Заболевания щитовидной железы занимают первое место в структуре эндокринопатий у беременных. Ведущим патогенетическим фактором в большинстве случаев является аутоммунный процесс [1].
В связи с этим особенно важны и интересны вопросы изучения взаимосвязи полиморфизма генов, кодирующих развитие аутоиммунных состояний, с тиреоидными нарушениями у женщин при беременности.
Одним из основных генетических локусов, ассоциированных с аутоиммунными заболеваниями щитовидной железы, является локус HLA-DR. Доказана роль ряда аллелей при развитии тиреопатий. Учитывая высокую распространенность тиреоидной патологии, актуален поиск взаимосвязи полиморфизма генов HLA-DR с развитием гипотиреоза у беременных.
Целью настоящей работы было исследование ассоциаций полиморфизма гена лейкоцитарного антигена человека II класса HLA-DRB1 с гипотиреозом у беременных российской популяции.
Материалы и методы исследования
В исследование были включены 178 женщин с одноплодной беременностью. Основную группу составили 65 женщин, у которых при проведении обследования был выявлен субклинический или манифестный гипотиреоз. Контрольную группу составили 113 беременных, не имеющих тяжелой экстрагенитальной патологии, эндокринопатий, акушерских и гинекологических осложнений (табл.1).
Женщины, включенные в исследование, были в возрасте от 19 до 41 года в обеих группах. Средний возраст, массо-ростовые показатели основной и контрольной группы не различались.
Анализировались данные семейного анамнеза. У женщин основной группы частота заболеваний щитовидной железы у ближайших родственников составила 32,3%. У 16,92% беременных в семейном анамнезе имелись указания на наличие других аутоиммунных заболеваний (сахарный диабет, ревматоидный артрит, антифосфолипидный синдром, миастения). Лишь у 9,73% женщин контрольной группы в семье имелась тиреоидная и другая аутоиммунная патология.
Определение тиреоидного статуса проводилось в конце 1-го – начале 2-го триместра беременности (10–16 недель).
Диагноз гипотиреоза был установлен на основании исследования уровня тиреотропного гормона (ТТГ) и свободного тироксина (Т4св) впервые во время данной беременности. Критерием для постановки диагноза был уровень ТТГ более 2,5 МЕ/л, нормальный или сниженный уровень Т4св. Референсный интервал для ТТГ составил 0,1–2,5 МЕ/л. У всех женщин также проведено определение уровня антител к тиреопероксидазе (АТ-ТПО) и к тиреоглобулину (АТ-ТГ). Позитивными считали женщин, у которых уровень антител превысил 35 МЕ/л. Анализировали данные семейного и личного анамнеза, наличие экстрагенитальной патологии, особое внимание уделяли выявлению аутоиммунных состояний.
Для генетических исследований использовали периферическую кровь, собранную в пробирки с ЭДТА. Кровь центрифугировали при 2500 об/мин в течение 10 мин, плазму отбирали и повторно центрифугировали при 13 000 об/мин в течение 5 мин. ДНК выделяли из 50 мкл крови с использованием комплекта реагентов для выделения ДНК «Проба-ГС» (ООО «НПО ДНК-Технология», Россия). Определение генного полиморфизма проводили с использованием набора реагентов для типирования генов гистосовместимости человека II класса (HLA-DRB1) методом амплификации ДНК (ООО «НПО ДНК-Технология», Россия).
Статистическая обработка данных выполнена с использованием пакета прикладных программ Statistica for Windows v. 8.0, StatSoft Inc. (CША). Оценку достоверности различия между несвязанными группами проводили с помощью критерия Манна–Уитни. Для оценки ассоциации полиморфизма HLA II с гипотериозом у беременных применяли метод χ2 и вычисление отношения шансов.
Результаты исследования
Основным лабораторным критерием диагностики гипотиреоза является уровень тиреотропного гормона, который достоверно различался в группах (табл. 1). Следует отметить, что в исследование включены женщины, у которых диагноз гипотиреоза был поставлен впервые при беременности. Субклинический гипотиреоз имел место у
59 (90,77%) женщин основной группы. Уровень Т4св у них был нормальным или находился на нижней границе референсных значений. Манифестный гипотиреоз характеризовался повышением уровня ТТГ и снижением Т4св и был диагностирован у 6 (9,23%) женщин основной группы.
У женщин обеих групп исследовали также уровень антител к тканям щитовидной железы. Достоверно чаще повышение титра АТ-ТПО и АТ-ТГ встречалось у женщин основной группы – в 73,85 и 75,38% соответственно по сравнению с контрольной группой, где эти показатели составили 8,85 и 9,73%.
Увеличение объема щитовидной железы – зоб I и II степени (по классификации ВОЗ) наблюдалось у 30,77% женщин с гипотиреозом, что достоверно отличалось от контрольной группы беременных (8,85%).
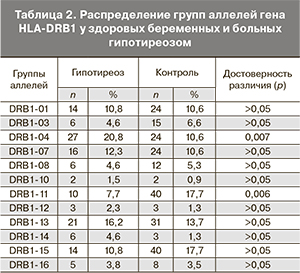 На основании сравнительного анализа распределения аллелей гена HLA-DRB1 у здоровых беременных и больных гипотиреозом описаны маркеры наследственной предрасположенности к заболеванию. Достоверное различие между исследуемыми группами было выявлено только по двум группам аллелей: DRB1*04 и DRB1*11. С повышенным риском развития гипотиреоза была ассоциирована аллельная группа DRB1*04. Ее частота в основной и контрольной группах составляли 20,8 и 10,6% соответственно (р=0,009; ОШ 2,21, 95% ДИ 1,21–4,04). И наоборот, присутствие аллельной группы DRB1*11 ассоциируется с устойчивостью к заболеванию, ее частота у больных составила 7,7 %, у здоровых – 17,7% (р=0,009; ОШ 0,39, 95% ДИ 0, 18–0,79) (табл. 2).
На основании сравнительного анализа распределения аллелей гена HLA-DRB1 у здоровых беременных и больных гипотиреозом описаны маркеры наследственной предрасположенности к заболеванию. Достоверное различие между исследуемыми группами было выявлено только по двум группам аллелей: DRB1*04 и DRB1*11. С повышенным риском развития гипотиреоза была ассоциирована аллельная группа DRB1*04. Ее частота в основной и контрольной группах составляли 20,8 и 10,6% соответственно (р=0,009; ОШ 2,21, 95% ДИ 1,21–4,04). И наоборот, присутствие аллельной группы DRB1*11 ассоциируется с устойчивостью к заболеванию, ее частота у больных составила 7,7 %, у здоровых – 17,7% (р=0,009; ОШ 0,39, 95% ДИ 0, 18–0,79) (табл. 2).
Обсуждение
Частота встречаемости тиреоидной патологии у беременных в последние годы имеет тенденцию к росту и достигает в некоторых странах 20–25% [2]. Во многом это обусловлено эндемическим йод-дефицитным фактором. Хорошо известно, что беременность сопряжена с изменением функции щитовидной железы. Вместе с тем во многих эпидемиологических и близнецовых исследованиях выявлена генетическая предрасположенность к заболеваниям щитовидной железы [3]. Интерес представляет вопрос о доле вклада генетических и средовых факторов в развитие патологии. В этой связи актуально определение группы риска женщин, у которых во время беременности может развиться гипотиреоз.
Аутоиммунная причина возникновения гипотиреоза в большинстве случаев не вызывает сомнений. Поэтому продолжаются исследования полиморфизма генов, регулирующих эти состояния. К числу генов, определяющих иммунологические взаимодействия, относится главный комплекс гистосовместимости, полиморфизм аллелей которого обусловливает предрасположенность к аутоиммунным заболеваниям.
Согласно данным генеалогических исследований, большинство больных с аутоиммунным тиреоидитом имеют отягощенную наследственность как по этому заболеванию, так и по другим аутоиммунным нарушениям (СКВ, ревматоидный артрит, тромбоцитопения, гемолитическая анемия, сахарный диабет и др.) [4]. В литературе широко обсуждается семейная предрасположенность к заболеваниям щитовидной железы. Так, еще в 1960 г. R. Hall и J. Stanbury показали, что у 33% братьев и сестер пациентов с гипо- или гипертиреозом развивается аутоиммунное заболевание щитовидной железы. А 56% братьев и сестер пациентов с аутоиммунными заболеванием щитовидной железы имеют антитела к ее тканям [5].
M. Dittmar и соавт. в своем исследовании указывают на 16-кратное увеличение риска развития аутоиммунных заболеваний щитовидной железы у детей от пациентов с уже имеющейся аналогичной патологией [6].
Наиболее достоверными в изучении роли генетической предрасположенности к тем или иным заболеваниям являются близнецовые популяционные исследования, базирующиеся на сопоставлении конкордантности у моно- и дизиготных близнецов. Анализ проведенных исследований показал достоверно более высокий уровень конкордантности у монозиготных по сравнению с дизиготными близнецами, что подтверждает роль генетических факторов в этиологии тиреопатий [7].
В ряде исследований выявлена взаимосвязь локуса HLA-DR с аутоиммунными заболеваниями щитовидной железы [8]. В настоящее время продолжается идентификация различных гаплотипов в развитии той или иной патологии. Большинство научных работ выявили ассоциации аллелей этого локуса с диффузным токсическим зобом. Данные в отношении развития гипотиреоза подчас противоречивы.
Проведенные нами исследования в группе беременных женщин подтверждают роль наследственной предрасположенности в развитии гипотериоза. У женщин носителей гена DRB1*04 гипотериоз выявлялся в два раза чаще, чем в контрольной группе. И наоборот, у носителей аллельной группы DRB1*11 выявлялся в 2,3 раза реже, чем в контроле, что указывает на возможную протекторную роль этой группы в развитии заболевания.
Повышенная частота аллеля DRB1*04 у пациентов с аутоиммунным гипотериозом независимо от пола была показана также в индийской и бразильской популяциях [9, 10].
Представляет интерес тот факт, что одновременно повышенная частота группы аллелей DRB1*04 и сниженная частота DRB1*11 выявлялась также при таких аутоиммунных заболеваниях, как ревматоидный артрит [11], сахарный диабет [12], желчный цирроз печени [13], обыкновенной пузырчатке [14]. Считается, что основной функцией антигенов гистосовместимости является узнавание определенных групп антигенов, которые видимо специфичны конкретным патологиям, и представление этих антигенов для специфического ответа иммунной системы [15]. Выявленная нами схожесть представленности по группам антигенов DRB1*04 и DRB1*11 при вышеперечисленных аутоиммунных патологиях указывает на некоторую общность механизмов возникновения этих заболеваний.
Полученные в работе результаты подтверждают важную роль аутоиммунных процессов в развитии гипотериоза, которую мы выявили у беременных женщин. Об этом же говорит и высокая частота носительства антител к тканям щитовидной железы у пациенток основной группы, особенно при выявленном полиморфизме аллеля DRB1*04. При этом беременность и дефицит йода могут служить дополнительными внешними факторами в реализации этой патологии. Также обращает на себя внимание факт более высокой частоты встречаемости других аутоиммунных заболеваний в семейном анамнезе у женщин с гипотиреозом и наличие у большинства женщин антител к тканям щитовидной железы.
При отсутствии генетической предрасположенности на фоне дефицита йода при беременности не всегда развивается гипотиреоз, поскольку этот дефицит, видимо, может быть компенсирован интенсификацией работы систем, обеспечивающих синтез тиреоидных гормонов. При этом определенную роль могут играть и другие защитные факторы.
Заключение
Выявлена достоверная взаимосвязь полиморфизма аллельной группы DRB1*04 с развитием гипотиреоза у беременных и протекторная роль аллельной группы DRB1*11, что позволяет сделать вывод о важной роли генетического полиморфизма в возникновении заболеваний щитовидной железы.




