Ожирение является важной проблемой здравоохранения. Оно широко распространено в различных популяциях людей, в том числе среди женщин репродуктивного возраста [1]. Доказано, что пациентки с индексом массы тела (ИМТ) ≥25 кг/м2 чаще страдают репродуктивными нарушениями, имеют меньше шансов наступления беременности после экстракорпорального оплодотворения (ЭКО) и более высокий риск различных осложнений беременности по сравнению с женщинами с ИМТ <25 2="" 2="" 11="" p="">
Лептин и адипонектин – это пептидные гормоны, синтезируемыми жировой тканью, основными функциями которых является регуляция энергетического обмена. В последнее время появились данные о роли адипокинов не только в развитии ожирения и поддержании энергетического гомеостаза, но и в регуляции репродуктивных функций человека [12–19].
Уровень лептина в крови у женщин с высоким (>25 кг/м2) ИМТ повышен, а адипонектина – понижен, что приводит к дисрегуляции половых гормонов, нарушению фолликуло-/оогенеза и раннего эмбриогенеза. Доказано, что лептин может регулировать овуляцию, стимулируя протеолиз и высвобождение содержимого фолликулов [12–15]. Также существуют данные о плейотропном влиянии лептина на репродукцию. Так, усиление экспрессии лептина в плаценте усиливает пролиферацию и дифференцировку трофобластных клеток [16].
Описаны полиморфизмы гена лептина (LEP) и его рецепторов (LEPR), кодирующих уровень и активность адипокинов у человека [20, 21], которые приводят к ожирению [22, 23], нарушению гонадотропной функции гипофиза [24], гестационному сахарному диабету [25], самопроизвольным выкидышам [25], преэклампсии [26] и другим нарушениям репродуктивной функции.
Цель исследования: оценить роль адипокинов и генов-регуляторов адипокинов в эффективности программ ВРТ у пациенток с избыточной массой тела.
Материал и методы исследования
В проспективное когортное исследование были включены 147 пациенток с трубно-перитонеальным фактором бесплодия, нормальным кариотипом, ИМТ ≥18,0 кг/м2, отсутствием противопоказаний к проведению ВРТ и подписанным информированным согласием на участие в исследовании. Критерием исключения было наличие патоспермии у супруга, а также развитие осложнений, требующих отмены переноса эмбрионов в изучаемом цикле.
Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий (ВРТ), противопоказаниях и показаниях к их применению» [27].

Стимуляция функции яичников проводилась с применением рекомбинантного фолликулостимулирующего гормона (рФСГ) или комбинированного препарата рФСГ и лютеинизирующего гормона и назначением антагонистов гонадотропин-рилизинг-гормона (ант-ГнРГ). Триггер овуляции вводился при наличии лидирующих фолликулов диаметром 17 мм и более. В качестве триггера использовались человеческий хорионический гонадотропин (ЧХГ) в дозе 7500–10 000 МЕ, а при риске развития синдрома гиперстимуляции яичников – агонист гонадотропин-рилизинг-гормона (а-ГнРГ) в дозе 0,2 мг, или сочетание а-ГнРГ с ЧХГ в дозе 1500 МЕ. Трансвагинальную пункцию яичников (ТВП) осуществляли через 36 часов после введения триггера овуляции. Перенос эмбрионов в полость матки производили на 5-е сутки культивирования. В полость матки переносили один эмбрион лучшего качества. Поддержка лютеиновой фазы индуцированного цикла у всех пациенток проводилась по стандартному протоколу с назначением натурального микронизированного прогестерона интравагинально в дозе 600 мг в сутки после ТВП. Если в качестве триггера овуляции был использован а-ГнРГ, или сочетание а-ГнРГ с ЧХГ в дозе 1500 МЕ, для поддержки лютеиновой фазы назначали эстрадиола валерат в дозе 6 мг в сутки. При наличии подъема уровня сывороточного ЧХГ через 14 дней после переноса эмбрионов в полость матки регистрировали биохимическую беременность, а при визуализации плодного яйца в полости матки через 21 день после переноса – клиническую беременность.
 Определение уровня адипокинов (лептина, адипонектина) в плазме крови проводили на мультиплексном анализаторе Luminex 200 (Luminex Corporation, США). Процедуру измерения проводили в соответствии с инструкцией производителя наборов. Расчет концентрации белков в плазме крови осуществляли по калибровочной кривой в программе Luminex 100 IS 2.3 (Luminex Corporation, США).
Определение уровня адипокинов (лептина, адипонектина) в плазме крови проводили на мультиплексном анализаторе Luminex 200 (Luminex Corporation, США). Процедуру измерения проводили в соответствии с инструкцией производителя наборов. Расчет концентрации белков в плазме крови осуществляли по калибровочной кривой в программе Luminex 100 IS 2.3 (Luminex Corporation, США).
Анализ полиморфизма генов, регулирующих уровень адипокинов, проводился методом полимеразной цепной реакции (ПЦР) с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes) с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия. Определяли следующие генные варианты: LEP: c.-2548 (2453) G>A [rs7799039], LEPR: c.818(853) A>G (Gln223Arg) [rs1137101] и LEPR: c.476 (511) A>G (Lys109Arg) [rs1137100].
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Первичной конечной точкой было скорректированное по конфаундерам отношение шансов (ОШкор) наступления клинической беременности и живорождения в зависимости от массы тела пациенток, оцененное с помощью многофакторного анализа – логистической регрессии. Статистический анализ проводился с применением χ2-теста для оценки частотных показателей, t-теста и ANOVA для сравнения средних, а также многофакторного регрессионного анализа (логистической регрессии) для расчета ОШкор. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Результаты исследования
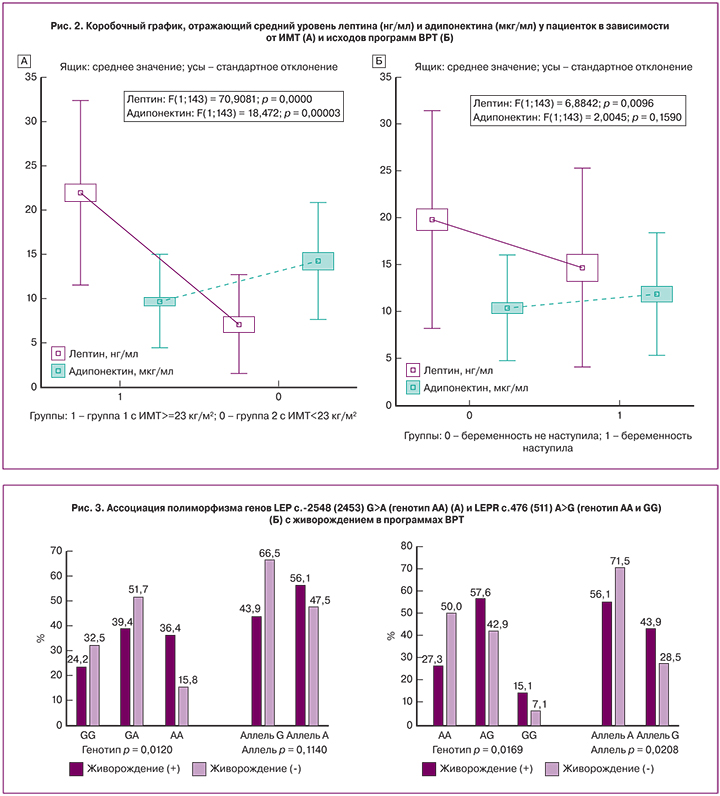
В исследование были включены 147 пациенток: 82 пациентки с избыточной массой тела и ожирением (ИМТ ≥25 кг/м2) и 65 пациенток с нормальной массой тела (ИМТ =18,0–24,9 кг/м2). Для стратификации на группы нами было найдено пороговое значение ИМТ, ниже которого шансы наступления беременности, а также достоверность модели и площадь под кривой (AUC) были максимальными. При проведении ROC-анализа порогом отсечки с максимальной площадью под кривой стал ИМТ =23 кг/м2 (AUC=0,606). Группу 1 составили 106 пациенток с ИМТ ≥23 кг/м2, группу 2 – 41 пациентка с ИМТ <23 2="" p="">
Средний возраст пациенток составил 32,1±3,7 года и 31,2±3,1 года в группах 1 и 2 соответственно (p=0,2059). При анализе антропометрических данных было выявлено различие в показателях веса и, как следствие, ИМТ пациенток (р<0,0001). Пациентки двух групп не отличались по менструальной функции, гинекологической и соматической заболеваемости и паритету. В группе 2 было больше курящих пациенток (р=0,0099). Продолжительность бесплодия была выше у пациенток в группе 1 (р=0,0078). При анализе особенностей протоколов ЭКО было отмечено, что суммарная доза препаратов гонадотропинов, длительность стимуляции суперовуляции и вид протокола стимуляции были сопоставимы в 2 группах. В группе 1 было получено меньше ооцитов (р=0,0047), зрелых ооцитов (р=0,0069) и зигот (р=0,0151). При этом число бластоцист, в том числе отличного качества, было сопоставимо в группах сравнения. У пациенток группы 1 чаще проводили фертилизацию ооцитов методом ИКСИ (р=0,0015) (табл. 1).

У пациенток с ИМТ ≥23 кг/м2 отмечалось статистически значимо меньшее число клинических беременностей (р=0,0011) и живорождений (р=0,0106) по сравнению с пациентками с ИМТ <23 2="" 1="" 3="" 4="" 95="" 1="" 6="" 7="" 2="" 2="" 8="" 95="" 1="" 2="" 6="" 4="" p="">
При оценке уровня адипокинов было выявлено, что у пациенток с ИМТ ≥23 кг/м2 по сравнению с пациентками с ИМТ <23 2="" 21="" 9="" 10="" 5="" 7="" 1="" 5="" 6="" 9="" 7="" 5="" 3="" 14="" 3="" 6="" 6="" 2="" 2="" p="">
Нами были найдены пороговые значения уровня лептина и адипонектина, ниже и выше которых, соответственно, шансы наступления беременности, а также достоверность модели и площадь под кривой (AUC) были максимальными. При проведении ROC-анализа порогами отсечки с максимальной площадью под кривой стали уровень лептина >18 нг/мл (AUC=0,600), уровень адипонектина ≤7 мкг/мл (AUC=0,586).
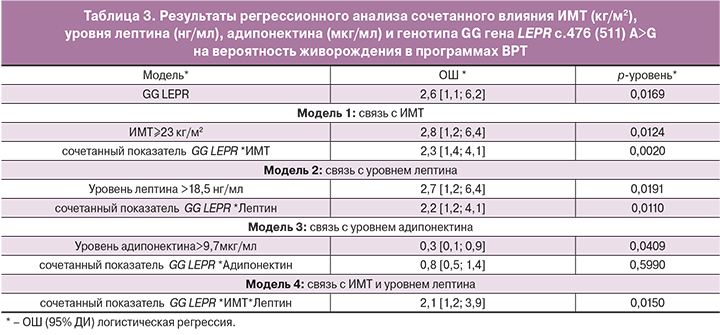
Среди пациенток, родивших живых детей (n=33), значимо чаще отмечалось наличие генотипа АА гена LEP c.-2548 (2453) G>A (ОШ=3,0; 95% ДИ=1,3; 7,3), реже – наличие генотипа АА и чаще – генотипа GG гена LEPR c.476 (511) A>G (ОШ=2,1; 95% ДИ=1,1; 3,9) (рис. 3).
При оценке уровней адипокинов в зависимости от выявленного полиморфизма генов, более высокий уровень адипонектина и более низкий, хотя и не статистически значимый, уровень лептина отмечался у пациенток, имеющих генотип GG гена LEPR c.476 (511) A>G (табл. 2).
Таким образом, в однофакторном анализе был выявлен ключевой полиморфизм, определяющий эффективность программ ВРТ в зависимости от уровня адипокинов. Генотип GG гена LEPR c.476 (511) A>G был ассоциирован с более низким уровнем лептина и высоким уровнем адипонектина, а также с большей вероятностью живорождения в программах ВРТ. Таким образом, данный генотип играет защитную роль в обмене адипокинов, а также ассоциирован с позитивными исходами программ ВРТ. Мы проанализировали влияние генотипа GG гена LEPR c.476 (511) A>G на исходы программ ВРТ в зависимости от ИМТ, уровня лептина и адипонектина. Данные по оценке сочетанного влияния концентрации ИМТ и SNP гена LEPR c.476 (511) A>G на исходы программ ВРТ представлены в табл. 3. Для данного анализа проводился регрессионный скорректированный анализ с учетом уровня лептина и адипонектина. Вероятность живорождения значимо повышалась при понижении ИМТ и уровня лептина. Сочетанный показатель GG LEPR c.476*ИМТ*Лептин значимо влиял на вероятность живорождения.
Обсуждение
Ожирение и избыточная масса тела играют важную роль в генезе репродуктивных нарушений, повышая риск бесплодия, неудач ЭКО и неблагоприятных исходов беременности [2–11, 28]. Анализ большой когорты женщин показал, что фертильность значимо снижается при ИМТ >23,9 кг/м2 [11]. В нашем исследовании пороговым ИМТ, ниже которого вероятность наступления беременности в программах ЭКО была максимальной, был 23 кг/м2.
При ИМТ ≥23 кг/м2 шансы наступления беременности были в 3,4 раза ниже (95% ДИ 1,6; 7,2) по сравнению с ИМТ <23 2="" 2="" 8="" 95="" 1="" 2="" 6="" 4="" -="" 10="" 28="" p="">
Одной из причин нарушения репродуктивной функции у женщин с избыточной массой тела является нарушение секреции адипокинов [10, 29].
Адипокины – это цитокины, секретируемые преимущественно адипоцитами. К ним относятся лептин и адипонектин, а также неспецифические для жировой ткани адипокины: фактор некроза опухолей-α (TNFα), интерлейкин-6 (IL-6) и другие. Нарушение обмена адипокинов приводит к воспалению и аномальной клеточной сигнализации, и как следствие, к нарушению метаболизма и функции клеток [12–19]. Было показано, что у людей с ожирением такие адипокины, как лептин, TNF-α и IL-6 увеличиваются, а «полезные адипокины», такие как адипонектин, снижаются из-за дисфункции жировой ткани [14, 15, 18, 19, 30]. В нашем исследовании у пациенток с ИМТ ≥23 кг/м2 по сравнению с пациентками с ИМТ <23 2="" p="">
Лептин оказывает стимулирующее действие на гипоталамо-гипофизарную ось вследствие инициации сигнала для созревания гипоталамуса. Он ингибирует инсулин-индуцированный стероидогенез в яичниках, воздействуя на тека- и гранулезные клеточные рецепторы, ингибирует ЛГ-зависимый синтез эстрадиола в гранулезных клетках. Еще одним эффектом лептина на репродуктивную функцию является регуляция раннего эмбриогенеза [12]. Адипонектин стимулирует усвоение глюкозы в печени и мышцах, блокирует глюконеогенез в печени, влияет на синтез липидов, энергетический гомеостаз и вазодилатацию, снижает накопление триглицеридов и повышает чувствительность к инсулину [15, 18, 19]. При снижении адипонектина у женщин с ожирением уровень инсулина в плазме крови увеличивается, что приводит к гиперандрогении.
Повышение уровня лептина приводит к нарушению фолликуло- и оогенеза, к дефектам развития эндометрия, а также дефектам имплантации и раннего эмбриогенеза, которые негативно влияют на женскую фертильность [13, 14]. В нашем исследовании уровень лептина был выше у пациенток, у которых беременность в программе ВРТ не наступила, что подтверждает негативное влияние лептина на репродуктивную функцию. Нами также были установлены пороговые значения лептина и адипонектина, выше и ниже которых шансы наступления беременности были максимальными (≤18 нг/мл для лептина и >7 мкг/мл для адипонектина).
Уровень в крови как лептина, так и адипонектина может зависеть от состояния генов-регуляторов адипокинов. Ген лептина (LEP) человека экспрессируется в белой жировой ткани, желудке и плаценте. Мутации гена LEP изменяют секрецию гормона лептина, что вызывает наследственное ожирение. Ген рецептора лептина (LEPR) кодирует трансмембранный рецептор, через который ген лептина (LEP) регулирует массу жировой ткани и расходы энергии. Рецепторы лептина присутствуют не только в жировой ткани, но и в других органах и тканях (гипоталамусе, печени, скелетной мускулатуре, поджелудочной железе, яичниках, плаценте, почках, легких). Точечные мутации в гене LEPR: 818(853) A>G и 476 (511) A>G приводят к нарушению сплайсинга и блокируют экспрессию длинной формы рецептора. При таких заменах в гене нарушается синтез рецептора и проведение гормонального сигнала. Единичная точечная замена Gln223Arg или Lys109Arg приводит к аминокислотной замене и, как следствие, к изменению функциональных особенностей рецептора.
Существуют данные по связи SNP гена LEP: -2548 (2453) G>A с повышением уровня лептина и риска ожирения. Так, по данным Hoffstedt и соавт. (2002), носители генотипа AA имели уровень сывороточного лептина выше чем, носители генотипов GA/GG. Секреция лептина жировой тканью при генотипе АА увеличивалась в 2 раза, а уровень лептиновой мРНК был на 60% выше. Таким образом, полиморфизм (-2548G>A) гена лептина на транскрипционном уровне влияет на экспрессию лептина [20]. В исследовании EPIC-Heidelberg (2002) была обнаружена роль гомозиготного генотипа гена LEP: –2548 AA в развитии ожирения. Полиморфизм коррелировал с уровнем сывороточного лептина и лептиновой мРНК [22]. Также ассоциация полиморфизма с уровнем лептина и ожирением была показана и в других исследованиях [23]. Существуют также данные по связи SNP гена LEPR: 818(853) A>G с повышенным уровнем лептина. В исследовании O. Ukkola и соавт. (2000) было выявлено, что генотип АА LEPR: 818(853) A>G был связан с повышенным содержанием лептина в плазме и не был связан с повышением ИМТ [21]. В нашем исследовании не было выявлено связи SNP гена LEP –2548 G>A и LEPR: 818(853) A>G с уровнем адипокинов и массой тела. Однако был отмечен более высокий уровень адипонектина и более низкий, хотя и не статистически значимый, уровень лептина у пациенток, имеющих генотип GG гена LEPR c.476 (511) A>G. Мы не нашли данных литературы по связи данного SNP с уровнем адипокинов.
Существуют данные по связи SNP генов LEP и LEPR с негативными исходами беременности и репродуктивными нарушениями. Так, в исследовании J.A. Vaskú и соавт. (2006) было выявлено, что наличие аллеля А (генотипы АА и AG) гена LEP: -2548 (2453) повышало риск развития гестационного сахарного диабета в 2,8 раза. Также генотип АА увеличивал риск самопроизвольного аборта в 2 раза [25]. В работе J. Rigó и соавт. (2006) генотипы AG или GG LEPR 818(853) A>G увеличивали риск развития преэклампсии в 2 раза [26]. В нашем исследовании у пациенток, родивших живых детей, значимо чаще отмечалось наличие генотипа АА гена LEP c.-2548 (2453) G>A, что не согласуется с имеющимися литературными данными. SNP гена LEPR 818(853) A>G не оказывал влияния на наступление беременности и живорождение в нашем исследовании. Также у пациенток, родивших живых детей, в 2,1 раза реже отмечалось наличие генотипа АА и чаще – генотипа GG гена LEPR c.476 (511) A>G. Мы не нашли данных литературы по связи данного гена с репродуктивными нарушениями и исходами беременности.
Заключение
Таким образом, в нашем исследовании единственным SNP, определяющим эффективность программ ВРТ в зависимости от уровня адипокинов, был генотип GG гена LEPR c.476 (511) A>G, который был ассоциирован с более низким уровнем лептина и высоким уровнем адипонектина, а также с большей вероятностью живорождения в программах ВРТ. Таким образом, данный генотип играет защитную роль в обмене адипокинов, а также ассоциирован с позитивными исходами программ ВРТ. При проведении регрессионного скорректированного анализа вероятность живорождения повышалась в 2,1 раза при понижении ИМТ и уровня лептина при наличии генотипа GG гена LEPR c.476 (511) A>G.



