Последнее десятилетие отмечена тенденция к увеличению частоты гиперпластических процессов матки [1, 2]. Актуальность поиска патофизиологических механизмов развития лейомиомы матки и аденомиоза обусловлена широкой распространенностью заболеваний среди женщин репродуктивного возраста и высокой частотой оперативных методов лечения. В России каждая четвертая женщина рано или поздно рискует оказаться перед сложным решением о необходимости оперативного вмешательства [3, 4].
Механизмы опухолевого роста складываются из динамического баланса процессов пролиферации и апоптоза [5]. Одним из ключевых факторов в развитии опухолевых процессов, в настоящее время рассматривается ангиогенез [6]. Индуктором ангиогенеза является сосудистый эндотелиальный фактор роста (VEGF), поддерживающий развитие сосудистой сети опухоли [7]. Известно, что VEGF, с одной стороны препятствует апоптозу незрелых клеток эндотелия, с другой – подавляет созревание дендритных клеток и блокирует нормальный иммунный ответ на опухоль, подавляя эффекторные функции цитотоксических клеток. Установлено, что экспрессия VEGF повышена при аденомиозе и, чем сильнее, тем хуже прогноз при лечении [8]. Напротив, процессы неоангиогенеза в псевдокапсулах миоматозных узлов обеспечиваются иными факторами роста, а роль VEGF при этом не существенна [9].
Помимо факторов, стимулирующих ангиогенез, при миоме активно экспрессируется хемокин интерлейкин (ИЛ)-8 в миометрии [10]. Считается, что хемокины, ИЛ-6 и фактор некроза опухоли (ФНО)-α стимулируют экспрессию факторов роста при данной патологии [11]. При этом экспрессия рецептора ИЛ-8 – CXCR1 на поверхности эутопического эндотелия в пролиферативной фазе повышена и при аденомиозе, однако снижена экспрессия самого ИЛ-8 в культурах эндотелиальных стромальных клеток [12]. Известно, что синтез ИЛ-8 и других цитокинов модулируется лактоферрином (ЛФ) – металлопротеином и осрофазовым реактантом [13], однако роль данного белка в патогенезе аденомиоза и миомы не изучена.
Значительную роль в патогенезе миомы играет баланс протеиназ, особенно матриксных металлопротеиназ (ММП) и их ингибиторов. Известно, что повышенные уровни VEGF в крови при миоме коррелируют с содержанием ММП [14]. Маркером прогрессии лейомиомы является активация экспрессии такого ингибитора протеиназ как α1-антитрипсин (α1-АТ). Повышение сывороточного уровня α1-АТ ассоциируется с ростом опухоли, как и лейцин-обогащенного α2-гликопротеина [15], который по свойствам дублирует ассоциированный с беременностью α2-гликопротеин (АБГ) [16] и, вероятно, является его низкомолекулярным обломком. Известно, что α2-макроглобулин (α2-МГ) является не только универсальным ингибитором протеиназ, но и активным транспортером цитокинов и факторов роста, регулирующим их синтез по типу обратной связи [16], при этом роль α2-МГ в патогенезе миомы и аденомиоза также не установлена.
Целью работы было установление взаимосвязей между цитокинами, фактором роста VEGF и регуляторно-транспортными белками при развитии лейомиомы и аденомиоза у женщин перименопаузального возраста.
Материал и методы исследования
Обследованы 65 пациенток с верифицированным диагнозом, сопоставимых по возрасту и оперированных в МЛБУ ГКБ № 1 г. Новокузнецка за период 2010–2013 гг. В группу больных с миомой матки вошли 38 больных, из них 14 пациенток (43±1,3 года) – с простой и 24 женщины (46,5±0,95 года) – с пролиферирующей миомой. Группу с аденомиозом составили 10 женщин (48,3±2,7 года), 17 пациенток (47,4±1,2 года) имели сочетание миомы матки и аденомиоза. Показаниями для оперативного лечения были размеры матки более 12 недельного срока беременности в сочетании с меноррагией (87%), приводящей к анемии и, в ряде случаев, в связи с нарушением функции соседних органов. Контрольную группу составили 16 практически здоровых женщин в возрасте (45±0,9 года), обратившихся с целью профилактического осмотра. У всех женщин основной и контрольной групп было получено информированное согласие на участие в исследовании.
Образцы венозной крови были получены до операции. Сывороточные уровни α2-МГ, ассоциированного с беременностью АБГ, α1-АТ изучены количественным ракетным иммуноэлектрофорезом с использованием исследовательских тест-систем, разработанных в НИЛ иммунологии ГБОУ ДПО ГНИУВ Минздрава России. Содержание ЛФ, цитокинов (ИЛ-6, ИЛ-8, ФНО-α) и VEGF определено иммуноферментным анализом с использованием коммерческих тест-систем «Вектор-Бест», Россия. Статистическая обработка полученных результатов проведена с использованием компьютерной программы InStat II.
Результаты
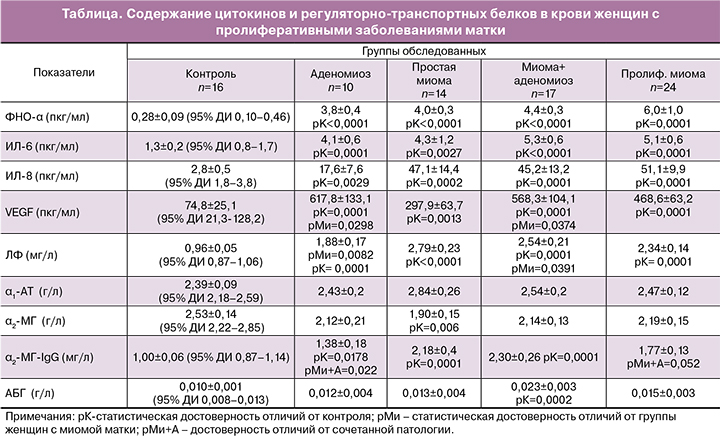
Согласно полученным данным (см. таблицу), уровень фактора роста VEGF был значимо повышен во всех группах больных, в сравнении с контролем. Примечательно, что при аденомиозе его уровень в 8 раз превышал контроль и был значимо выше показателей больных простой миомой матки. Содержание VEGF в сыворотке крови пациенток с сочетанной патологией (аденомиоз±миома) было сопоставимо с его уровнем в группе больных аденомиозом, но несколько ниже, однако достоверно выше, в сравнении с показателями здоровых женщин и больных простой миомой (в 7,5 и 1,9 раза соответственно). Концентрация VEGF в сыворотке пациенток с пролиферирующей миомой статистически значимо отличалась только от контрольных значений.
Концентрации классического провоспалительного цитокина ФНО-α как и иммуномодуляторного ИЛ-6, были сопоставимы в группах больных и повышены, в сравнении со здоровыми (в 13–21 раз и в 3–4 раза соответственно), однако, в целом, не демонстрировали выраженного повышения, по сравнению с предельно допустимыми уровнями для здоровых женщин (5 пкг/мл).
Любой пролиферативный процесс в матке сопровождался значительным повышением уровня ИЛ-8: при аденомиозе в 6 раз превышая нормативные значения, при пролиферирующей миоме – почти в 20 раз, при простой миоме и при ее сочетании с аденомиозом – более чем в 15 раз.
Сывороточное содержание ЛФ во всех группах больных статистически значимо повышалось в сравнении с нормой (в 2–3 раза), при этом у пациенток с простой миомой было самым высоким и достоверно выше в сравнении с показателями больных аденомиозом и с показателями пациенток с сочетанной патологией (аденомиоз±миома).
Концентрация α1-АТ, также являющегося позитивным реактантом воспаления, не демонстрировала достоверных отличий от контрольной группы, хотя в сыворотке больных простой миомой наблюдалась недостоверная тенденция к повышению (в среднем, на 15%).
При этом уровни α2-МГ, еще одного активного ингибитора протеиназ, относящегося, в отличие от α1-АТ, к негативным реактантам воспаления, в среднем были несколько снижены, однако достоверное снижение обнаружено лишь в группе больных с простой миомой матки. При этом содержание иммунокомплекса α2-МГ-IgG было достоверно повышено у больных (в 1,3–2,3 раза), особенно при простой миоме матки и ее сочетании с аденомиозом.
Значимо повышенный по сравнению со здоровыми уровень АБГ, являющегося резервным гомологом α2-МГ, выявлен только у женщин с сочетанной патологией (в 2,3 раза).
Обсуждение
Патогенез миомы матки позиционируется как патологическая реакция на повреждение, где основным звеном патогенеза является ишемия и гипоксия [4]. Повреждение, как правило, играет роль триггера в развитии патологического процесса, активируя защитные механизмы, моделирующие апоптоз, ангиогенез и пролиферацию. Необходимо отметить, что одним из самых чувствительных острофазовых реактантов, взаимозависимо активирующим синтез хемоаттрактанта ИЛ-8, является ЛФ, что мы и наблюдали в нашем исследовании. Кроме того, данный белок является еще и активным транспортером железа, а также ионов кислорода [13]. Метаболические реакции, призванные регулировать структурную кинетику тканей в условиях нормального функционирования организма, могут усугублять повреждающее действие исходной гипоксии [17, 18]. В настоящее время роль метаболических реакций общепризнанна и универсальна как для деструктивных, так и гиперпластических процессов в тканях [19].
При срыве защитных механизмов, антипротеазной, антиоксидантной систем, агенты и метаболиты воспаления способны, в некоторых случаях, модифицировать нуклеиновые кислоты и, повреждая нити ДНК, приводить к формированию измененного клона клеток и патологической пролиферации [20]. Известно, что чрезмерное окислительное повреждение белков может реализоваться дегенеративными заболеваниями, а неконтролируемое перекисное окисление липидов – атеросклерозом [21]. Любое повреждение провоцирует воспалительную реакцию, лежащую в основе любого патологического процесса, но программа ответа может оказаться либо несовершенной, либо не вполне соответствовать конкретной ситуации. В этой связи, обращает на себя внимание, что из двух изученных основных (α2-МГ и α1-АТ) и одного резервного (АБГ) ингибиторов протеиназ [16], только уровень α2-МГ демонстрирует тенденцию к активному расходованию, превращающуюся в достоверную при миоме матки. При этом накопление α1-АТ не достоверно и не критично, а содержание АБГ, белка с выраженными иммуносупрессивными свойствами [16], повышено только при сочетанной патологии. Повышение концентраций иммунокомплексов α1-МГ-IgG в крови больных свидетельствует об активном повреждении молекул α2-МГ продуктами воспалительной реакции, усиливающим их иммуногенность с формированием аутоантител и крайне негативно влияющим на регуляцию синтеза цитокинов данным белком [16]. Все это, с одной стороны, свидетельствует о том, что организм до определенной степени справляется с утилизацией протеиназ, активно высвобождающихся при воспалении, а с другой, с учетом недостаточно активного синтеза ИЛ-6 и ФНО-α, может служить подтверждением неадекватной реакции организма на патологические изменения.
Так или иначе, гладкомышечные клетки миометрия реагируют на повреждение и гипоксию, точно так же, как и гладкомышечные клетки сосудистого эндотелия, а именно: каскадом пролиферативных преобразований и синтезом факторов роста, в том числе VEGF, который первый откликается на гипоксию, что и подтверждают результаты нашего исследования.
Заключение
В целом, полученные результаты согласуются с данными литературы и демонстрируют, что в случае миомы матки, «патологический круг» замыкается между провоспалительным процессом, пролиферацией и апоптозом, что позиционирует миому матки как воспалительную реакцию на повреждение и опухолевидное образование по типу «регенераторного пролиферата» [4]. В случае аденомиоза, воспалительные и иммунные ответы замыкают «порочный круг» на ангиогенезе, что позволяет провести параллель между аденомиозом и неопластическими процессами. Результаты нашего исследования созвучны с литературными данными, трактующими эндометриоидную болезнь как гиперпластический процесс, имеющий типовые этапы морфогенеза опухолевого роста [22]. В свою очередь, при сочетании миомы и аденомиоза имеет место некое объединение иммуносупрессии и провоспалительных реакций, что создает программу ответа, свойственную, согласно нашим данным, аутоиммунным проявлениям воспаления.



