Уменьшение перинатальной патологии есть главный фактор сохранения здоровья рождающегося поколения [2, 7, 8]. Врожденные пороки сердца (ВПС) – это структурная патология сердца, имеющаяся при рождении ребенка независимо от того, когда впервые она выявлена. Частота ВПС определяется отношением числа детей с пороком к общему числу родившихся и приблизительно составляет 1 на 100 родившихся [2, 3, 9]. У части больных ВПС не представляют жизненной угрозы в раннем возрасте. Небольшие дефекты межжелудочковой перегородки и межпредсердные сообщения, открытый артериальный проток с возрастом иногда могут спонтанно уменьшаться и закрываться полностью. Другие ВПС, например умеренный стеноз устья аорты, в раннем возрасте могут протекать благоприятно и требуют операции лишь к 8–10 годам. Однако половина ВПС считается «критическими ВПС периода новорожденности», т.е. пороками, при которых большинство пациентов не доживают до первого года жизни, а 1/3 таких детей умирают после рождения в первые дни или недели жизни [4, 5, 12]. Такие больные требуют немедленной консультации в кардиохирургическом центре для уточнения диагноза и проведения неотложной операции. По официальным данным, в последние десятилетия неизменно регистрируется общий рост врожденной сердечной патологии среди новорожденных, несмотря на общее снижение младенческой и неонатальной смертности в России [9]. Исследование региональных коэффициентов неонатальной смертности, представленное в 2009 г. United Nations Children’s Fund (UNICEF), демонстирирует достаточно высокий уровень этого показателя в странах ЦВЕ/СНГ, достигающий 15 неонатальных смертей на 1000 живорожденных детей. Кроме этого анализ летальности показывает, что младенческая смертность остается высокой и в наши дни, причем 60% составляет смертность в течение первого месяца жизни. За последние 15 лет наблюдений (с 1995 по 2008 г.) врожденные аномалии неизменно являются основной причиной летальности в этот период, составляя от 24,8 до 27,4% причин смерти. Причем на долю врожденной патологии системы кровообращения с 1965 по 2005 г. неизменно приходится почти 40% (43,8% – в 1965 г., 47,8% – в 2005 г.)[8, 9].
Ранняя хирургическая коррекция ВПС, и, прежде всего, увеличение объема хирургических вмешательств, выполняемых в период новорожденности и у детей первого года жизни, делают необходимым изучение общепедиатрических проблем, имеющихся в этих возрастных группах, и влияющих на состояние детей с ВПС, тактику их ведения, прогноз лечения и исход самого заболевания [10, 11].
Успех решения данной проблемы в настоящее время определяется исключительно вопросами
организации и обеспечения неонатальной кардиологической и кардиохирургической служб [2,
3]. Зарубежный опыт свидетельствует [10, 13], что гибель более 50% плодов и новорожденных может быть предотвращена при наличии правильно организованной и функционирующей системы перинатальной, в том числе ранней неонатальной помощи.
Организация специализированной кардиохирургической помощи новорожденным: глобальная модульная система
Основными задачами системы перинатального здоровья (рис. 1), сформулированными в последние годы в мировой детской кардиологической практике, являются [2]:
· Пренатальное наблюдение.
· Родовспоможение и помощь родильнице.
· Неонатальная помощь.
· Консультативная помощь.
· Возможность транспортировки.
· Продвижение исследовательских программ и развитие.
· Обеспечение наблюдения в регионе (по месту жительства).
· Наблюдение за эффективностью и координация программ с системой общего здоровья населения.
Рисунок 1. Принципы организации и взаимодействия глобальной модульной системы.
Анализ ситуации показал, что успех решения данной проблемы в настоящее время в значительной
мере определяется вопросами организации и обеспечения кардиологической и кардиохирургической
служб. Таким образом, с учетом тяжелого течения ряда ВПС у детей на первом году жизни и связанной с этим высокой смертности в этой возрастной группе, внимание педиатров и детских кардиологов должно быть направлено, главным образом, на оказание экстренной квалифицированной помощи
пациентам сразу после рождения. Задача создания этой системы и ее внедрения в практическое здравоохранение предполагает определение этапов оказания этой помощи и разработку лечебно-диагностических алгоритмов ведения новорожденных с критическими ВПС.
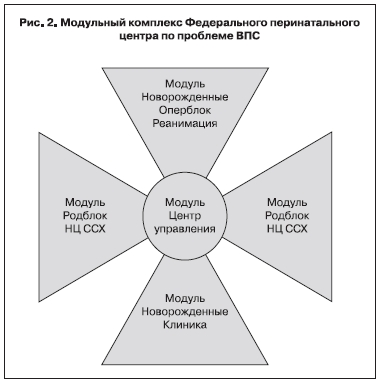
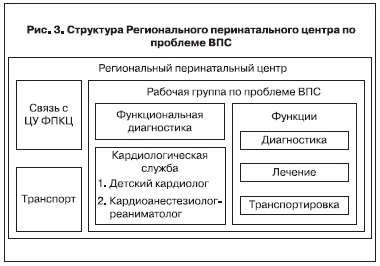
Общие принципы такого взаимодействия (рис. 1) можно представить в виде многоэтапного модульного комплекса, который определяет и регулирует взаимоотношения специализированного Федерального перинатального кардиохирургического центра (рис. 2) и Региональной группы по проблеме ВПС (рис. 3). Региональная группа по проблеме ВПС – это структурное подразделение Регинального перинатального центра, через который осуществляется связь с Федеральным центром по проблеме и при необходимости решаются вопросы транспортировки пациентов. Основные функции Рабочей группы включают диагностику пороков сердца, проведение патофизиологического и симптоматического лечения и при необходимости транспортировку новорожденных с ВПС. Поэтому в состав Рабочей группы должна быть включена кардиологическая служба (детский кардиолог и анестезиолог-реаниматолог) и сотрудники службы функциональной дигностики. При этом все специалисты должны владеть методами диагностики ВПС (в том числе эхокардиографией), базовыми вопросами интенсивной терапии и кардиореанимации новорожденных. Являясь основным звеном по проблеме ВПС в регионе, Рабочая группа решает следующие задачи:
· Выездные консультации по области.
· Учет патологии в области.
· Образование.
· Решение организационых вопросов (квота, согласие родителей и др.).
· Связь с Центром управления Федерального центра.
· Диагностика ВПС (пре- и постнатальная).
· Оценка состояния новорожденного и беременной.
· Определение условий родовспоможения и транспортировки новорожденных с ВПС.
· Определение показаний к экстренному переводу новорожденного в Федеральный кардиохирургический центр.
· Сопровождение, в случае необходимости, новорожденного с ВПС до Федерального кардиохирургического центра.
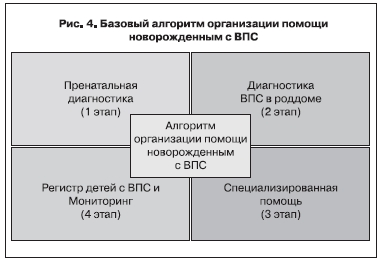
В результате внедерения сотрудничества, основанного на взаимосвязи специалистов различных уровней, действительно становится возможным оказание своевременной и адекватной помощи новорожденным с ВПС, а разработанные нами лечебно-диагностические алгоритмы [1, 4, 5] позволяют объединить усилия специалистов по выявлению пороков сердца на различных этапах, их своевременной коррекции и проведению различных реабилитационных мероприятий, начиная с дооперационной подготовки детей и заканчивая их послеоперационным выхаживанием. Базовый алгоритм организации помощи новорожденным с ВПС (рис. 4) устанавливает главные этапы и их последовательность, а основной методологический алгоритм (рис. 5) раскрывает их суть, что позволяет своевременно определить принципиальную тактику квалифицированного лечебно-диагностического подхода при ВПС у плода и новорожденного. Рассмотрим более подробно эти этапы.
Рисунок 5. Базовый алгоритм оказания помощи новорожденным с ВПС.
Базовые алгоритмы организации помощи новорожденным с ВПС
Если говорить об организации специализированной помощи, то ее оказание должно складываться в алгоритм из определенных этапов (рис. 4):
1 этап – пренатальная диагностика врожденной патологии сердца и сосудов.
2 этап – диагностика врожденной патологии системы кровообращения непосредственно
на местах с оценкой необходимости и целесообразности экстренного перевода новорожденных в кардиохирургический стационар и обеспечения адекватных условий в момент их транспортировки.
3 этап – оказание специализированной кардиологической и кардиохирургической помощи.
4 этап – проведение адекватного мониторинга и формирование регистров беременных женщин,
угрожаемых по рождению детей с ВПС, и детей, родившихся с ВПС; создание регистра детей
с врожденной патологией.
Ведущими принципами лечебно-диагностических алгоритмов ведения детей первого года
жизни с ВПС [1, 3, 5,], в том числе новорожденных и недоношенных детей являются этапность,
квалифицированность, взаимопонимание и четкая организация.
1 этап – пренатальная диагностика
Известно, что пренатальная (внутриутробная) диагностика ВПС позволяет еще до рождения выявить от 60 до 91% хромосомной патологии и до 51% экстракардиальной патологии [1]. Эти данные подтверждают мнение о безусловной важности дородовой диагностики ВПС. Кроме того, четкая организация перинатальной службы потенциально позволяет выявлять до рождения около 90% сердечной патологии в группе повышенного риска. Причем заметим, что спектр ВПС, диагностируемых пренатально, гораздо шире и сложнее врожденной кардиальной патологии, выявляемой постнатально.
К сожалению, в нашей стране пренатальная диагностика врожденной патологии еще недостаточно хорошо развита, особенно в дальних реги онах РФ. В то же время опыт зарубежных коллег [10, 13] показал, что в США и европейских странах (Норвегии, Франции, Германии и т.д.) всем женщинам на 18–22 нед беременности проводится эхокардиография плода для исключения кардиальной патологии. Такой подход способствует тому, что Западной Европе уровень внутриутробной диагностики ВПС на диспансерном этапе достигает 48%.
На сегодняшний день в России исследование сердца плода на уровне женских консультаций
в большинстве случаев ограничивается визуализацией четырех камер сердца и оценкой только частоты сердечного ритма, при этом на диспансерном уровне выявляется лишь 6,5% детей
с ВПС.
До сих пор бытует ошибочное мнение, что выявление ВПС и тем более нарушений ритма у плода возможно лишь после 30-й нед беременности. Все ВПС формируются в I триместре и заподозрить грубый порок сердца и сосудов возможно уже на 13–14-й нед беременности. Внедрение стандартизированного подхода к проведению внутриутробной эхокардиографии, который был предложен американским колледжем акушерства, гинекологии и радиологии, повысило процент выявляемости ВПС у плода с 50 до 95% в США. По данным исследования C. Stoll, E. Garne, M. Clementi (2001), в странах Восточной Европы, где не используется обязательный эхокардиографический скрининг всех беременных, доля диагностированных пренатально ВПС составляет 17,9%, при рутинном однократном скрининге плода – 46%, а при двух-трехкратном исследовании – 55,6%. В то же время, очевидно, что выявление порока до рождения ребенка часто определяет его дальнейшую судьбу [1–3].
В случае подозрения на наличие ВПС у плода (рис. 5), необходима не только верификация
диагноза, но и пренатальное проведение консилиума о тактике дальнейшего ведения. Вопрос
о целесообразности сохранения беременности при обнаружении у плода ВПС решает консилиум в составе акушера-гинеколога, детского кардиолога, медицинского генетика, возможно участие и детского кардиохирурга. В процессе работы консилиума и формирования рекомендаций для родителей относительно здоровья их будущего ребенка принимаются во внимание следующие основные аспекты: диагностически значимые признаки, оказывающие влияние на течение и исход беременности, а также возможности хирургического лечения и прогноз при различной патологии сердечно-сосудистой системы у плода. Нередко приходится сталкиваться с односторонним или принципиально неверным подходом при рассмотрении вопроса об исходе беременности, прогнозе для жизни и здоровья плода и ребенка при той или иной конкретной сердечной патологии. Вместе с тем не стоит забывать, что патология сердечно-сосудистой системы приводит к быстрой декомпенсации в раннем неонатальном периоде. Только знания о наличии порока сердца у ребенка еще до его рождения позволят провести своевременное медикаментозное лечение и избежать появления признаков сердечной недостаточности в пре- и раннем постнатальном периодах.
Рисунок 6. Лечебно-диагностический алгоритм первичной диагностики ВПС.
В случаях сохранения беременности планируется оказание своевременной квалифицированной
помощи ребенку, прежде всего, с критическим ВПС сразу после рождения. В пренатальном центре и комиссии необходимо проводить обязательное подтверждение пренатально установленного
диагноза: при прерывании беременности секционное, а в случаях рождения детей – постнатальное подтверждение ВПС, выполняемое в первую очередь с помощью эхокардиографического исследования.
Грамотная организация пренатальной службы позволяет выявить до рождения около 95%
сердечной патологии и оценить возможность сохранения беременности; выбрать срок и способ
родоразрешения; определить вариант специализированной помощи в период новорожденности
и психологически подготовить родителей к возможным проблемам после рождения ребенка.
Метод комплексной эхокардиографии дает возможность с высокой степенью точности и достоверности диагностировать ВПС в 98% случаев, нарушения сердечного ритма в 100% наблюдений. Высокая частота встречаемости сложных и комбинированных ВПС у плода обусловливает необходимость использования расширенного протокола эхокардиографического исследования с изучением анатомии сердечно-сосудистой системы, внутрисердечной и фетоплацентарной гемодинамики, а также функционального состояния фетального миокарда [1, 4, 7].
Следует отметить, что по мере расширения работы по ведению беременности при кардиальной патологии у плода и расширению спектра и объема операций у новорожденных и детей 1-го года жизни, процент прерывания беременности заметно снижается, а процент детей с пренатально установленным диагнозом, прооперированных в неонатальном периоде, растет.
По данным НЦССХ им. А.Н. Бакулева РАМН, средний процент проведенных операций по поводу пренатально выявленной кардиальной патологии составляет 48% (до 1 года), при этом диагностическая погрешность не превышает 5% [4].
Таким образом, развитие пренатальной диагностики ВПС приводит к увеличению числа детей,
поступающих для хирургического лечения ВПС в специализированную клинику в неонатальный
период, и, прежде всего, в первые 7 сут жизни, а также способствует снижению послеоперационной летальности в данной возрастной группе. Внедрение пренатальной диагностики в практическое здравоохранение в значительной степени влияет как на своевременность поступления детей с ВПС в кардиохирургическую клинику, так и на и готовность хирургической бригады к оказанию помощи конкретному больному с известным диагнозом.
2 этап – диагностика ВПС в родильном доме
Диагностика врожденной патологии системы кровообращения непосредственно на местах,
оценка необходимости и целесообразности экстренного перевода новорожденных в кардиохирургический стационар, обеспечение адекватных условий в момент их транспортировки – так можно сформулировать основные задачи 2 этапа. Алгоритм диагностики ВПС в роддоме (рис. 6)
основан на выделении симптомов или комплекса симптомов (сердечная недостаточность, аритмия,
недостаточность периферического кровообращения – шок, цианоз, сердечные шумы), позволяющих заподозрить патологию сердца у новорожденных и определяющих тактику ведения этого контингента больных в первые часы, дни, месяцы жизни [4, 14, 16, 22].
Первичная дифференциальная диагностика порока и оценка тяжести состояния ребенка предполагают обязательное физикальное обследование больного (оценка выраженности артериальной гипоксемии и степени сердечной недостаточности) с проведением диагностических проб; оценку пульсации и измерения артериального давления на верхних и нижних конечностях; аускультацию сердца и сосудов. При наличии соответствующих возможностей (исследование КЩС, Rö-граммы, ЭКГ, ЭхоКГ-диагностика) в роддоме или в поликлинике по месту жительства следует подтвердить возникшее подозрение на наличие ВПС. Если таких возможностей нет, то требуется безотлагательная (в тяжелых случаях) или плановая (при стабильном состоянии) консультация специалиста для определения дальнейшей тактики лечения ребенка: наблюдение, терапия или экстренный перевод на неотложное оперативное лечение.
При наличии цианоза проведение диагностических проб (дыхание 100% кислородом, инфузия препаратов ПГЕ1) позволяет установить его причину. В случае диагностики центрального характера цианоза (критического ВПС), а также выраженных клинических проявлений цианоза, быстрого нарастания ацидоза и сердечной недостаточности, могут потребоваться незамедлительные действия в организации адекватных условий транспортировки новорожденных с критическими ВПС в кардиохирургический стационар для оперативного лечения ВПС. Нередко перед переводом ребенка в специализированный стационар необходимо проведение интенсивной медикаментозной терапии с целью стабилизации состояния [4, 6].
Выездные кардиологические бригады дают возможность непосредственно в роддомах проводить
диагностику врожденной патологии системы кровообращения, оценивать необходимость и целесообразность экстренного перевода новорожденных в кардиохирургический стационар и обеспечивать адекватные условия в момент их транспортировки.
«Критические» ВПС периода новорожденности приводят к быстрой декомпенсации состояния
в раннем неонатальном периоде и требуют оказания экстренной помощи. При критических
пороках сердца и жизнеугрожающих аритмиях прогноз для ребенка непосредственно зависит
от времени поступления в специализированный стационар и определяется слаженностью работы
акушерской, неонатальной и кардиологической служб [2, 15, 19].
Медикаментозная терапия ВПС должна быть основана на знаниях патофизиологии ВПС. При
планировании терапии, необходимо избегать мероприятий, утяжеляющих имеющиеся гемодинамические нарушения [1, 6]. Речь идет, прежде всего, о реакции открытого артериального протока (ОАП) на кислород и простагландины группы Е (ПГЕ1) у дуктус-зависимых ВПС, а также овлиянииразличныхпрепаратовнаобщелегочное сопротивление и, соответственно, на легочный кровоток в случаях высокой реактивности легочного сосудистого русла у новорожденных.
3 этап – оказание специализированной квалифицированной помощи
Возможность оказания специализированной квалифицированной помощи новорожденным
с ВПС является одним из основных условий сохранения здоровья этих детей [2, 3, 17, 18]. При этом кардиохирургическая в зависимости от потребностей больного ребенка. Уровень оказания этой
помощи в большой степени связан со степенью тяжести, типом порока сердца и возможностями
непосредественных участников лечебного процесса. Так, при некоторых пороках сердца помощь
может быть оказана непосредственно в родильном доме или региональных отделениях (перевязка открытого артериального протока, закрытая атриосептостомия – процедура Рашкинда), при других, более сложных ВПС – в условиях федеральных специализированных центров с возможностью оказания анестезиологического пособия, искуственного кровообращения, реанимационных мероприятий для ребенка с ВПС. Однако необходимо отметить ведущую роль детского кардиолога на этом этапе. Детский кардиолог работает как в кардиологическом, так и в кардиохирургическом отделениях, что во многом определяет его возможности непосредственного взаимодействия с диагностическими, хирургическими, реанимационными и реабилитационными службами. На этом уровне в первую очередь проводитсяуглубленное,уточняющеетопический диагноз исследование с применением высокотехнологичных методов (высокоточное многомерное ЭхоКГ-исследование, МРТ, ЯМР и др.); оценивается состояние ребенка, составляется план и проводится подготовка к хирургической коррекции патологии (при необходимости многоэтапной) в виде радикального, паллиативного или гемодинамического пособия с последующим выхаживанием ребенка в условиях реанимационного и кардиологического отделений.
Таким образом, важнейшими составляющими этого этапа являются: планирование, подготовка и выполнение коррекции ВПС с проведением в дальнейшем реабилитационных мероприятий и наблюдения за ребенком.
4 этап – проведение адекватного мониторинга и формирование регистров
Проведение мониторинга как беременных женщин с диагностированным ВПС или нарушениями ритма у плода, так и детей, родившихся с ВПС, абсолютно необходимо для адекватного наблюдения и своевременного оказания помощи [20]. Поэтому 4 этап оказания специализированной помощи детям с ВПС заключается в проведении адекватного мониторинга и формировании регистров беременных женщин, угрожаемых по рождению детей с ВПС, и детей, родившихся с ВПС.
Ведущими специалистами России в области врожденной патологии системы кровообращения была
разработана схема формирования государственного регистра детей с врожденными аномалиями
системы кровообращения. Она предполагает обязательную одновременную передачу информации
из женских консультаций об исходе такой беременности и о рождении ребенка с ВПС из родильных
домов в течение первых суток в детскую поликлинику по месту жительства родителей, в региональный кардиохирургический центр, и в последующем непосредственно в Федеральные специализированные центры и головную организацию.
Такая система позволяет иметь информацию о возрасте ребенка на момент выявления порока, об учреждении, где впервые диагноз был установлен, о состоянии пациента при первичном осмотре, выполненных лечебно-диагностических мероприятиях и клинике, где они проводились, об исходе заболевания и послеоперационном восстановительном лечении и
реабилитации. Эти мероприятия дают возможность проводить четкий статистический учет
врожденной кардиальной патологии и оценивать адекватность лечебной тактики в каждом
конкретном случае: своевременность выполненного оперативного лечения, эффективность
терапии в до- и послеоперационном периодах, а также качество реабилитации. Регистр детей
с врожденной патологией должен постоянно пополняться также за счет детей с ВПС, выявленными участковыми педиатрами в амбулаторных условиях или врачами в стационаре. В ряде регионов РФ начата и по сей день продолжается работа по созданию регистра врожденной патологии сердца и сосудов среди детского населения в возрасте от 0 до 18 лет. Создание единого регистра детей с ВПС необходимо для ведения четкого статистического учета врожденной кардиальной патологии в Российской Федерации.
Заключение
Раннее распознавание пороков сердца, установление топического диагноза, определение
степени нарушения гемодинамики и в зависимости от этого выбор метода лечения и оптимального срока хирургического вмешательства являются важнейшими задачами [18–20], решение которых поможет снижению как младенческой, так и общей детской летальности.
Проведенное в рамках программы исследование подтвердило эффективность предложенных нами базовых (организационных) алгоритмов, которые наравне с совершенствующимися
хирургическими подходами позитивно влияют на исходы лечения новорожденных с ВПС и
нарушениями сердечного ритма.
Внедрение пренатальной диагностики ВПС в структуру основного организационного алгоритма значительно увеличило активность первичного звена в отношении диагностики ВПС и ответственность акушров-гинекологов женских консультаций и родильных домов. В случаях
выявления ВПС после рождения важная роль в реализации основных задач базовых алгоритмов приналежит неонатологам родильных домов и отделений патологии новорожденных, а зачастую участковым педиатрам, проводящим первичный патронаж на дому. Необходимо помнить, что невнимательное отношение к маленьким пациентам является основной причиной поздней диагностики ВПС, а отсутствие адекватной терапии в первые сутки после рождения ребенка,
прежде всего, с критическими формами ВПС негативно влияет на результат хирургической коррекции [1, 21]. Представленные базовые алгоритмы позволяют не только диагностировать
критические состояния сердечно-сосудистой системы, но и определять тактику ведения этого
контингента больных в первые часы, дни, месяцы жизни на всех этапах оказания специализированной помощи новорожденным с ВПС.



