Анеуплоидии (изменения числа хромосом) являются самыми распространенными вариантами хромосомных аномалий у человека, а также основной генетической причиной потерь беременности и рождения детей с врожденными дефектами, как при естественном зачатии, так и при использовании вспомогательных репродуктивных технологий (ВРТ). Хотя эмбрионы с анеуплоидиями, как правило, останавливаются в развитии до имплантации, или такие беременности самопроизвольно прерываются на очень ранних сроках гестации, некоторые трисомии (а именно трисомии 13, 18, 21-й и половых хромосом) совместимы с жизнеспособностью эмбриона. Беременности анеуплоидными эмбрионами приводят к рождению детей с врожденными аномалиями развития.
Преимплантационный генетический скрининг (ПГС) был разработан с целью селекции генетически полноценных эмбрионов, увеличения эффективности программ экстракорпорального оплодотворения/интрацитоплазматической инъекции сперматозоидов (ЭКО/ИКСИ) и профилактики рождения детей с хромосомными нарушениями.
В качестве материала для генетического исследования могут быть использованы первое или второе полярное тельце ооцитов [1, 2], один или два бластомера эмбриона 3 суток культивирования [3, 4], или клетки трофоэктодермы эмбриона на стадии бластоцисты [5, 6]. В качестве метода исследования в настоящее время используют следующие технологии: полимеразную цепную реакцию (ПЦР), флуоресцентную гибридизацию in situ (FISH), а также метод сравнительной геномной гибридизации (СГГ от англ. CGH – comparative genomic hybridization). Наиболее доступной и потому распространенной в клинической практике методикой является FISH-диагностика бластомеров эмбрионов. Основным ограничением FISH-методики является возможность анализа небольшого числа хромосом в образце, поскольку применение большого числа красителей повышает вероятность диагностической ошибки. Поэтому анализу подвергаются хромосомы, с которыми связаны наиболее часто встречающиеся аномалии (13, 18, 21, а также половые хромосомы) [7, 8].
Исследования гаметогенеза у человека показали, что оогенез более значительно подвержен ошибкам мейоза, чем сперматогенез [9]. По данным литературы, распространенность анеуплоидии по 13-й, 18-й, 21-й, X, Y хромосом в нормальной сперме не превышает 0,6% [10], а распространенность анеуплоидии по 24 хромосомам не превышает 5%, хотя при наличии патозооспермии, особенно тератозооспермии, распространенность анеуплоидии может возрастать в 4–5 раз [11, 12].
При этом средний уровень анеуплоидии в ооцитах, полученных в естественных циклах у молодых женщин, составляет около 20% [13]. Уровень анеуплоидии в ооцитах четко коррелирует с возрастом женщины, и у женщин старше 40 лет более половины ооцитов имеют хромосомные аномалии [14, 15]. Несмотря на то что источником анеуплоидного эмбриона с большей вероятностью является ооцит с аномальным хромосомным набором, морфологической оценке ооцитов уделяется значительно меньше внимания, чем селекции сперматозоида для оплодотворения методом ИКСИ. Морфологические аномалии ооцитов, или дисморфизмы, встречаются более чем в половине циклов ЭКО с применением стимуляции суперовуляции, и их наличие ассоциировано со снижением частоты наступления клинических беременностей и ухудшением перинатальных исходов [16, 17].

И хотя в ооцитах с дисморфизмами наблюдается более высокий уровень анеуплоидии, по сравнению с морфологически нормальными клетками [18, 19] все зрелые ооциты подвергаются оплодотворению, а культивирование и морфологическая оценка эмбрионов производится без связи с исходной морфологией ооцита.
В связи с этим целью нашего исследования было сравнение клинико-экономической эффективности ЭКО с последующей пренатальной генетической диагностикой и ЭКО с ПГС методом FISH для предотвращения рождения детей с анеуплоидиями у пар с различными видами дисморфизмов ооцитов у женщин.
Материал и методы исследования
Авторами была создана модель принятия решений (TreeAge Pro Inc), в которой было проведено сравнение 2 стратегий: рутинного ЭКО и ЭКО с ПГС методом FISH у бесплодных пар с дисморфизмами ооцитов у женщин для определения минимальной стоимости одного живорождения на одного пациента, проходящего вышеуказанное лечение бесплодия.
Понятие «дисморфизмы ооцитов» включало наличие у пациенток 100% ооцитов с патологией цитоплазмы или экстрацитоплазматическими нарушениями. К цитоплазматическим дисморфизмам относили центральную гранулярность цитоплазмы, вакуоли, рефрактерные тельца, аномальные агрегаты гладкого эндоплазматического ретикулума в цитоплазме клетки, а также наличие темной цитоплазмы. К экстрацитоплазматическим дисморфизмам относили расширенное перивителлиновое пространство и наличие в нем дебриса, а также наличие деформации или утолщения зоны пеллюцида. Критерием включения со стороны супруга было наличие фертильной или субфертильной спермы с целью минимизации влияния отцовских анеуплоидий на хромосомный набор эмбриона.

В модель включались пары с наличием эмбрионов, пригодных для переноса в полость матки. Допущением модели была возможность применения одного цикла ЭКО со свежими эмбрионами без криоконсервации. Данные по вероятности наступления беременности, самопроизвольного выкидыша, риска анеуплоидии по данным биохимического скрининга, частоте амниоцентеза и прерывания беременности во 2-м триместре в группах ЭКО и ЭКО/ПГС у пар с различными видами дисморфизмами ооцитов были получены из результатов собственных наблюдений (табл. 1 и 2).
Мы предположили, что всем женщинам с самопроизвольным выкидышем будет проведено инструментальное удаление плодного яйца из полости матки. Также мы предположили, что всем женщинам с высоким риском анеуплоидии по данным скрининга 1-го триместра будет проведен пренатальный генетический скрининг путем амниоцентеза. Если во время пренатального генетического скрининга выявлялась анеуплоидия плода, мы предположили, что этим женщинам будет проведено прерывание беременности во втором триместре.
В анализе были учтены только прямые затраты на проведение ЭКО и ЭКО/ПГС. Под затратами понималась непосредственная стоимость медицинских услуг, а также стоимость койко-дней при проведении различных лечебных процедур в условиях стационара. Стоимость ЭКО в свежем цикле рассчитывалось как норматив финансовых затрат на 1 случай применения процедуры за счет средств ОМС в 2014 году [20].
Стоимость всех остальных процедур рассчитывалась по прейскуранту услуг ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Стоимость ПГС включала стоимость биопсии бластомеров и FISH-диагностики по пяти хромосомам. Стоимость пренатального скрининга в 1-м триместре включала стоимость ультразвукового исследования и исследования биохимических маркеров крови. Стоимость амниоцентеза включала стоимость процедуры, а также стоимость 1 койко-дня в дневном стационаре, определение кариотипа по амниотической жидкости, консультацию врача-генетика и ультразвуковой контроль при проведении амниоцентеза. Прерывание беременности в 1-м триместре состояло из инструментального удаления плодного яйца и пребывания в стационаре в течение 2 койко-дней. Прерывание беременности во 2-м триместре включало 5 койко-дней в стационаре и гистологическое исследование тканей плода (табл. 3). Устойчивость созданной модели была проверена путем анализа чувствительности с учетом размаха вероятностей и стоимости процедур от средних показателей (табл. 1–3).

Результаты исследования
Для пар с цитоплазматическими дисморфизмами ооцитов вероятность иметь здорового ребенка при применении одного цикла ЭКО составила 15% по сравнению с 21% для пар при применении одного цикла ЭКО/ПГС, а вероятность родить ребенка с анеуплоидией составила 1,4% в циклах ЭКО и 0% в циклах ЭКО/ПГС (рис. 1).
Средняя стоимость лечения методом ЭКО составила при этом 116 065 руб. по сравнению со 190 278 руб. при лечении методом ЭКО/ПГС. При этом средняя стоимость лечения методом ЭКО для рождения одного здорового ребенка составила 733 766 руб., при лечении методом ЭКО/ПГС – 889 149 руб. В этой группе пациентов стоимость лечения бесплодия методом ЭКО или ЭКО/ПГС в расчете на рождение одного здорового ребенка отличалась на 13% (табл. 4).
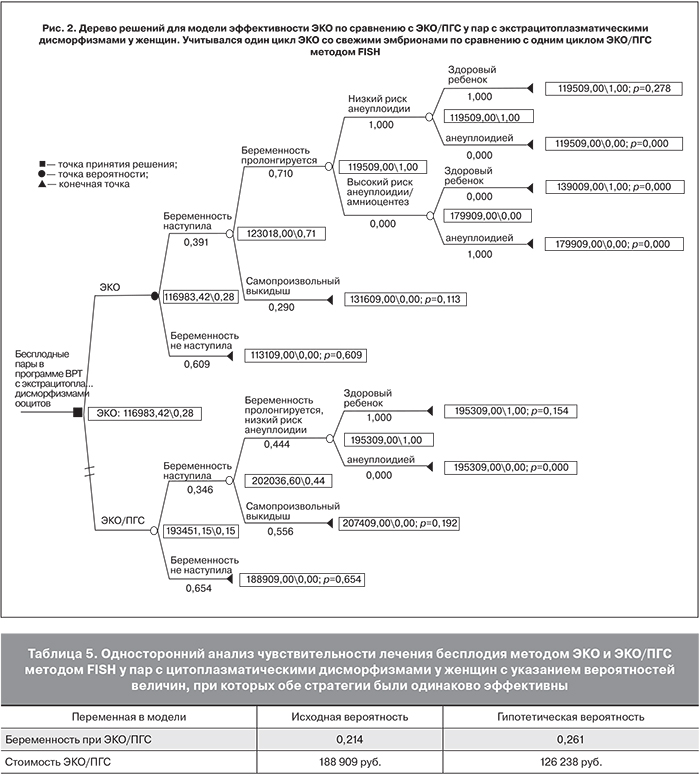
Для пар с экстрацитоплазматическими дисморфизмами ооцитов вероятность иметь здорового ребенка при применении одного цикла ЭКО составила 28 по сравнению с 15% для пар при применении одного цикла ЭКО/ПГС, а вероятность родить ребенка с анеуплоидией составила 0% в циклах ЭКО и 0% в циклах ЭКО/ПГС (рис. 2).
Средняя стоимость лечения методом ЭКО составила при этом 116 983 руб. по сравнению со 193 451 руб. при лечении методом ЭКО/ПГС. При этом средняя стоимость лечения методом ЭКО в расчете на одного здорового ребенка составила 420802 руб., при лечении методом ЭКО/ПГС – 1 256 175 руб. В этой группе пациентов стоимость лечения бесплодия методом ЭКО или ЭКО/ПГС в расчете на рождение одного здорового ребенка отличалась на 66,5% (табл. 4).
Мы провели анализ чувствительности для модели с цитоплазматическими дисморфизмами ооцитов как наиболее устойчивой модели. Данная модель была чувствительна к изменению вероятности наступления беременности и рождения эуплоидного ребенка при применении ЭКО/ПГС и стоимости ЭКО/ПГС (табл. 5).
ЭКО/ПГС стала бы доминирующей стратегией, если бы вероятность наступления беременности возросла до 26,1% по сравнению с исходной вероятностью 21,4%, а стоимость ее снизилась до 126 238 руб. по сравнению с исходными 188 909 руб. (рис. 3).
Обсуждение
Наше исследование является первым, в котором была применена аналитическая модель принятия решений по выбору более клинико-экономически выгодной стратегии – ЭКО или ЭКО/ПГС – для диагностики анеуплоидии и рождения здорового потомства у бесплодных пар с дисморфизмами ооцитов у женщин.
Анализ показал, что эффективность лечения бесплодия методом ЭКО/ПГС методом FISH не была выше по сравнению с ЭКО в плане рождения здорового потомства у пациенток с экстрацитоплазматическими дисморфизмами: 27,8% при применении ЭКО и лишь 15,4% при применении ЭКО с ПГС. И наоборот, у пациенток с цитоплазматическими дисморфизмами удалось добиться рождения живого здорового потомства в 21,4% наблюдений при применении ЭКО с ПГС и лишь в 15% случаев при применении ЭКО. Важно, что в отсутствии применения ПГС в этой группе пациентов 1,4% рожденных детей имели те или иные анеуплоидии.
Несмотря на высокую эффективность ПГС у пациенток с цитоплазматическими дисморфизмами ооцитов высокая стоимость данной процедуры не позволила назвать метод ЭКО/ПГС более клинико-экономически эффективной стратегией лечения бесплодия в этой группе больных. При этом следует отметить, что стоимость лечения бесплодия методом ЭКО или ЭКО/ПГС в расчете на рождение одного здорового ребенка у этих пациентов отличалась всего на 13% в отличие от пар с экстрацитоплазматическими дисморфизмами ооцитов, у которых дельта в цене составляла 66,5%. Анализ чувствительности показал, что для того чтобы добиться увеличения клинико-экономической эффективности ЭКО/ПГС по сравнению с ЭКО у пациентов с цитоплазматическими дисморфизмами ооцитов у женщин, надо снизить ее стоимость до 126 238 руб. по сравнению с исходными 188 909 руб. При этом следует повысить эффективность ЭКО/ПГС до 26,1% по сравнению с исходными 21,4%.
Мы рассчитали и провели сравнение показателей приращения затрат (ICER) на проведение ЭКО и ЭКО/ПГС в данной группе пациентов, который составил 18 028,60 руб. Анализ CER показал, что для достижения дополнительного 1% эффективности (то есть 1% рождения здоровых детей) при применении ЭКО/ПГС в группе пациентов с цитоплазматическими дисморфизмами у женщин требуется всего лишь 18 028,60 рублей дополнительных вложений.

Достаточно низкая частота наступления беременности при применении ЭКО с ПГС может быть обусловлена несколькими факторами. Во-первых, изучение дробящихся эмбрионов не позволяет исключить мозаичность бластомеров эмбрионов, а также потенциальную способность дробящегося эмбриона к самокоррекции [21, 22]. При этом существует риск как переноса в полость матки анеуплоидного эмбриона, так и прекращения культивирования и не переноса эмбриона с нормальным хромосомным набором. Во-вторых, при применении ПГС методом FISH нельзя исключить наличие анеуплоидии хромосом, не подвергнутых анализу, и переноса в полость матки анеуплоидного эмбриона.
Также одним из возможных механизмов, лежащих в основе низкой частоты наступления беременности у пациенток с цитоплазматическими дисморфизмами ооцитов, является наличие метаболических нарушений в ооцитах, в частности, нарушение синтеза белков или продукции АТФ вследствие поражений митохондрий и гладкого эндоплазматического ретикулума в клетке [17, 23]. Уменьшение функциональных возможностей ооцитов может быть причиной низкого потенциала развития эмбриона, поскольку на ранних этапах эмбриогенез зависит от питательных веществ и субстратов, накопленных ооцитом в процессе оогенеза, а митохондрии ооцита являются единственным источником энергии дробящегося эмбриона. Несмотря на то что метаболические нарушения в ооцитах могут являться причиной низкой эффективности программ ЭКО у пациенток с дисморфизмами ооцитов, в первую очередь с цитоплазматическими, на сегодняшний день не существует ни методов диагностики подобных нарушений, ни возможных методов их коррекции, внедренных в клиническую практику.
Наиболее интересной находкой нашего исследования с клинической точки зрения является высокая вероятность рождения ребенка с анеуплоидией при наличии цитоплазматических дисморфизмов ооцитов, составляющая 1,4%, что превышает общепопуляционные значения. Несмотря на то что метод ЭКО/ПГС не является экономически выгодной стратегией для пациенток с цитоплазматическими дисморфизмами ооцитов, применение ПГС может способствовать профилактике рождения детей с врожденными аномалиями. Следует учитывать, что для упрощения созданной модели мы не включали в анализ расходы на лечение детей с врожденными аномалиями.
Ограничением нашего исследования была ошибка выборки, основанная на неравноценном подборе пациентов для сравнения ЭКО и ЭКО/ПГС в популяции пациентов с дисморфизмами ооцитов и их отсутствием. Кроме того, стоимость различных процедур, включенных в стандарт лечения бесплодия методом ЭКО, учитывалась из различных каналов финансирования (ОМС и платные услуги), так как не все включенные в исследование методики финансируются по каналу ОМС.
Заключение
ЭКО является более клинико-экономически эффективным методом лечения бесплодия у супружеских пар с дисморфизмами ооцитов у женщин. У пар с цитоплазматическими дисморфизмами ооцитов у женщин ЭКО с применением ПГС методом FISH может быть более выгодной методикой в случае снижения стоимости ПГС. Необходимо проведение дополнительных исследований по изучению эффективности ПГС в данной группе пациентов.



