Известно, что 60–70% гиперпластических процессов эндометрия (ГПЭ) могут быть обусловлены длительной монотонной эстрогенной стимуляцией при отсутствии антипролиферативного действия прогестерона и низком уровне полового стероид-связывающего глобулина (свободные эстрогены), что в репродуктивном и перименопаузальном возрасте может быть связано с ановуляторными циклами, а также с нарушением жирового и углеводного обмена. Но у 30–40% пациенток пери- и постменопаузального возраста ГПЭ могут возникать в условиях нормального для них гормонального фона (подавление процессов апоптоза, нарушение рецепторного аппарата эндометрия по отношению к факторам роста). Важным достижением последнего времени является определение гетерогенности патологических процессов при ГПЭ, включающих разрастание или нормального поликлонального эндометрия под действием гиперэстрогенемии различного генеза (чаще всего при ановуляторных менструальных циклах), или фокусно-измененного аномального моноклонального эндометрия. Это четко определяет два основных пути при ГПЭ: гиперплазию или неоплазию. При современном подходе к лечению ГПЭ прежде всего оценивается наличие или отсутствие клеточной, а затем и тканевой атипии. При этом патогенез ГПЭ не стоит рассматривать как последовательное увеличение степени тяжести пролиферативных, клеточных и структурных изменений. Таким образом, патогенез и клиническое течение гиперплазий и неоплазий эндометрия неоднородны.
Классификация гиперплазий эндометрия (ГЭ) основана на морфологическом принципе, гистологической оценке должны подвергаться все подозрительные участки слизистой оболочки полости матки. При атипической ГЭ процент малигнизации, по данным разных авторов, достигает 10–40%, и поэтому обнаружение клеточной и структурной атипии при комбинированной атипической ГЭ может рассматриваться как предрак. Однако частота расхождения морфологического диагноза в стандартных многопрофильных стационарах и в специализированных онкологических клиниках может достигать 82,1–92,3%. Поэтому действительно нередко требуется пересмотр гистологических препаратов в онкоцентрах.
С клинической точки зрения выделяют основные факторы риска атипической ГПЭ: ожирение (преимущественно висцеральное), нарушения менструального цикла 12 лет и более, синдром поликистозных яичников, инсулинонезависимый сахарный диабет. В значении риска развития атипической ГПЭ в настоящее время выделяют также такой показатель, как отсутствие родов в анамнезе в совокупности с отсутствием указаний на использование гормональной контрацепции в течение 12 и более месяцев.
В диагностике ГПЭ могут иметь значение любые нарушения менструального цикла – от аменореи до аномальных маточных кровотечений (АМК). При этом при ГПЭ без атипии практически всегда регистрируются АМК, а при атипической ГПЭ АМК может и не быть.
В постановке диагноза помогает УЗИ (его специфичность достигает 89%). УЗ-обнаружение разрастания эндометрия по фазам менструального цикла, как правило, является показанием для проведения гистологического исследования удаляемого утолщенного эндометрия как при наличии, так и при отсутствии АМК. Стандартными ограничениями к проведению забора материала измененного эндометрия являются острые воспалительные заболевания гениталий и подростковый возраст (кроме витальных показаний). Современными дополнительными ограничениями для внутриматочного вмешательства служат: первый эпизод нарушений менструальной функции у женщин до 40 лет, не входящих в группу высокого риска развития атипической ГПЭ; наличие в недавнем (3–4 месяца) анамнезе ДВ с гистологическим заключением об отсутствии атипии, без проведения гормональной противорецидивной терапии (рис. 1).
Ультразвуковые критерии гиперплазии эндометрия
Увеличение толщины (переднезаднего размера) М-Эхо:
- в конце условной второй фазы >16 мм;
- на 5–8-й день от начала кровотечения >9 мм.
Появление кистозно-расширенных желез, анэхогенные фокусы диаметром 0,5–1,5 мм.
Попытки УЗ-установления морфотипа ГПЭ не имеют клинического значения, так как не отменяют необходимости РДВ.
Лечение больных с гиперплазией эндометрия
Удаление патологически измененной ткани слизистой оболочки является лечебным мероприятием.
Дальнейшая терапия либо оперативное лечение –профилактика рецидивов.
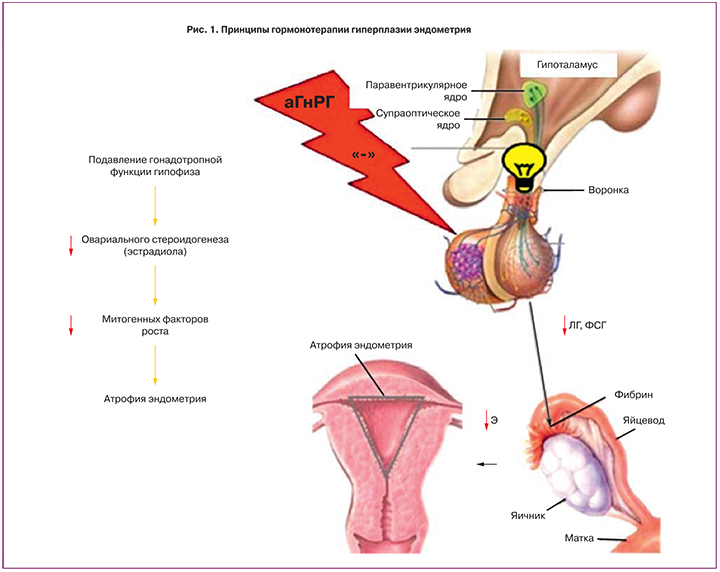
В настоящее время противорецидивная терапия типичных ГПЭ с использованием агонистов гонадотропин-рилизинг-гормона (аГнРГ) является наиболее патогенетически обоснованной. Это связано с доказанными множественными механизмами действия (рис. 2). Помимо представленной на рисунке центральной гормональной аблации за счет развивающейся при применении аГнРГ десенситизации гипофиза, препараты этой группы способны непосредственно связываться с цитоплазматической мембраной клеток эндометрия, взаимодействуя со своими специфичными рецепторами, угнетают продукты генов, ассоциированных с G1 фазой клеточного цикла (циклина Е, p33cdk2), угнетают пролиферацию за счет повышения внутриклеточной концентрации аннексина V – эндогенного ингибитора протеинкиназы С, снижают высвобождение промитогенных цитокинов и сосудистого эндотелиального фактора роста, тем самым ингибируя пролиферацию и неоангиогенез; вызывают апоптоз, подавляя выработку антиапоптотического белка Bcl-2; угнетают внегонадную продукцию эстрогенов за счет супрессии синтеза ароматазы; приводят к увеличению выработки матриксных металлопротеиназ (ММП) с сопутствующим уменьшением их тканевых ингибиторов, способствуя лизису стромального компонента; существенно снижают выработку экстрацеллюлярных сигналрегулирующих киназ и киназ фокальной адгезии, являющихся неотъемлемыми звеньями внутриклеточных сигнальных путей, активируемых половыми стероидами и факторами роста [1, 2].

Во всех известных аГнРГ в 10 положении химической структуры удалена аминокислота глицин для повышения сродства к рецепторам гипофиза и пролонгации действия. Но не зря по химической структуре различают аГнРГ с дополнительными двумя заменами аминокислот (в 6 и 9 положениях) – бусерелин, лейпрорелин, гозерелин, деслорелин или с одной заменой (в 6 положении) – трипторелин, нафарелин. Изменения в 3 положениях обеспечивают усиление биологической активности, повышение связывающего сродства, удлинение периода полураспада и увеличение способности к депонированию в жировой ткани. Такие аГнРГ называют суперагонистами в связи с их способностью давать наибольшую величину максимального физиологического ответа: повышение сродства к рецепторам аденогипофиза и клеток-мишеней, усиленная блокада синтеза лютеинизирующего и фолликулостимулирующего гормонов клетками аденогипофиза, повышенная блокада альтернативного синтеза стероидов, усиленный антипролиферативный эффект [3]. Самым доступным из суперактивных аГнРГ является отечественный Бусерелин Депо. Лечение этим препаратом, как правило, начинают в первые 5 дней менструального цикла (внутримышечно вводится 3,75 мг) с последующим введением аналогичной дозы каждые 28 дней в течение 6 месяцев под контролем УЗИ 1 раз в 3 месяца. Отсутствие эффекта в течение 3 месяцев требует изменения лечебной тактики и проведения хирургического лечения, что отмечается менее чем в 13% наблюдений.
У пациенток, по возрасту приближающихся к менопаузе, такая противорецидивная терапия типичных гиперплазий эндометрия может способствовать достижению естественной постменопаузы и физиологической постепенной инволюции репродуктивной системы и рисков рецидивирования доброкачественной диффузной гиперплазии эндометрия. У 15–20% пациенток с ГПЭ репродуктивного возраста через 4–12 месяцев после окончания терапии аГнРГ могут возникать рецидивы. Им целесообразно проведение стабилизирующего противорецидивного этапа с использованием гормональных контрацептивов (ГК) или до планируемой беременности, или вплоть до менопаузы. Профилактический (даже, можно сказать, «наступательный» потенциал ГК) определяется прежде всего тропностью к эндометрию гестагена, входящего в его состав. Наиболее высокий утеротропный индекс (суточная доза прогестина с подавлением овуляции в соотношении с дозой прогестина для трансформации эндометрия) зарегистрирован в отношении диеногеста, гестодена, норгестимата и левоноргестрела. Поэтому после «базовой» терапии Бусерелином Депо в профилактике рецидива ГПЭ у молодых женщин, не заинтересованных в ближайшее время в беременности, при отсутствии стандартных для гормональной контрацепции противопоказаний могут использоваться соответствующие утеротропному индексу ГК. При этом необходимо помнить, что этинильная группа этинилэстрадиола (ЕЕ) предотвращает в организме женщины переход ЕЕ в Е2 (эстрадиол), и, таким образом, КОК с ЕЕ не обладают какой-либо пролиферативной активностью на эндометрий [4].
В связи с тем, что при сочетанных доброкачественных гиперплазиях матки онкологическую суспициозность (малигнизация атипической гиперплазии эндометрия составляет 10–40%) представляет именно гиперплазия эндометрия, мной разработан алгоритм ведения таких больных, основанный прежде всего на объективной оценке морфотипа гиперпластического процесса эндометрия. В вопросе онкопрофилактики такие параметры, как количество, локализация и объем узлов миомы и очагов аденомиоза, неактуальны. Они касаются лишь чисто технических вопросов сохранения матки и репродуктивной функции, многократно представлены и хорошо известны, но принципиально также обозначены в этой схеме в понятиях «планирование беременности», «КМ – консервативная миомэктомия соответствующим параметрам миомы доступом», «ЭМА – высокоселективная эмболизация маточных артерий», «репродуктивные планы».
Когда репродуктивные планы женщины объективно завершаются в связи с достижением возраста перименопаузы, алгоритм ведения пациенток с гиперпластическими процессами матки может выглядеть в упрощенном виде (рис. 3).

В таких наблюдениях лечение Бусерелином Депо для профилактики ГПЭ без атипии может рассматриваться в качестве первой линии, как правило, самодостаточной монотерапии.
Несмотря на разработку относительно новых направлений в ведении больных с ГПЭ с использованием химических и физических аблационных методик, вопросы лечения данной патологии остаются одними из наиболее актуальных вопросов гинекологии и еще далеки от окончательного решения. Это обусловлено прежде всего сложным и неоднородным пато- и морфогенезом заболевания и индивидуальной чувствительностью организма к различным лечебным воздействиям.



