В настоящее время кесарево сечение становится далеко небезопасной операцией и может сопровождаться быстрым массивным кровотечением, связанным с патологическим состоянием миометрия. Это могут быть изменения, связанные как с врастанием плаценты, так и с патологической архитектоникой матки.
Артериовенозная мальформация (АВМ) матки — очень редкая патология. За 90 лет наблюдений в мировой литературе представлено менее 150 случаев истинных АВМ матки, при этом реальное распространение патологии неизвестно. Впервые данную патологию описали в 1926 г. АВМ матки — непосредственная коммуникация маточных вен с ветвями артерий разного калибра из бассейнов внутренних подвздошных артерий. Существуют два типа АВМ матки: врожденные мальформации и приобретенные. Одной из причин приобретенной мальформации может быть аденомиоз. Синонимы АВМ матки: диффузный кавернозный ангиоматоз, ангиодисплазия матки, артериовенозные соустья или шунты, лагуны, варикозная аневризма матки [1].
Если обобщить накопленный опыт, то еще в недавнем прошлом находки изменения сосудов матки были только после гистерэктомии. С развитием современных методов диагностики распознавание данной патологии становится более эффективным. Наиболее доступный метод диагностики сосудистых аномалий развития женских гениталий – ультразвуковое исследование (УЗИ). Более точное представление о локализации АВМ и ее ангиоархитектонике дают данные МРТ и МР-ангиографии. Золотым же стандартом диагностики АВМ считается ангиография, позволяющая визуализировать сосудистое образование, определить основной питающий сосуд [2]. Однако применять контрастирование при беременности недопустимо, что ограничивает возможность использования данного метода в акушерстве.
Отличительная особенность кровотечений при АВМ – их внезапность и массивность, что может привести к инвалидизации женщины, тяжелым постгеморрагическим осложнениям, требующим реанимационных мероприятий, и даже к летальному исходу [3]. Особо опасно данное осложнение при беременности. В большинстве случаев такие операции раньше заканчивались экстирпацией матки.
Обобщенный мировой опыт лечения АВМ матки говорит о том, что эмболизация маточных артерий (ЭМА) является наиболее эффективным методом лечения, но в небеременном состоянии [3–5].
Ранее проводилась двусторонняя перевязка внутренних подвздошных артерий. Но проведенное рандомизированное исследование по профилактической перевязке внутренних подвздошных артерий в случае прогноза массивной кровопотери при абдоминальном родоразрешении свидетельствует о том, что рутинное выполнение данной манипуляции не требуется вследствие того, что различий в объеме кровопотери нет, а время оперативного вмешательства достоверно увеличивается [6]. Также имеются данные, свидетельствующие о том, что блокирования кровотока во внутренних подвздошных артериях недостаточно, поскольку кровоснабжение нижнего сегмента матки поддерживается и коллатералями из наружной подвздошной артерии [7].
В настоящее время разработаны и применяются органосохраняющие методики при врастании плаценты с использованием ангиографических методов гемостаза во время кесарева сечения (КС) – ЭМА, баллонной окклюзии общих подвздошных артерий.
В акушерской практике метод баллонной окклюзии общих подвздошных артерий начал применяться с 1995 г. при гистерэктомии во время КС с целью уменьшения объема кровопотери. Эндоваскулярная блокада кровотока (в маточных, общих подвздошных артериях) в настоящее время является современным методом лечения массивных послеродовых кровотечений. Впервые в России операция временной баллонной окклюзии подвздошных артерий во время КС при врастании плаценты была произведена профессором Марком Аркадьевичем Курцером в декабре 2012 г. [8].
Однако данные зарубежных коллег свидетельствуют о том, что профилактическое использование баллонной окклюзии аорты – это более эффективный и менее инвазивный метод, нежели окклюзия общих подвздошных артерий, который может уменьшить интраоперационную кровопотерю, снизить объем переливаемой крови и значительно увеличить удельный вес органосохраняющих операций, что приведет к сохранению репродуктивной функции [9, 10]. Обобщение в этих работах результатов 230 случаев применения эндоваскулярной баллонной окклюзии аорты при КС у пациенток с врастанием предлежащей плаценты показало эффективность данного метода в плане снижения кровопотери, времени операции, частоты гистерэктомии (в обсервационной группе гистерэктомии не было), объема переливания крови, послеродовых кровотечений и дней пребывания в отделении интенсивной терапии по сравнению с группой пациенток, у которых данная методика не применялась (гистерэктомия выполнена из-за массивной кровопотери в 3 случаях из 38). Достоверной разницы в показателях Апгар новорожденных и частоте тромбозов нижних конечностей между двумя группами не выявлено.
Хотя, безусловно, риск развития артериальных тромбозов при применении метода эндоваскулярной баллонной окклюзии аорты, как при любых эндоваскулярных вмешательствах, исключить нельзя. Опыт военно-полевой хирургии свидетельствует, что при минимизации времени раздувания баллона (менее 60 минут) и профилактическом применении гепарина в низких дозах этого риска можно избежать [11].
Клиническое наблюдение
Пациентка М., 32 года, жительница области. Гинекологический анамнез отягощен первичным бесплодием в течение 10 лет, в 2014 г. проведена кистэктомия левого яичника, в анамнезе – эндометриоз. Данная беременность – первая, наступила в результате ЭКО с первой попытки, беременность двойней бихориальной биамниотической. На диспансерном учете по беременности с 8 недель. При УЗ-скрининге I триместра выявлено предлежание хориона 1-го плода. Первый эпизод мажущих кровянистых выделений отмечен в сроке беременности 19–20 недель на фоне полного благополучия. Была госпитализирована в ОПЦ Курганской области. При УЗИ выявлено полное предлежание плаценты 1-го плода. Подозрение на вращение плаценты. По УЗИ обращали на себя внимание выраженная васкуляризация и расширение сосудов в проекции шейки матки, по задней стенке высоко от внутреннего зева. Выставлен диагноз: беременность 19–20 недель. Бихориальная биамниотическая двойня. Отягощенный акушерский анамнез (бесплодие 1–10 лет). ЭКО 1. Центральное предлежание плаценты 1-го плода с признаками врастания. Был поставлен вопрос о перегоспитализации пациентки в ФГБУ «НИИ ОММ» МЗ РФ, куда она и была доставлена вертолетом. Госпитализирована в операционно-родовое отделение. При поступлении кровянистых выделений не было.
Проведено полное клинико-лабораторное исследование, по данным которого подтверждено центральное предлежание плаценты 1-го плода с признаками глубокой инвазии плацентарной ткани в ткани задней стенки матки, шейки матки и цервикальный канал (рис. 1).
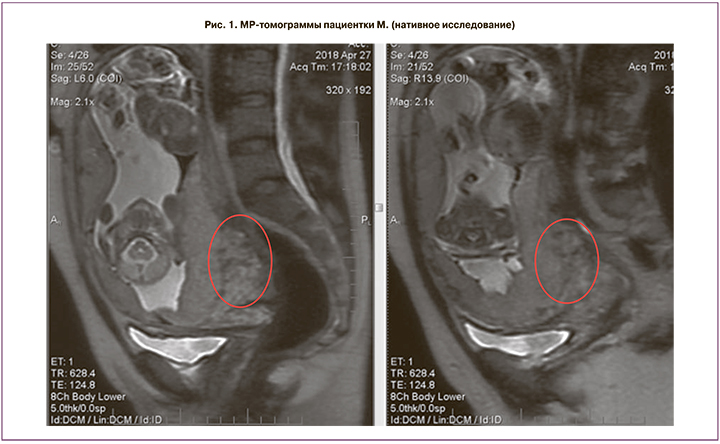
МРТ-исследование органов малого таза и плода в 3 ортогональных проекциях выполнено в режимах t1 w; t1 firm; t2 w, fiesta, lava, mrcp, DWI ИП (нативное исследование) на 19–20-й неделе беременности. В полости матки определяется дихориальная диамниотическая двойня. Плацента 2-го плода расположена по передней стенке. Плацента 1-го плода расположена по задней стенке и в области внутреннего зева, полностью его перекрывает. Определяется значительное утолщение задней стенки матки и смежного отдела стенки шейки матки (до 47 мм). В толще стенки матки определяются множественные извитые и расширенные тонкостенные сосуды. Общий размер патологически измененного участка стенки матки и шейки 83×50×86 мм. Контуры прилежащей части плаценты неровные, местами нечеткие и прерывистые. МРТ-картина предлежания плаценты 1-го плода с признаками врастания.
Данная ситуация предполагала радикальную тактику, но после дополнительного обсуждения с целью уточнения глубины инвазии плацентарной ткани и дифференциальной диагностики с объемным образованием шейки матки, в целях уточнения диагноза решено было провести МРТ-исследование с контрастированием (рис. 2).

Необходимость проведения дополнительного исследования с контрастом (не рекомендуемая во время беременности) была обоснована необходимостью уточнения диагноза, поскольку проводилась дифференциальная диагностика между сосудистым образованием, обширной инвазией плаценты и онкологическим процессом. Данный вопрос был обсужден на экстренном заседании Этического комитета института и мультидисциплинарном консилиуме, пациентка была проинформирована о дополнительном методе исследования. Было получено дополнительное информированное согласие пациентки.
Проведено МРТ-исследование органов малого таза в 3 ортогональных проекциях в режиме lava (до и после введения контрастного препарата Гадовист 6,3 мл). Указанный выше очаг патологической перестройки шейки представляет собой обширный конгломерат извитых и расширенных тонкостенных сосудов, соединяющихся с расширенными венами паракольпия. Граница плаценты неровная четкая, прослеживается на всем протяжении. МРТ-картина соответствует АВМ (кавернозной гемангиомы?) задней стенки матки и шейки. Таким образом, при исследовании с контрастом была получена информация о связи выявленного образования с сосудистой сетью паракольпия, что предполагало высочайший риск жизнеугрожающего кровотечения у пациентки на любом этапе последующего наблюдения.
На расширенном консилиуме, который включал в себя специалистов рентгеноэндоваскулярной диагностики и лечения, рентгенографических методов лечения, сосудистых хирургов областной клинической больницы № 1 и акушеров-гинекологов Федерального института охраны материнства и младенчества, было принято решение продолжить вынашивание беременности. При появлении необходимости родоразрешения КС решено провести с эндоваскулярной временной баллонной окклюзией аорты.
В сроке гестации 22 недели и 5 дней на фоне полного благополучия из половых путей появились яркие кровянистые выделения в объеме до 250 мл. Пациентка была переведена в операционную, вызваны сосудистый хирург и рентгенохирург, пациентка подготовлена к оперативному лечению.
Учитывая начавшееся кровотечение у пациентки с центральным предлежанием плаценты, высокий риск развития интраоперационной массивной кровопотери, методом анестезиологической защиты была выбрана общая анестезия [12]. Исходно использовалась тотальная внутривенная анестезия с миорелаксацией и искусственной вентиляцией легких через интубационную трубку, после восстановления целостности матки и до перевода пациентки в послеоперационную палату реанимации – ингаляционная анестезия на основе севофлурана. Выбор метода анестезии является в данном случае дискутабельным. Однако, поскольку до операции уже было кровотечение в объеме 250 мл, остановились на методе общей анестезии.
Выполнена пункция правой бедренной артерии, установлен интродьюсер 11 Fr. Проводник Amplatz 0,035 дюйма – 260 см – проведен в брюшной отдел аорты. По проводнику через интродьюсер заведен и установлен в брюшной отдел аорты выше бифуркации и ниже почечных артерий (под контролем УЗИ) баллон Amplatser II – 24 мм. Баллон раздут — контроль правильной установки, затем сдут до извлечения новорожденных (рис. 3).
Далее выполнена нижнесрединная лапаротомия, донное КС, на 7-й и 8-й минуте извлечены дети: мужского пола 650 г, 2/5 баллов, и женского пола массой 560 г, 2/5 баллов. На ИВЛ новорожденные переведены в отделение реанимации и интенсивной терапии новорожденных. К сожалению, исход для новорожденных неблагоприятный – оба ребенка погибли: мальчик в раннем неонатальном периоде, на 3-е сутки, девочка – в позднем неонатальном периоде, на 12-е сутки.
Донное КС было выбрано в связи с тем, что полностью исключить вероятность вращения предлежащей плаценты первого плода мы не могли, хотя при ретроспективной оценке случая считаем возможной в данной ситуации методику КС в нижнем сегменте, поскольку передняя стенка нижнего сегмента по данным УЗИ и МРТ была свободной от плацентарной ткани.
После извлечения новорожденных был раздут баллон, находящийся в аорте, – до прекращения пульсации на бедренной артерии, после чего извлечены последы, в матку введен баллон для осуществления баллонной тампонады внутренней поверхности матки, целостность матки восстановлена непрерывными швами (2 ряда). Проведено дренирование брюшной полости, необходимость которого была обусловлена возможностью более тщательного контроля гемостаза у данной пациентки.
Общая кровопотеря составила 800 мл (300 мл до операции и 500 мл интраоперационно). Длительность окклюзии аорты – 35 мин. Операция проводилась в условиях развернутого Cell-saver для реинфузии крови, однако с учетом небольшой кровопотери возврата крови не было.
После операции проведено влагалищное исследование, удален баллон из полости матки, в цервикальном канале обнаружен большой участок плацентарной ткани – удален, вслед за баллоном выделились сгустки и яркая кровь в объеме 200 мл, баллон в аорте раздут повторно. Проведена тугая тампонада влагалища.
Через 1 ч тампон из влагалища удален (в условиях баллонной тампонады аорты), осмотрена в зеркалах – выделения кровянистые скудные, баллон в аорте сдут, кровотечение прекратилось. Длительность повторной окклюзии аорты – 20 мин. Баллон фиксирован к коже отдельными швами. Пациентка переведена в послеоперационную палату. Общая кровопотеря составила 1000 мл. Гемотрансфузия с учетом исходной анемии – эритроцитарная взвесь 859 мл. Совокупная длительность баллонной окклюзии – 55 минут (35 минут при первом этапе окклюзии и 20 минут при втором). Контроль за правильностью окклюзии осуществлялся УЗ-методом.
Баллон в сдутом состоянии оставлен в аорте. В течение суток наблюдения кровотечения не было, через 24 ч проведены удаление внутриаортального баллона, удаление интродьюсера, ушивание дефекта общей бедренной артерии (3 мм) под местной инфильтрационной анестезией с потенцированием внутривенной анестезией. Пациентка выписана на 9-е сутки.
Благодаря интраоперационному применению временной баллонной окклюзии аорты удалось избежать массивной кровопотери и сохранить пациентке репродуктивную функцию. В настоящее время пациентка планирует следующую беременность. Хотя окклюзия брюшной аорты баллоном широко используется в разных дисциплинах в качестве новой медицинской техники, в то же время она мало используется в акушерстве в разных странах мира [13, 14].
Заключение
Избежать гистерэктомии и сохранить репродуктивную функцию пациенток, не допуская массивной кровопотери, – важная задача современного акушерства. Ряд инновационных техник, разработанных в последние десятилетия, позволяют изменить подход к ведению таких пациенток на органосохраняющий. И одним из перспективных и эффективных направлений можно считать эндоваскулярную баллонную эмболизацию аорты. В России данная методика проведена впервые, и дальнейшее внедрение может быть эффективным и при других патологиях, сопровождающихся массивной кровопотерей, таких как врастание плаценты.



