Миома матки – наиболее часто встречающаяся доброкачественная опухоль органов женской половой системы. Так, в настоящее время она обнаружена у каждой 4–5-й женщины в мире, а в последние годы отмечена тенденция к «омоложению» заболевания [1–3]. Безусловно, у пациенток репродуктивного возраста приоритетными являются органосохраняющие методы лечения [4].
На сегодняшний день до конца не определена тактика ведения пациенток с миомой матки, планирующих в будущем осуществление генеративной функции. Выжидательная тактика в отношении миомы приводит к осложнениям во время беременности и родов в 10–40% случаев [3]. Медикаментозная терапия, дистанционные и современные миниинвазивные технологии, такие как фокусированная ультразвуковая аблация (ФУЗ-аблация) и эмболизация маточных артерий, в силу различных обстоятельств не заменили традиционную миомэктомию. Хирургическая коррекция миомы зачастую является одним из этапов репродуктивных технологий и позволяет восстановить детородную функцию женщины [4, 5].
В практической деятельности большинство специалистов склоняются к консервативно-пластическим методам лечения миомы у женщин репродуктивного возраста в случае субмукозной локализации узлов, атипичной локализации (перешеечной, интралигаментарной), субсерозных узлов больших размеров на узком основании, глубоко расположенных интрамуральных узлов более 3 см и интрамуральных узлов более 5 см [6].
Однако хирургическое лечение влечет за собой определенные риски для женщины, планирующей беременность. Они связаны с наличием рубца на матке, спаечным процессом в малом тазу после оперативного вмешательства. Немаловажное значение имеет рецидив миомы матки, влекущий за собой необходимость повторного хирургического вмешательства, что неблагоприятно сказывается на репродуктивном потенциале женщины и ее психоэмоциональном состоянии.
Информация о частоте несостоятельности рубца на матке значительно варьирует. По данным обзора литературы H.H. Syam с 1980 по 1990 г. данное осложнение наиболее часто встречалось после лапароскопических миомэктомий. Однако начиная с 2000 г. количество сообщений о разрыве матки по рубцу после оперативного лечения с использованием эндоскопии значительно уменьшилось [7]. На сегодняшний день большинством авторов признано, что при выполнении миомэктомии у женщин репродуктивного возраста обязательно зашивание ложа удаленного миоматозного узла двухрядным либо трехрядным швом при максимально точном сопоставлении краев раны. Коагуляция ложа недопустима, так как во время беременности значительно возрастает риск гистопатического разрыва матки.
По данным ряда авторов, вероятность рецидива миомы матки после миомэктомии составляет 31–55% [8, 9]. В работе Hanafi и соавт. (2005) показано, что в течение 5 лет после оперативного лечения при одиночных узлах рецидив миомы встречается в 12–22% случаев, при множественной миоме – в 74% [10]. В качестве рисков по возникновению рецидива миомы матки в различных работах указаны возраст пациентки, ее вес, паритет, количество миоматозных узлов, размер максимального узла, сочетание миомы матки с гиперпластическими процессами эндометрия, эндометриозом.
Большинство исследователей утверждают, что вероятность рецидива связана с тщательностью удаления всех имеющихся миоматозных узлов.
В связи с высокой частотой рецидива миомы матки после хирургического лечения, а также относительно высокой частотой случаев несостоятельности рубца во время беременности особую актуальность приобретает вопрос о доступе и технике оперативного вмешательства при выполнении миомэктомии, а также адъювантной терапии в послеоперационном периоде. Не менее важно выявление рисков и разработка методов прогнозирования рецидива миомы матки у пациенток, планирующих беременность и определение оптимального периода для реализации детородной функции с учетом состояния рубца на матке и риска рецидива фиброида.
С позиций доказательной медицины нет данных о том, что лапароскопическая или открытая миомэктомия в отдаленным периоде повышают риск рецидива миомы матки и разрыва матки по рубцу во время беременности. По данным Кохрановского обзора (2014) не доказано влияние доступа при проведении реконструктивно-пластических операций на матке на частоту рецидива миомы и несостоятельности послеоперационного рубца [11].
В литературе встречаются единичные работы, посвященные исследованию рецидивов миомы матки и состоянию рубца после робот-ассистированной лапароскопической миомэктомии.
Цель исследования: анализ рецидивов миомы матки и состояния послеоперационного рубца у пациенток репродуктивного возраста после лапароскопической робот-ассистированной миомэктомии.
Материал и методы исследования
За период с ноября 2009 г. по июль 2015 г. в клинике женских болезней и репродуктивного здоровья ФГБУ НМХЦ им. Н.И. Пирогова Минздрава России с использованием роботизированного комплекса «da Vinci Si» 44 пациенткам с миомой матки в возрасте от 25 до 45 лет (в среднем 35±3,1) в плановом порядке была выполнена миомэктомия. Показанием для операции служили крупные или множественные фиброиды с субсерозным, субсерозно-интрамуральным и интрамуральным расположением, симптомная миома матки, миома матки в сочетании с бесплодием. Масса тела пациенток составила 65,66±6,75 кг, индекс массы тела 23,88±3. Из 44 женщин 35 планировали беременность в ближайший год, 9 – в более отдаленный период.
Предоперационная подготовка, положение больных на операционном столе не отличались от таковых при традиционной лапароскопии. Для обезболивания больных использовался комбинированный эндотрахеальный наркоз.
В настоящем исследовании использовалась аппаратура для выполнения лапароскопических робот-ассистированных операций «da Vinci Si» фирмы Intuitive Surgical (США), состоящая из эргономичной консоли хирурга, стойки с четырьмя интерактивными роботизированными руками у операционного стола, высокопроизводительной системы обзора InSite и патентованных инструментов EndoWrist.
Техника робот-ассистированной лапароскопической миомэктомии в точности соблюдает все принципы ранее разработанных открытых (лапаротомных) миомэктомий и повторяет основные приемы органосберегающего хирургического лечения миомы матки. Для уменьшения интраоперационной кровопотери выполнялась временная окклюзия маточных артерий наложением турникета вокруг шейки матки через «окна» в широких связках матки (рационализаторское предложение № 12194/5 от 27.10.2010), либо вазоконстрикция путем введения в миометрий в зоне предполагаемого рассечения физиологического раствора с адреналином [6]. Зашивание ложа узла проводилось двухрядным либо трехрядным швом с использованием современного рассасывающегося шовного материала (викрила 2/0–3/0, V-loc 180). При вскрытии полости матки викрилом 5/0–7/0 проводилось ушивание эндометрия.
Из 44 больных с миомой матки у 34 (77,3%) были дополнительно диагностированы другие гинекологические заболевания: эндометриоидная болезнь различной локализации – у 28, спаечная болезнь – у 17, болезни яичников и маточных труб – у 15, патология эндометрия – у 2, что также потребовало выполнения симультанных хирургических вмешательств.
Статистическая обработка данных проводилась непараметрическими методами с расчетом средних и относительных величин. Для определения различий между несвязанными группами рассчитывались критерии Манна−Уитни, критическое значение р=0,005; критерий χ2 и точный двусторонний критерий Фишера, критическое значение р=0,05. Для оценки связи между группами проводился корреляционный анализ с определением r-коэффициента Спирмена, корреляция между группами считалась статистически значимой при р≤0,05. Для статистической обработки данных использовалась программа Statistica 10 (англоязычная версия) компании Statsoft.
Результаты собственных исследований
Нами был проведен Саll-опрос (телефонный звонок) пациенток после робот-ассистированной лапароскопической миомэктомии. Из 44 женщин удалось связаться с 31. Две пациентки, прооперированные в 2015 г., не подлежали опоросу ввиду короткого периода после операции (менее трех месяцев).
У 17 пациенток (54,9%) из 31 выявлен рецидив миомы матки: через 6 месяцев – у 4 пациенток, через 1 год – у 8 пациенток, через 2 года – у 5. У 13 пациенток отмечен рост одного узла, у 4 – множественная миома матки. У 11 женщин размер узла не превышает 3 см, у 6 – свыше 3 см. У 9 пациенток миома матки носит бессимптомный характер, 8 отмечают меноррагии. У двух женщин отмечен рецидив миомы с быстрым ростом узлов, в одном случае – на отмену мефипристона, во втором – в протоколе стимуляции ЭКО. Пяти пациенткам проводилась адъювантная терапия продолжительностью от 6 месяцев до 5 лет (визанна, мифепристон, жанин, новаринг, внутриматочная система мирена), во всех случаях отмечена стабилизация роста узла по данным ультразвукового и магнитно-резонансного исследования органов малого таза в динамике. Повторное хирургическое лечение было проведено 1 пациентке (гистерорезектоскопическая миомэктомия), 1 пациентка планирует повторное хирургическое лечение в течение полугода в объеме лапароскопической миомэктомии как подготовительный этап к ЭКО. 1 пациентке была выполнена ФУЗ-аблация миомы матки, 1 женщине последовательно были выполнены неселективная эмболизация маточных артерий и ФУЗ-аблация миоматозного узла больших размеров.
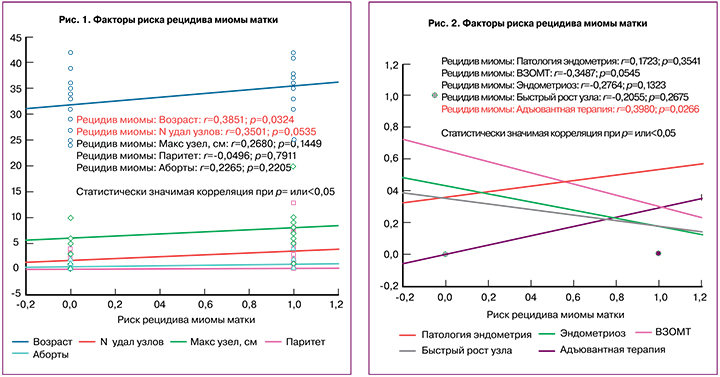
При проведении корреляционного анализа умеренная положительная связь обнаружена между риском рецидива миомы матки и возрастом пациентки, а также количеством удаляемых узлов (рис. 1).
Повышение риска миомы матки, связанное с возрастом, было продемонстрировано во многих исследованиях (R. Tal, J.H. Segars, 2014) [12]. При множественной миоме матки повышается риск рецидива, что связано с большей технической сложностью в элиминации всех узлов. Маточные фиброиды очень малых размеров остаются в толще миометрия и дают рецидив миомы в отдаленном послеоперационном периоде.
В нашем исследовании не получено статистически значимой связи между риском рецидива миомы матки и размером максимального узла, паритетом, количеством абортов, воспалительными заболеваниями органов малого таза, а также с патологией эндометрия, эндометриозом различной локализации и быстрым ростом узла в анамнезе (рис. 2).
Противоречивые данные, полученные в отношении умеренной положительной корреляционной связи между проведением адъювантной терапии и повышением при этом риска рецидива миомы обусловлены низкой комплаентностью пациенток и началом терапии уже после рецидива маточного фиброида с целью стабилизации роста узла, а не в качестве превентивной меры.
Всем пациенткам регулярно (1 раз в 6–12 месяцев) проводится ультразвуковое исследование органов малого таза, в ходе которого не получено эхографических данных о несостоятельности рубца после миомэктомии, толщина миометрия не отличается от таковой в области интактной ткани. У 11 (64,7%) пациенток наступила беременность: у 9 женщин – спонтанное наступление беременности в естественном цикле; две беременности наступили в результате ЭКО. В 5 наблюдениях (29,4%) беременность завершилась рождением здоровых доношенных детей. У одной пациентки произошли нормальные своевременные самопроизвольные роды, послеродовой период протекал без осложнений. В 4 наблюдениях при доношенных сроках в плановом порядке произведено кесарево сечение. При этом у всех женщин интраоперационно миометрий в области рубца на матке после миомэктомии не был истончен. Операции и послеоперационный период протекали без осложнений. В настоящее время у 2 пациенток беременность прогрессирует (22 и 24 недели). Их состояние и параметры плода удовлетворительные. В ходе скринингового ультразвукового исследования во II триместре беременности эхографических данных о несостоятельности рубца после миомэктомии не получено. В обоих случаях беременность протекает благоприятно.
Обсуждение полученных результатов
По данным Е.А. Калининой с соавт., максимальная частота возникновения рецидивов миомы матки отмечалась через год после оперативного вмешательства [13]. Есть работы, указывающие на максимальную частоту рецидива через 2 года – 43,6% [9], через 5 лет – 50–62% [9, 10], через 8–9 лет – 50–84,4% [14]. В наших исследованиях отмечено, что наибольшее количество рецидивов приходится на отдаленный послеоперационный период от 1 года. Следовательно, именно в течение этого времени пациенткам необходимо рекомендовать зачатие в естественном цикле или прибегнуть к вспомогательным репродуктивным технологиям. В качестве превентивной меры рецидива миомы матки в послеоперационном периоде у женщин репродуктивного возраста необходим подбор адъювантной терапии с учетом индивидуальных особенностей пациентки и ее назначение на срок от 6 до 12 месяцев в зависимости от состояния рубца на матке и репродуктивных планов больной.
Pitter и соавт. (2013) провели крупный многоцентровой анализ, посвященный исследованию течения беременности и родов у пациенток после робот-ассистированной лапароскопической миомэктомии. Исследованию подлежали 107 женщин, у которых случились 127 беременностей, 92 из которых закончились родами. Был зафиксирован один разрыв матки [15]. В 2014 г. описан случай разрыва матки по рубцу во время беременности в сроке 37–38 недель после робот-ассистированной лапароскопической миомэктомии [16].
Полученные нами данные свидетельствуют об эффективности робот-ассистированной миомэктомии в формировании полноценного рубца на матке. У всех пациенток во время беременности и в родах рубец был состоятельным, одна женщина была родоразрешена через естественные родовые пути, при этом роды и послеоперационный период протекали без осложнений. Надо отметить, что во всех случаях зашивание ложа узла проводилось опытным хирургом с использованием современного шовного материала. Использование методик для снижения интраоперационной кровопотери позволило минимизировать электрохирургическое воздействие с целью гемостаза и уменьшить тем самым риск гистопатического разрыва матки во время беременности.
Заключение
Использование роботизированных технологий в медицине в перспективе поможет избежать нежелательных последствий хирургического органосохраняющего лечения миомы матки. Робот-ассистированная лапароскопическая миомэктомия несет в себе достоинства минимальной травматизации, что уменьшает образование спаек в послеоперационном периоде и способствует скорейшей реабилитации пациентки. В то же время прецизионность за счет трехмерной визуализации и уникальных инструментов EndoWrist, полностью копирующих движения человеческой руки, способствует более тщательному удалению миоматозных узлов и формированию полноценного рубца на матке. Робот-ассистированную лапароскопическую миомэктомию следует рассматривать как эффективный метод органосохраняющего реконструктивно-пластического лечения миомы матки у пациенток репродуктивного возраста, планирующих в будущем реализацию генеративной функции.



