Патологические варианты прикрепления плаценты объединены в один термин – placenta accreta spectrum disorders (PAS), представляющий собой осложнение беременности, связанное с аномальным прикреплением и врастанием плаценты; проявляется в ее неспособности отделиться от стенки матки, что приводит к массивной кровопотере, высокой материнской и неонатальной смертности [1]. Во всем мире в настоящее время выявлен неуклонный рост частоты встречаемости PAS, начиная от 1:4000 родов в 1970 г. до 1:213 в наши дни, что обусловлено увеличением частоты оперативных родоразрешений [2, 3]. PAS является одной из ведущих причин (до 38%) гистерэктомий в мире [4, 5]. Риск таких осложнений, как массивное кровотечение, повреждение мочевого пузыря, гистерэктомия, значительно снижается благодаря своевременной диагностике и правильной хирургической тактике, что, в свою очередь, дает возможность проведения органосохраняющей операции [6–8]. Особое место занимает органосохраняющая хирургия или частичная резекция миометрия плацентарной площадки с дальнейшей метропластикой, внедренная в клиническую практику в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России с 2014 г. [9].
Ультразвуковое исследование (УЗИ) является основным инструментом для диагностики врастания плаценты, позволяющим своевременно и корректно спланировать сроки и методы оперативного вмешательства, максимально снизив риски развития осложнений как для матери, так и для плода [10, 11].
В соответствии с консенсусными рекомендациями Международной Федерации гинекологии и акушерства (FIGO) факторы риска врастания плаценты могут быть разделены на 3 основные группы [12].
В первую из них входят такие хирургические манипуляции, как кесарево сечение, хирургическое прерывание беременности, кюретаж полости матки, миомэктомия, резекция эндометрия, синдром Ашермана. Печальным остается тот факт, что частота родоразрешений путем кесарева сечения продолжает расти во всем мире, количество родов с помощью кесарева сечения при отсутствии клинических показаний с 1990-х гг. выросло более чем в 3 раза – с 6 до 21%. В России, по официальным данным, частота выполнения кесарева сечения составляет около 30% [13, 14].
Во вторую группу факторов риска врастания плаценты входят нехирургические манипуляции: вспомогательные репродуктивные технологии (ВРТ), эмболизация маточных артерий, химио- и лучевая терапия, эндометрит, ручное отделение плаценты в анамнезе. А, как известно, число родов после ВРТ за период с 2012 г. по 2020 г. увеличилось в 2,3 раза [15–18].
И наконец, к третьей группе факторов риска врастания плаценты относятся врожденные патологии матки и приобретенные патологии миометрия: аномалии развития матки, аденомиоз, субмукозная миома. Популяционная частота врожденных пороков развития женских половых органов колеблется от 2,7 до 4% [19, 20].
Двурогая матка – один из наиболее частых вариантов аномалий матки, возникающий вследствие неполного слияния парамезонефральных протоков в процессе эмбриогенеза. Различают 3 формы двурогой матки: полная, неполная, двурогая матка с перегородкой [21].
Известно, что у пациенток с патологией развития внутренних половых органов повышена частота самопроизвольных абортов, преждевременной отслойки нормально расположенной плаценты, преждевременных родов и гибели плода [22]. Также аномалии развития матки могут являться причиной бесплодия, аномалий родовой деятельности и неправильного положения плода, приводя к увеличению частоты экстракорпорального оплодотворения, инструментальных выскабливаний стенок полости матки и кесарева сечения [22], увеличивая вероятность врастания плаценты у данной категории пациенток.
Имеются единичные опубликованные клинические наблюдения врастания плаценты у пациенток с пороками развития матки [23–26]. В мировой литературе представлены данные о 4 пациентках с подобным сочетанием аномалий.
Haberal E.Т. et al. (2016) представили клиническое наблюдение пациентки с повторной беременностью и рубцом на матке после операции кесарева сечения, проведенной 7 лет назад. Беременная была госпитализирована в экстренном порядке в сроке 18 недель беременности в связи с острыми болями внизу живота и клинической картиной геморрагического шока. УЗИ выявило прогрессирующую беременность, солидную массу, прилежащую к матке, и гемоперитонеум. Проведена экстренная лапаротомия, в ходе которой выявлено удвоение матки. На передней стенке матки, в которой развивалась беременность, визуализировалась активно кровоточащая область размером 2×3 см – прорастание плаценты до серозного слоя. При влагалищном исследовании определено наличие продольной перегородки во влагалище и две шейки матки. Операционной бригадой принято решение о проведении надвлагалищной гемигистерэктомии беременной матки. Второй рог матки и придатки были оставлены в связи с желанием пациентки сохранить менструальную и репродуктивную функцию. Объем интраоперационной кровопотери составил 2000 мл. Гистологическое исследование подтвердило врастание плаценты в удаленной матке [23].
Ashton E. et al. (2013) [24] опубликовали опыт ведения родов у пациентки с двурогой маткой и привычным невынашиванием: самопроизвольными прерываниями беременности в сроках 8 и 19 недель беременности, осложненными остатками плодного яйца, в связи с которыми трехкратно проводилось выскабливание стенок полости матки. Третья беременность закончилась своевременными оперативными влагалищными родами с применением вакуум-экстракции живого плода в сроке 39 недель. В третьем периоде родов отсутствовали клинические признаки отделения плаценты, были выполнены ручное обследование стенок послеродовой матки и безуспешная попытка ручного отделения последа, заподозрено врастание плаценты, которое было подтверждено при УЗИ. Произведена магнитно-резонансная томография (МРТ), также подтвердившая врастание плаценты в правом роге матки. Ввиду отсутствия кровотечения и желания женщины сохранить репродуктивную функцию, было принято решение оставить плаценту in situ с дальнейшим динамическим наблюдением. Однако на вторые сутки послеродового периода у пациентки отмечены развитие болевого синдрома в нижних отделах живота, влагалищное кровотечение, объем которого авторами не уточнен, падения гематокрита на 8%, в связи с чем в экстренном порядке произведена лапаротомия, удаление правого рога матки с сохранением левого рога и придатков. Патоморфологическое исследование удаленного рога подтвердило врастание плаценты [24].
Zhang С. et al. (2021) [25] опубликовали случай осложненной беременности в двурогой матке после метропластики по Штрассману. Акушерский анамнез данной пациентки отягощен первичным бесплодием, двумя неразвивающимися беременностями, наступившими с помощью ВРТ. Третья беременность наступила естественным путем и осложнилась врастанием плаценты, диагностированным на УЗИ и МРТ в сроке 22 недели беременности. В сроке 28 недель в связи с развитием кровотечения из половых путей проведено экстренное оперативное родоразрешение, во время которого обнаружены разрыв рубца после метропластики, предлежание и врастание плаценты на участке 4×5 см, продолжающееся кровотечение. Операционной бригадой произведено кесарево сечение выше области врастания плаценты, извлечен живой недоношенной мальчик массой 1350 г, удалены части плацентарной ткани вне зоны врастания, произведена тампонада полости матки марлевым тампоном. Объем кровопотери на данном этапе составил 4000 мл. На 2-е сутки послеоперационного периода попытка удаления тампона из полости матки сопровождалась массивным кровотечением объемом 2000 мл за 5 минут. Проведены релапаротомия, гистерэктомия с интраоперационной кровопотерей 2500 мл. Дальнейшее течение послеродового периода заявлено как нормальное [25].
Ngichabe S. et al. (2017) [26] опубликовали наблюдение беременности при двурогой матке и врастании плаценты, не диагностированными на антенатальном этапе. В сроке 35 недель пациентка обратилась с резкими болями внизу живота. При осмотре в приемном отделении диагностированы антенатальная гибель плода, выраженные перитонеальные симптомы у беременной, нестабильная гемодинамика. Произведено экстренное кесарево сечение, где находкой для хирургов был ранее не диагностированный дополнительный правый рог матки, признаки врастания плаценты в беременном левом маточном роге, гемоперитонеум объемом 2000 мл. После извлечения мертвого плода признаков отделения последа не было; при попытке отделения плаценты началось массивное кровотечение, в связи с чем произведена гемигистерэктомия с сохранением второго рога и придатков. Общий объем кровопотери авторами не указан [26].
Очевидно, что все опубликованные в зарубежных источниках клинические наблюдения сочетания врожденных пороков развития матки и врастания плаценты сопровождались геморрагическими осложнениями, органоуносящими операциями, высокой частотой перинатальных осложнений, включая гибель плода. Особенно необходимо подчеркнуть факт отсутствия своевременной антенатальной диагностики врастания плаценты в 3 из представленных наблюдений.
Учитывая клиническую значимость сочетания подобных аномалий и увеличивающееся количество пациенток с факторами риска врастания плаценты, мы посчитали целесообразным представить собственное наблюдение ведения и родоразрешения пациентки с врастанием плаценты и пороком развития репродуктивной системы.
Клиническое наблюдение
Пациентка Д., 43 года, проходила лечение в ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России.
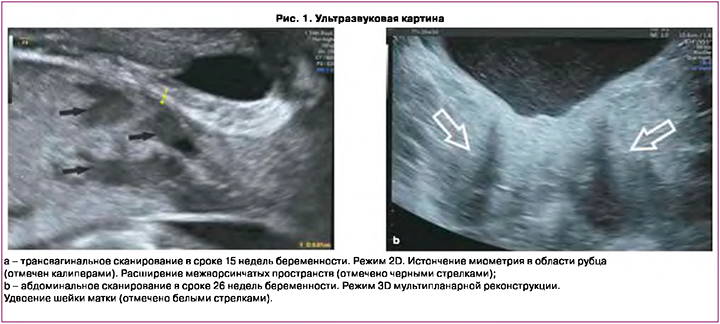
Из анамнеза: первая беременность, наступившая естественным путем в 1998 г., была прервана в сроке 6 недель по желанию пациентки – медицинский аборт (аbrasio cavi uteri). В 2017 г. при проведении обследования по поводу вторичного бесплодия у пациентки диагностированы врожденная аномалия развития матки: двурогая матка c перегородкой (тип U3c по классификации Европейского общества репродукции человека и эмбриологии (ESHRE)), удвоение шейки матки (рис. 1), перегородка влагалища и гиперплазия эндометрия, миома матки (FIGO тип 5). Выполнено резектоскопическое рассечение фиброзной внутриматочной перегородки, раздельное диагностическое выскабливание стенок полости матки и цервикальных каналов.
Вторая беременность, наступившая после экстракорпорального оплодотворения в 2019 г., имела неосложненное течение. В сроке 39 недель в связи с ножным предлежанием плода было проведено оперативное родоразрешение: родилась живая здоровая девочка массой 2830 г, ростом 49 см.
Настоящая беременность – третья, наступила после экстракорпорального оплодотворения в 2021 г. При проведении ультразвукового пренатального скрининга в сроке 12 недель беременности плацента перекрывала область послеоперационного рубца, отмечено истончение миометрия в области рубца в ретроплацентарной области до 1,0 мм. Пациентка отнесена в группу высокого риска врастания плаценты.
За время наблюдения во II и III триместрах беременности состояние матери и плода оставалось удовлетворительным, эпизодов кровяных выделений из половых путей и болевых ощущений в области рубца у беременной не отмечалось.
При динамическом ультразвуковом контроле была отмечена миграция плаценты от краевого предлежания в сроке 15 недель беременности до расстояния 50 мм над внутренним зевом в сроке 36 недель беременности. Однако сохранялась эхографическая картина субплацентарного локального истончения миометрия до 0,5–0,7 мм на участке размерами 38×40 мм, исчезновение нормальной гипоэхогенной зоны между плацентарной тканью и миометрием и расширение плацентарных межворсинчатых пространств на данном участке – эхографические признаки placenta accreta (рис. 1) [27].
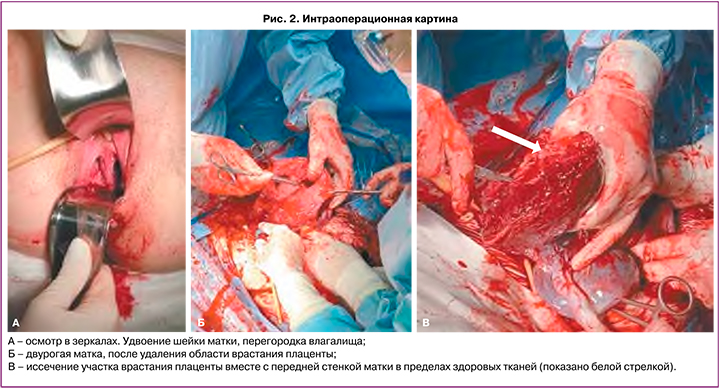
Плановое оперативное родоразрешение было проведено в сроке беременности 36 недель 5 дней. Выполнено оперативное пособие в объеме: поперечное надлобковое чревосечение с иссечением старого кожного рубца, кесарево сечение в нижнем маточном сегменте поперечным разрезом по верхнему краю плаценты, комплексный компрессионный гемостаз, метропластика, выскабливание полости матки, реинфузия аутоэритроцитов в объеме 250 мл. Интраоперационно на передней стенке матки в нижней трети определялись расширенные до 5 мм сосуды плаценты, истонченный до 1 мм рубец до 1 мм на всем протяжении, плацентарная грыжа размерами 98×120 мм. Выполнить кесарево сечение в нижнем маточном сегменте при врастании плаценты позволил метод интраоперационной ультразвуковой навигации. УЗИ передней стенки матки производится стерильным конвексным датчиком. Данная процедура позволяет в точности определить границу края плаценты и выбрать оптимальный разрез на матке, тем самым уменьшив потенциальный объем кровопотери. По верхнему краю плаценты производится разрез на матке. Извлечен живой доношенный мальчик массой 3180 г, ростом 50 см. Оценка состояния по шкале Апгар 8/9 баллов. Имелся участок врастания размерами 40×35 мм в переднюю стенку матки по типу placenta accreta, остальная часть плаценты имела плотное прикрепление. Участок врастания вместе со стенкой матки иссечен в пределах здоровых тканей (рис. 2В). На уровне перешейка матки наложен центральный турникет, затянут на уровне шейки, фиксирован зажимом. Отчетливо визуализировались две полости матки (рис. 2Б), произведен кюретаж области врастания плаценты и затем выполнена пластика передней стенки матки – дефект стенки матки зашивается отдельными П-образными швами с последующей перитонизацией. При осмотре в зеркалах визуализируется перегородка во влагалище толщиной до 2 см (рис. 2А). Послеоперационный период протекал без осложнений для матери и ребенка; выписаны с ребенком на 5-е сутки после операции.
При патологоанатомическом исследовании на материнской поверхности в краевой и парацентральной зоне присутствовали аномально прикрепленные участки миометрия размерами 6×8 см (рис. 3А).

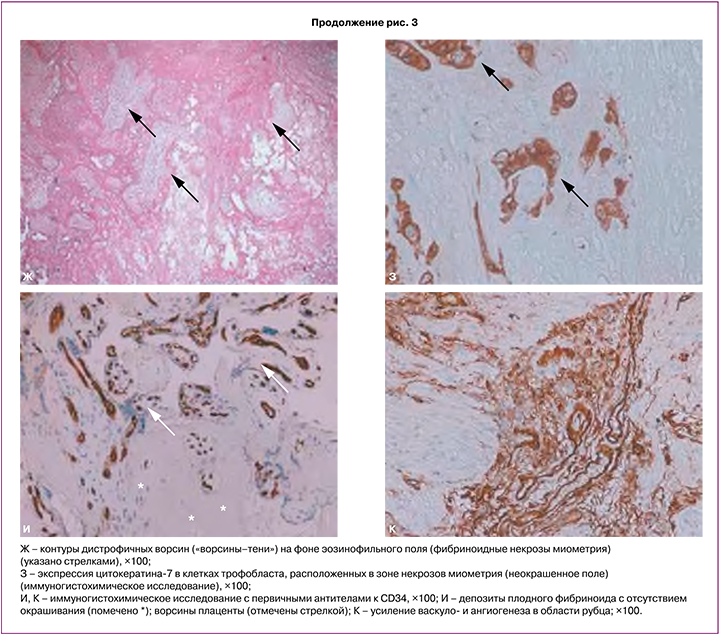
Морфологическое исследование включало макроскопическое и гистологическое исследование плаценты и иссеченные фрагменты миометрия в области плотного прикрепления и врастания. При гистологическом исследовании морфологическая картина соответствует placenta accreta, на ограниченном участке 40×35 мм с врастанием до серозной оболочки (рис. 3Б–Г). В миометрии видны разрастания соединительной ткани в виде септ, отмечено повышенное количество плодного фибриноида в зоне плотного прикрепления и врастания на фоне уменьшения количества децидуальных клеток и разрушения децидуальной пластинки (рис. 3Д, Е). На ограниченном участке отмечены очаговые асептические некрозы миометрия с наличием замурованных ворсин с дистрофическими изменениями («ворсины-тени») (рис. 3Ж, З) [27, 28]. Участки множественных кровоизлияний и гематом миометрия (рис. 3Б). При окрашивании CK7 имело место окрашивание клеток трофобласта области асептических некрозов миометрия (рис. 3З). Миометрий в области врастания (передняя стенка матки – область рубца) был с повышенным количеством сосудов различного калибра, что определялось при окрашивании CD34 (рис. 3И, К). Гистологическое исследование полностью подтвердило интраоперационную картину и предшествующее УЗИ.
В представленном клиническом наблюдении у пациентки имелись множественные факторы риска врастания плаценты из всех трех основных групп классификации FIGO [12]: врожденная аномалия матки, оперативная коррекция порока, раздельные диагностические выскабливания стенок полости матки, миома матки, использование ВРТ и кесарево сечение в анамнезе.
Заключение
Таким образом, в представленном клиническом наблюдении у пациентки с многочисленными факторами риска диагноз морфологически верифицированного врастания плаценты был установлен еще в первой половине беременности и благодаря координированной работе мультидисциплинарной команды специалистов «НМИЦ АГП им. В.И. Кулакова» – акушеров-гинекологов, врачей ультразвуковой диагностики, анестезиологов-реаниматологов, трансфузиологов – беременность была пролонгирована до срока 37 недель, а апробированный хирургический метод при врастании плаценты позволил избежать органоуносящих оперативных техник.



