Ежегодно растущая частота ожирения является одной из основных проблем современного общества. По данным медицинской статистики в настоящее время число женщин, имеющих избыточный вес или ожирение, составляет больше 20% всех женщин, вступающих в беременность [1]. При этом, известно, что избыточный вес негативно отражается на течении беременности, повышая частоту материнской и перинатальной заболеваемости и смертности, что, в свою очередь, становится одной из основных проблем современной медицины [2–5]. По результатам клинических исследований и проведенного мета-анализа показано, что помимо негативного влияния на течение беременности, избыточный вес является фактором, снижающим эффективность лечения бесплодия с использованием методов вспомогательных репродуктивных технологий [6]. Большинство исследователей сходятся во мнении, что ожирение оказывает негативное воздействие на процессы фолликуло-, оогенеза и раннего эмбриогенеза, рецептивность эндометрия и частоту наступления беременности [7–10].
В ряде работ показана взаимосвязь между ожирением и нарушением структуры и функции митохондриального ретикулума – основной энергопреобразующей внутриклеточной системы, обладающей также регуляторными способностями в отношении клеточных процессов [11]. Оказалось, что существует корреляция между степенью ожирения и такими параметрами активности митохондрий, как величина трансмембранного потенциала митохондрий, скорость синтеза АТФ, протяженность ретикулума и его внутриклеточная локализация, емкость по ионам кальция и др. При этом нарушение регуляции активности митохондрий отрицательно влияет на метаболический гомеостаз в целом. Накопленные экспериментальные данные позволяют предположить, что у женщин, страдающих ожирением, по сравнению с женщинами, имеющими нормальную массу тела, наблюдаются структурные и функциональные митохондриальные нарушения в ооцитах, а также статистически значимо больший процент ооцитов с множественным веретеном деления и дезорганизацией хроматина [12]. Для оценки влияния избыточного веса на оо-, фоликуло- и ранний эмбриогенез было проведено исследование на грызунах, в рамках которого было выявлено, что у страдающих ожирением рекомбинантных мышей наблюдается значимое снижение уровня энергетического метаболизма ооцитов и предимплантационных эмбрионов, коррелирующее с более низкой вероятностью наступления беременности [11].
Это позволило предположить, что одним из механизмов, ведущих к репродуктивным неудачам при ожирении, является нарушение функционального состояния митохондриального ретикулума и опосредованный этим энергетический дисбаланс.
В последние годы была разработана система оценки критериев состояния митохондриального аппарата в клетках периферической крови с использованием проточной цитометрии. Данный метод был апробирован для исследования влияния сепсиса или ВИЧ-инфекции на состояние митохондриального аппарата, а также взаимосвязи митохондриальной дисфункции и клинических исходов [13, 14].
В связи с этим нами было проведено пилотное исследование функционального состояния митохондрий в мононуклеарах периферической крови у пациенток с нормальным, избыточным весом и ожирением, позволившее охарактеризовать взаимосвязь избыточной массы тела, функциональной активности митохондрий и успешности имплантации. Предложен диагностический метод оценки качества ооцитов в программах вспомогательных репродуктивных технологий на базе апробированной технологии оценки.
Цель исследования: оценить показатели митохондриальной функции мононуклеаров периферической крови у женщин с различным индексом массы тела в программе ЭКО и проанализировать взаимосвязь исследованных показателей с исходами лечения.
Материал и методы исследования
Исследование было проведено в отделении вспомогательных технологий в лечении бесплодия ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России и в лаборатории митохондриальной медицины. В исследование были включены пациентки, соответствующие следующим критериям: возраст от 18 до 37 лет; нормальный овариальный резерв (по данным ультразвукового исследования визуализируются 5–7 антральных фолликулов с каждой стороны, уровень антимюллерового гормона >1,1 нг/мл, ФСГ<8,0 МЕ/л [15]); отсутствие оперативных вмешательств на яичниках, наружного генитального эндометриоза, миом матки, фертильная/субфертильная сперма у супруга.
Исследование состояло из двух этапов. На первом этапе проводился анализ оценки функциональной активности митохондрий в мононуклеарах периферической крови у 55 пациенток. На втором этапе проводилась сравнительная оценка эффективности программ ЭКО и переноса эмбрионов (ПЭ) у 148 пациенток.
До вступления в программу ЭКО утром натощак производилось измерение массы тела, роста, объема талии, объема бедер и рассчитывался индекс массы тела (ИМТ) по формуле Кетле:
ИМТ=масса тела/рост (кг/м2).
Все пациентки, включенные в исследование, были разделены на 3 группы в зависимости от показателя индекса массы тела:
 I группу составили 24 женщины с нормальной массой тела (ИМТ=18,5–24,99 кг/м2), средний вес 61,28±6,2 кг; II группу – 16 пациенток с избыточной массой тела (ИМТ=25,0–29,99 кг/м2), средний вес 74,82±7,2 кг; III группу – 15 пациенток с ожирением (ИМТ >30,0 кг/м2), средний вес 96±13,4 кг.
I группу составили 24 женщины с нормальной массой тела (ИМТ=18,5–24,99 кг/м2), средний вес 61,28±6,2 кг; II группу – 16 пациенток с избыточной массой тела (ИМТ=25,0–29,99 кг/м2), средний вес 74,82±7,2 кг; III группу – 15 пациенток с ожирением (ИМТ >30,0 кг/м2), средний вес 96±13,4 кг.
Анализ параметров энергопреобразующей функции митохондрий проводили на мононуклеарных клетках периферической крови (МНК). Для выделения МНК использовали периферическую венозную кровь, взятую у пациенток натощак до начала стимуляции суперовуляции в пробирки с этилендиаминтетраацетатом (ЭДТА) (Sarstedt). Для оценки влияния применения гонадотропинов на функциональную активность митохондрий перед проведением трансвагинальной пункции яичников производился повторный забор венозной крови. Использовали стандартную методику выделения МНК на градиенте фиколла (Sigma) плотностью 1,077 г/мл.
Для оценки трансмембранного потенциала митохондрий выделенные МНК окрашивали флуоресцентным красителем JC1 (Life technologies) по протоколу, рекомендованному производителем, и методом проточной цитометрии оценивали распределение клеток по интенсивности окраски в зеленом и красном канале (рис. 1 см. на вклейке).
Для оценки жизнеспособнсти клеток использовали краситель пропидий йодид (Life technologies).
Измерение проводили на проточном цитофлуориметре (BD FACS Calibur). Для каждой пробы измеряли два показателя: долю высокополяризованных МНК и величину, характеризующую потенциал митохондрий в МНК. В качестве величины, характеризующей потенциал митохондрий в клетках крови, использовали интегральный показатель митохондриальной энергопреобразующей функции (ИПМЭФ). ИПМЭФ рассчитывали как (М красный 1/М зеленый 1) – (М красный 2/ М зеленый 2), где М красный 1 и М зеленый 1 – медианы интенсивности свечения высокополяризованных МНК в интактной пробе на длинах волн 590 и 529 нм соответственно, а М красный 2 и М зеленый 2 – медианы интенсивности свечения высокополяризованных МНК в контрольной пробе, в которую был добавлен разобщитель дыхания карбонилцианид-4-(трифторметил)-фенилгидразоном (Sigma) в конечной концентрации 7 µМ.
Статистическую обработку данных проводили с помощью программы Statistica 6.
Результаты и обсуждение
Пациентки исследуемых групп были сопоставимы по параметрам овариального резерва. Анализ распространенности экстрагенитальных и гинекологических заболеваний статистически значимых различий между группами не выявил. Исследуемые параметры не коррелировали с возрастом пациенток, что позволило в данном исследовании рассматривать всю выборку как одну возрастную группу.
Средний возраст женщин в I группе составил 30,5±3,8 года, во II – 32,2±3,1 года, в III – 31,7±4,7 года. В I группе пациенток показатель соотношения объема талии к объему бедер составил 0,72±0,04, во II и III группах данный показатель составил 0,82±0,06 и 0,88±0,1 соответственно, что говорит о распространении ожирения по висцеральному типу у пациенток с избыточной массой тела и ожирением.
Средняя суммарная доза затраченных гонадотропинов в I и II группах практически не различалась и составила 1452,1±406 МЕ и 1489,3±480 МЕ, в то время как в III группе суммарная доза гонадотропинов была достоверно выше, чем в группе женщин с нормальной массой тела, и составила 1895,0±804МЕ (p=0,03). Продолжительность лечения не различалась между двумя первыми группами и составила 9,43±1,6 и 9,57±1,3 дня соответственно, в то время как в группе женщин с ожирением данный показатель составил 11,2±3,0 дня, что было достоверно выше, чем в I группе (p=0,02).
Число зрелых ооцитов достоверно не различалось между I и II группами. В III группе данный показатель составлял 4,4±0,9 и был снижен как по сравнению с I группой (6,4±0,6; p=0,03), так и по сравнению со II группой (7,1±1,0; p=0,06).
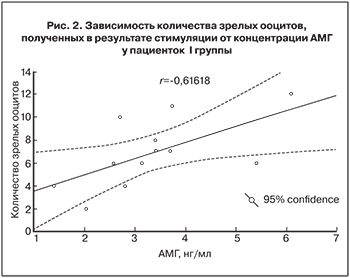
В I группе число зрелых ооцитов, полученных при стимуляции, достоверно коррелировало с концентрацией АМГ в крови пациенток до стимуляции (r=0,62; рис. 2).
В II и III группах отсутствовала корреляция между уровнем АМГ и количеством зрелых ооцитов, полученных в результате стимуляции.
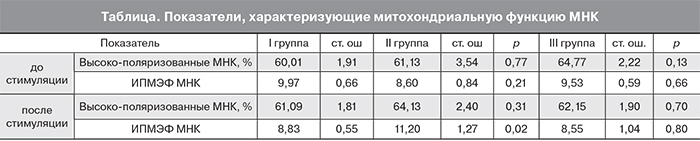
При анализе показателей, характеризующих митохондриальную функцию МНК (таблица), достоверное различие между I и II группами было выявлено для ИПМЭФ МНК после стимуляции. Данный показатель в группе с избыточным весом был выше, чем в группе с нормальным (p=0,02, критерий χ2 с поправкой Йетса). Группа с ожирением по исследуемым параметрам не отличалась от группы контроля.
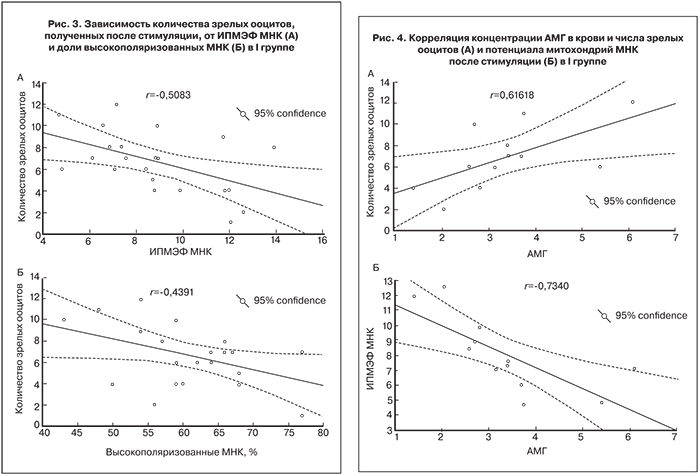
В I группе наблюдалась обратная корреляция ИПМЭФ/числа зрелых ооцитов после стимуляции (r=-0,5), и доли высокополяризованных МНК/числа зрелых ооцитов после стимуляции (r=-0,4), (рис. 3А, Б соответственно).
В то же время концентрация АМГ положительно коррелировала с числом зрелых ооцитов (r=0,6) и отрицательно – с потенциалом митохондрий в МНК (r=-0,7; рис. 4А, Б).
В II и III группах концентрация АМГ, ИПМЭФ МНК, доля высокополяризованных МНК и число зрелых ооцитов между собой не коррелировали.
Таким образом, можно сделать предположение о том, что АМГ, угнетая энергопреобразующую функцию митохондрий посредством разобщения дыхания и окислительного фосфорилирования, достоверно снижает митохондриальный потенциал в мононуклеарах крови женщин с нормальным ИМТ (I группа). В соответствии с данными о прямой зависимости продукции активных форм кислорода от величины мембранного потенциала [16] можно заключить, что при стимуляции функции яичников у женщин с нормальным весом АМГ выполняет роль мягкого разобщителя и обладает защитным действием, предохраняя от избыточной продукции и повреждающего эффекта активных форм кислорода в отношении ооцитов. В то же время для пациенток с избыточным весом и ожирением в связи с повышенным содержанием в крови и тканях свободных жирных кислот, выполняющих функцию эндогенных разобщителей, наблюдается дисбаланс между уровнем мембранного потенциала и продукцией активных форм кислорода. Это приводит к формированию состояния хронического окислительного стресса, негативно воздействующего на ткань яичника и приводящего к уменьшению числа зрелых ооцитов.
На заключительном этапе был проведен комплексный анализ исходов лечения у пациенток с различными показателями ИМТ. Всего было проанализировано 148 циклов ЭКО и ПЭ. Сравнительный анализ исходов программ ЭКО и ПЭ показал, что частота клинической беременности из расчета на ПЭ была наибольшей у женщин с нормальной массой тела и составила 45%. В группах пациенток с избыточным весом (II группа) и ожирением (III группа) этот показатель составил 24,14 и 22,5% соответственно. При этом были выявлены статистически значимые различия по этому показателю между I и III группами. Таким образом, частота наступления клинической беременности из расчета на ПЭ у женщин с нормальной массой тела в 2 раза выше, чем у женщин с ожирением (χ²=5,27; p=0,022; ДИ 0,024-0,426). Процент имплантации у женщин с нормальной массой тела оказался в 2,8 раза выше, чем у женщин с ожирением (χ²=9,35; p=0,002; ДИ 0,067-0,301) (рис. 5 см. на вклейке).
Заключение
Данные о наличии корреляции величины ИПМЭФ и числа зрелых ооцитов, полученных при стимуляции функции яичников в программе ЭКО, находятся в согласии с данными о частоте наступления клинической беременности для женщин с нормальным, избыточным весом и ожирением. Вследствие этого определяемый в крови пациентов параметр ИПМЭФ может иметь диагностическое значение, достоверно предсказывая вероятность успешного исхода и наступления клинической беременности.



