В настоящее время проблема невынашивания беременности остается одной из ведущих в современном акушерстве. Актуальность данной проблемы связана с распространенностью этой патологии в структуре репродуктивных потерь, составляющей 15–20% всех клинически выявленных беременностей [1]. Поэтому поиск информативных маркеров-предикторов такого осложнения беременности представляет определенный научный и практический интерес. Особое значение имеют прогнозирование и доклиническая диагностика нарушений развития беременности [2, 3].
Несмотря на мультифакторную природу невынашивания беременности, одними из первостепенных причин являются иммунологические и генетические [4–6].
В последние годы внимание исследователей привлекает роль естественных Т-регуляторных клеток в индукции толерантности к аллоантигенам плода, которые в свою очередь позволяют расценивать их в качестве основных претендентов на роль клеток, контролирующих баланс в системе «мать-плод», а также предположить их участие в патогенезе невынашивания беременности [7]. Однако сообщения об этом в доступной литературе практически отсутствуют. В этом аспекте представляет интерес оценка местного цитокинового статуса, баланса и синтеза цитокинов периферической крови у женщин репродуктивного возраста [8–11].
Целью настоящего исследования является определение цитокинового баланса в сыворотке крови женщин с синдромом потери плода в анамнезе, а также выявление прогностической значимости полиморфизма генов в развитии данного состояния.
Материал и методы исследования
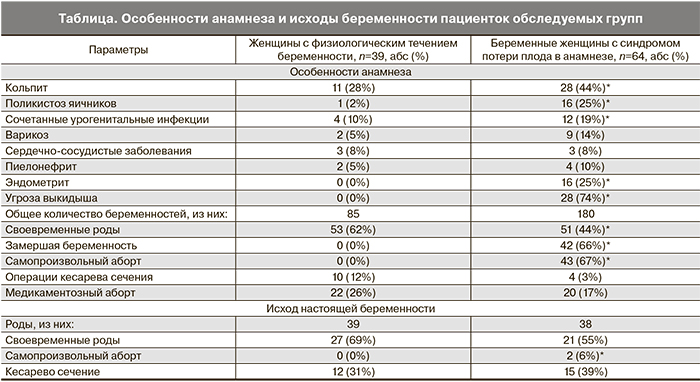
Обследованы 192 пациентки, наблюдающиеся в МУЗ Женская консультация № 5 и МУЗ Женская консультация № 6 г. Волгограда. Все обследуемые были разделены на три группы. Первую группу составили 39 женщин с физиологическим течением беременности, вторую – 64 беременных с синдромом потери плода в анамнезе. Группы были репрезентативны по возрасту (29±4,05 года) и сроку гестации (18±3,2 недели). Третью (контрольную) группу составили 89 небеременных соматически здоровых женщин без репродуктивных потерь в анамнезе (средний возраст 27,8±5,06 года).
Материалом для исследования послужила периферическая кровь пациенток, полученная при плановом посещении врача без проведения дополнительных манипуляций. Цитокины определялись с помощью наборов реактивов для иммуноферментного анализа производства ООО «Цитокин» (Санкт-Петербург): «ИФА-интерлейкин (IL-)-4», «ИФА-IL-6», «ИФА-IL-17а», «ИФА-IL-10», «ИФА-IL-1β», «ИФА-интерферон (IFN)-γ», «ИФА-фактор некроза опухоли (TNF)-α» на фотометре иммуноферментном планшетном «Эфос» 9305 (ОАО «Московский завод Сапфир», Москва). В наборах использован «сэндвич»-вариант твердофазного иммуноферментного анализа. Концентрация интерлейкинов в определяемых образцах рассчитывалась на основании калибровочной кривой, построенной по полученным значениям калибровочных проб. Исследование генетических полиморфизмов проводили с помощью диагностических наборов для выявления полиморфизмов в геноме человека методом полимеразной цепной реакции «SNP-экспресс» производства НПФ «Литех». Для исследования полиморфизмов генов провоспалительных цитокинов применялись наборы «Мутация интерлейкина 1β» (ген – IL-1β, полиморфизм – Т-31С), «Мутация интерлейкина 12β» (ген – IL-12β, полиморфизм – А1188С), «Мутация фактора некроза опухоли α» (ген – TNF, полиморфизм – G-308A), «Мутация интерлейкина 17а» (ген – IL-17a, полиморфизм – G-197A), «Мутация интерлейкина 17f» (ген – IL-17f, полиморфизм – His161Arg), «Мутация интерлейкина 6» (ген – IL-6, полиморфизм – C-174G), «Мутация интерлейкина 2» (ген – IL-2, полиморфизм – T-330G).
Для обнаружения полиморфизма генов противовоспалительных цитокинов использовались наборы «Мутация-1 интерлейкина 10» (ген – IL-10, полиморфизм – G-1082A), «Мутация-2 интерлейкина 10» (ген – IL-10, полиморфизм – С-592А), «Мутация-3 интерлейкина 10» (ген – IL-10, полиморфизм – C-819T), «Мутация интерлейкина 4» (ген – IL-4, полиморфизм – C-589T).
Особое значение в исследовании уделялось тщательному анализу акушерского-гинекологического анамнеза пациенток. Принималось во внимание наличие хронических инфекционных и неинфекционных заболеваний, наличие неблагоприятных производственных и экологических факторов, общее количество беременностей и исходы родов. Проведено проспективное наблюдение за течением и исходами настоящих беременностей. Получены данные скринингового обследования во всех триместрах беременности: общеклинические и гематологические исследования, определение маркеров пороков развития плода (уровень α-фетопротеина и хорионического гонадотропина), ультразвуковая фетометрия, допплерометрия, кардиотокография.
Статистические расчеты производили с помощью пакета прикладных программ Statistica 6.0 фирмы StatSoft, Inc. (США). Значимость различий при сравнении групп оценивалась непараметрическим U-критерием Манна–Уитни, достоверность различия частот встречаемости оценивали с помощью критерия χ2.
Результаты исследования и обсуждение
В результате обследования беременных женщин выявлено, что среди лиц с синдромом потери плода в анамнезе (2-я группа) по сравнению с женщинами, у которых беременность протекала физиологически (1-я группа), значимо выше частота кольпитов (44%), сочетанных урогенитальных инфекций (19%), эндометритов (25%), синдрома поликистозных яичников (25%). Установлено, что во 2-й группе обследуемых самопроизвольные выкидыши в анамнезе зарегистрированы в 67% случаев, при этом они происходили преимущественно в первом триместре на сроке 9±2,05 недели, у 66% женщин наблюдалась замершая беременность на сроке 8±4,02 недели. Кроме того, текущая беременность в исследуемой группе в 74% случаев была осложнена угрозой выкидыша на сроках 9±3,5 и 18±2,27 недели, подтвержденной данными ультразвукового и клинического исследования. Такие женщины были госпитализированы, им проводилось комплексное клинико-лабораторное обследование, спазмолитическая и седативная терапия, в первом триместре назначались препараты прогестерона. Настоящая беременность в группе женщин с синдромом потери плода в анамнезе закончилась самопроизвольным абортом на сроке 18±0,3 недели в 6% случаев (таблица).
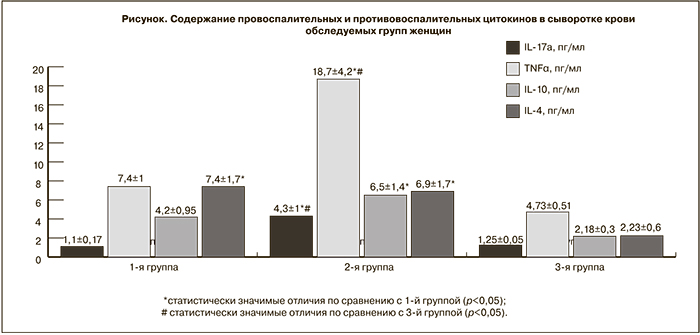
Анализ содержания провоспалительных (IL-1β, IL-6, IL-17а, IFNγ, TNFα) и противовоспалительных цитокинов (IL-10, IL-4) в сыворотке крови обследуемых групп женщин показал значимое увеличение уровня TNFα (18,7±4,2 пг/мл, р≤0,05) и IL-17а (4,3±1,0 пг/мл, р≤0,05) у беременных с синдромом потери плода в анамнезе по сравнению с группой женщин с физиологическим течением беременности (7,4±1,0 пг/мл и 1,2±0,2 пг/мл соответственно). При этом наблюдалось статистически значимое увеличение содержания IL-10 (6,5±1,4 пг/мл, р<0,05) и IL-4 (6,9±1,7 пг/мл, р<0,05) во второй группе обследуемых по отношению к контрольной группе (в среднем 2,2±0,5 пг/мл).
Обращает на себя внимание, что у женщин с физиологическим течением беременности наблюдался более высокий уровень IL-4 (7,4±1,7 пг/мл) по сравнению с таковыми показателями во 2-й и 3-й группах обследуемых (6,9±1,7 пг/мл и 7,1±1,5 пг/мл соответственно) (рисунок).
Согласно литературным данным, определенный уровень TNFα необходим для нормального развития беременности, так как ограничивает процессы синтеза ДНК клетками трофобласта, которые экспрессируют рецепторы для TNFα [12, 13].
Однако избыточная продукция TNFα приводит к нарушению микроциркуляции и тканевой гипоксии, что может негативно сказываться на развитии беременности. В результате происходит прогрессивное снижение маточно-плацентарного кровотока и нарушение метаболической, трофической, гормональной функции плаценты. IL-17а стимулирует выработку IL-6, IL-8, гранулоцитарного колониестимулирующего фактора, TNFα, простагландина Е2 клетками эпителия, эндотелия и фибробластами, проявляет выраженную провоспалительную активность [14, 15]. Следовательно, повышенный уровень IL-17а свидетельствует о наличии воспалительного компонента в сыворотке крови беременных женщин с синдромом потери плода в анамнезе.
IL-4 и IL-10 – противовоспалительные цитокины, повышенное содержание которых во время беременности является благоприятным прогностическим признаком, обеспечивая иммуносупрессию по отношению к развивающейся фетоплацентарной единице [3, 10–12]. Напротив, сохраняющийся высокий уровень провоспалительных цитокинов TNFα и IL-17а в группе женщин с синдромом потери плода в анамнезе свидетельствует о неустановившемся ко второму триместру иммунном балансе в системе мать-плод-плацента. Данное состояние может провоцировать угрозу прерывания беременности, наблюдающуюся в исследуемой группе.
При исследовании полиморфизма генов противовоспалительных цитокинов обнаружено значимо большее количество гетерозигот GA по полиморфному маркеру гена IL-10 (мутация 1, G-1082A) в группе женщин с синдромом потери плода в анамнезе (58%) в сравнении с группой женщин с физиологическим течением беременности (26%). При этом установлено, что количество гомозигот GG (26%) и AA (16%) было меньше, чем в группе женщин с физиологическим течением беременности (46 и 28% соответственно).
При анализе содержания цитокинов был обнаружен высокий уровень TNFα в группе женщин с синдромом потери в анамнезе, имеющим генотип GA по полиморфному варианту G-1082A гена IL-10 в сравнении с группой женщин с физиологическим течением беременности (17,3±4,8 пг/мл против 7,4±1 пг/мл), а уровень IL-4, напротив, был ниже (3,2±1,3 пг/мл против 7,4±1,7 пг/мл).
При анализе распределения аллелей и генотипов полиморфного маркера гена IL-4 (C-589-T) было установлено, что частота встречаемости нормальных гомозигот СС в группе женщин с синдромом потери плода в анамнезе (50%) была статистически ниже, чем в группе женщин с физиологическим течением беременности (69%). Напротив, гетерозиготы СТ во 2-й группе встречались чаще (39%), чем в 1-й (28%).
Анализ уровня цитокинов выявил следующие особенности: уровень IL-10 среди обследуемых женщин второй группы с генотипом СТ оказался статистически ниже (3,4±0,8 пг/мл, р<0,05), чем среди женщин с генотипом СС (8,3±2,6 пг/мл). В группе женщин с физиологическим течением беременности уровень IL-10 (4,2±0,95 пг/мл) значимо не отличался от уровня у женщин второй группы с генотипом СС.
Содержание IL-17а в сыворотке женщин с генотипами СС и СТ во 2-й группе обследуемых было выше (3,7±0,9 пг/мл и 5,6±1,2 пг/мл, р<0,05), чем в 1-й (1,1±0,17 пг/мл). То же касается и TNFα, уровень которого среди женщин с генотипом СС и СТ был выше (14,9±2,6 пг/мл и 20,9±3,9 пг/мл, р<0,05), чем в группе женщин с физиологической беременностью (7,4±1 пг/мл).
Уровень IL-4 среди женщин во 2-й группе с генотипом СТ оказался ниже (4,6±1,6 пг/мл), чем в 1-й (7,4±1,7 пг/мл).
При сравнении распределения частот аллелей и генотипов полиморфного маркера гена TNFα (G-308A) выяснилось, что частота встречаемости гетерозиготного генотипа GA в группе женщин с синдромом потери плода в анамнезе – 62 против 38% в группе женщин с физиологическим течением беременности. Нормальные гомозиготы GG во 2-й группе обследуемых встречаются в 33% случаев, в 1-й группе – в 62%. Таким образом, в группе женщин с синдромом потери плода в анамнезе наиболее распространен генотип GA – гетерозиготы по полиморфному маркеру гена TNFα (G-308A).
Анализ уровня цитокинов выявил, что у женщин с генотипами GG и GA 2-й группы значительно увеличен уровень TNFα в сыворотке крови (14,4±1,5 пг/мл и 21,2±2,8 пг/мл, р<0,05), что статистически отличается от его уровня в 1-й группе (7,4±1 пг/мл). Уровень IL-17а у женщин 2-й группы с генотипом GA был выше (5,2±0,8 пг/мл), чем у женщин с генотипом GG (2,9±1,2 пг/мл). Среди женщин 2-й группы с генотипом GA уровень противовоспалительного IL-4 оказался статистичеcки ниже (2,5±0,5 пг/мл, р<0,05), чем в 1-й группе (7,4±1,7 пг/мл) и у женщин с генотипом GG (15±6 пг/мл), как и уровень провоспалительного IL-1β (5,5±0,8 пг/мл против 8,0±1,04 пг/мл в 1-й группе).
Статистически значимые отличия были также выявлены при анализе распределения частот встречаемости аллелей и генотипов полиморфного маркера гена IL-17f His161Arg (7488A/G). Количество гетерозигот AG в этой группе превышало таковое в 1-й группе (42 против 15%), а количество нормальных гомозигот AA было статистически ниже (52 против 82%).
У женщин 2-й группы с генотипом АА наблюдалось более высокое значение IL-17а и TNFα (4,2±0,8 пг/мл и 20,5±3,5 пг/мл, р<0,05) в сравнении с 1-й группой (1,1±0,17 пг/мл и 7,4±1 пг/мл), то же касается уровня IL-17а и TNFα среди женщин с генотипом АG (4,4±1,1 пг/мл и 18,5± 3,6 пг/мл, р<0,05). У женщин 2-й группы, имеющих генотип АG по полиморфному маркеру гена IL-17fHis161Arg (7488A/G), уровень противовоспалительного IL-4 был ниже (3,5±0,8 пг/мл, р<0,05), чем в 1-й группе (7,4±1,7пг/мл) и у женщин с генотипом АА (7,5±1,2 пг/мл).
Следовательно, наличие высокого уровня провоспалительных и более низкого уровня противовоспалительных цитокинов среди гетерозигот в группе женщин с синдромом потери плода в анамнезе в сравнении с обследуемыми, у которых беременность протекает физиологически, свидетельствуют о дисфункции физиологического иммунного переключения с Th1- на Th2-путь во втором триместре беременности. Большой процент хронических инфекционных и неинфекционных заболеваний урогенитального тракта среди обследуемых женщин может служить важным патогенетическим фактором в нарушении иммунной реактивности при беременности и формировании угрозы выкидыша.
Заключение
Таким образом, у беременных женщин с синдромом потери плода в анамнезе наблюдаются нарушения баланса про- и противовоспалительных цитокинов, что проявляется повышением уровня IL-10, IL-6, IL-17а, TNFα в сыворотке крови. Увеличение количества провоспалительных цитокинов (TNFα и IL-17а) на фоне высокого уровня противовоспалительных (IL-10 и IL-4) свидетельствует о нарушении процесса перестройки иммунной системы в сторону преобладания иммуносупрессорных механизмов ко второму триместру беременности. В большинстве случаев гиперпродукция провоспалительных и снижение содержания противовоспалительных цитокинов в сыворотке крови женщин с синдромом потери плода в анамнезе связана с наличием гетерозиготного аллельного варианта генов IL-17f His161Arg, TNFα (G-308A), IL-4 (C-589-T). При этом индивидуальной особенностью женщин с невынашиванием беременности является аддитивный эффект нескольких вариантов полиморфных генов, что создает неблагоприятный фон для инициации, развития и пролонгирования беременности. Наличие в анамнезе хронических воспалительных неинфекционных и инфекционных заболеваний увеличивает вероятность осложнений во время беременности, в том числе приводит к синдрому потери плода.
Следовательно, оценка цитокинового баланса в сыворотке крови и типирование аллельных вариантов генов цитокинов, наряду с тщательным сбором акушерско-гинекологического анамнеза, позволяет своевременно предупредить развитие осложнений во время беременности, в том числе во втором триместре. Особенно важным представляется определение цитокинового профиля на этапе прегравидарной подготовки, что позволит провести своевременную профилактику нарушения течения беременности, в том числе потерю плода.



