Согласно рекомендациям Международного общества по менопаузе, программа сохранения здоровья женщины в пери- и постменопаузе представляет собой комплексный подход, который должен включать в себя рациональный режим питания, регулярную физическую активность, а также гормональную заместительную терапию аналогами половых стероидных гормонов, являющуюся основным методом профилактики и лечения климактерического синдрома [1]. Основной целью гормональной заместительной терапии является достижение оптимального минимального уровня гормонов в организме женщины, приводящего к устранению патологических симптомов климактерия, нормализации обменных процессов при минимальном риске побочных реакций, связанном с приемом препарата. В 2013 году на Всемирном консенсусе был принят термин «менопаузальная гормональная терапия» (МГТ) [2]. Согласно заключению консенсуса, доза и длительность МГТ должны быть согласованы с целями лечения и вопросами безопасности и индивидуализированы [2]. Также является важным вопрос о выборе эстрогенного и прогестагенного компонентов в составе МГТ и способе их введения [3].
Известно, что трансдермальное применение натуральных эстрогенов в сочетании с интравагинальным способом введения микронизированного прогестерона имеет ряд преимуществ. Определено, что трансдермальный способ введения эстрогенного компонента позволяет избежать первичного прохождения через печень и связан с меньшим риском венозного тромбоза, а интравагинальное применение прогестерона оказывает защитное влияние на эндометрий, но обладает меньшим количеством системных побочных эффектов [4]. Кроме того, очевидно, что пациентки в пери- и постменопаузе имеют достаточно высокую частоту сопутствующей соматической патологии, что также необходимо учитывать при назначении МГТ и минимизации возможных рисков терапии.
Цель исследования – оценить эффективность и безопасность микронизированного прогестерона в составе циклической и непрерывной комбинированной МГТ у женщин в пери- и постменопаузе.
Материал и методы исследования
В исследование были включены 63 женщины с климактерическим синдромом различной степени тяжести. В зависимости от фазы климактерия пациентки были разделены на две группы и определены следующие критерии включения.
Для первой группы:
- перименопаузальный период,
- возраст от 45 до 52 лет,
- гипергонадотропная овариальная недостаточность,
- наличие климактерического синдрома (легкой, средней или тяжелой степени тяжести).
Для второй группы:
- постменопаузальный период (длительность менопаузы не менее 2 лет),
- возраст от 52 до 58 лет,
- наличие климактерического синдрома легкой, средней или тяжелой степени тяжести.
Критериями исключения для двух групп были: онкологические заболевания, наличие тяжелой соматической патологии, а также тромбозы и тромбоэмболии в анамнезе.
У всех пациенток перед назначением МГТ проводилось следующее обследованиe: измерение артериального давления, определение индекса массы тела (ИМТ), ультразвуковое исследование (УЗИ) органов малого таза с применением трансвагинального датчика, мазок с поверхности шейки матки и цервикального канала на онкоцитологию, маммография, биохимический анализ крови, включающий определение уровней АЛТ, АСТ, билирубина, холестерина, сахара, коагулограмма, определение уровня тиреотропного гормона (ТТГ).
При необходимости в группе пациенток в перименопаузальном периоде проводилось определение уровней ФСГ и ЛГ. По показаниям выполнялось углубленное обследование свертывающей системы крови: расширенная коагулограмма, D-димер, внутрисосудистая агрегация тромбоцитов, двухэнергетическая рентгеновская абсорбциометрия поясничного отдела позвоночника и проксимального отдела бедренной кости.
Назначаемые режимы менопаузальной гормональной терапии:
Для пациенток в перименопаузе было рекомендовано применение эстрадиола гемигидрата в виде геля для наружного применения 1,0 или 0,5 мг трансдермально, ежедневно, непрерывно, в сочетании с назначением микронизированного прогестерона праджисан 200 мг «Сан Фармасьютикл Индастриз Лимитед» (Индия) интравагинально с 14-го по 28-й день ежемесячно на фоне применения эстрадиола гемигидрата.
Для женщин в постменопаузе использовался непрерывный монофазный режим применения МГТ – эстрадиола гемигидрата в виде геля для наружного применения 1,0 или 0,5 мг трансдермально, ежедневно, непрерывно на фоне непрерывного ежедневного интравагинального применения микронизированного прогестерона праджисан 200 мг.
Продолжительность наблюдения в двух группах составила 6 месяцев и состояла из 4 визитов. Алгоритм первого визита пациенток включал в себя сбор анамнеза, оценку тяжести климактерического синдрома, гинекологическое исследование, назначение необходимого клинико-лабораторного обследования. На повторном приеме (второй визит) проводился анализ результатов обследования и назначение менопаузальной терапии. Через один месяц от начала МГТ (третий визит) оценивалась эффективность гормональной заместительной терапии, наличие побочных эффектов и их выраженности, выполнялось контрольное УЗИ органов малого таза, а также определение ИМТ и артериального давления (АД) в динамике. На четвертом заключительном визите через 6 месяцев от начала МГТ также проводилась оценка эффективности терапии, побочных эффектов, определялись ИМТ и АД, выполнялось повторное УЗИ органов малого таза, биохимический анализа крови и коагулограмма (по показаниям у пациенток, получающих антиагрегантную терапию или гепатопротекторы).
Эффективность и безопасноcть заместительной МГТ у женщин в пери- и постменопаузе оценивали на основании:
- определения степени влияния на выраженность и купирование проявлений климактерического синдрома;
- стабильности менструального цикла (у женщин в перименопаузе – отсутствие межменструальных кровянистых выделений) и наличия аменореи на фоне МГТ у женщин в постменопаузе;
- отсутствия признаков гиперпластических процессов эндометрия (на основании динамического УЗИ органов малого таза через 1 и 6 месяцев от начала применения заместительной терапии);
- влияния данных схем МГТ на ИМТ, АД, биохимические и гемостазиологические показатели через 6 месяцев;
- переносимости данных схем гормональной терапии.
Схемы терапии и алгоритм обследования перед назначением МГТ рассматривались и были одобрены Локальным этическим комитетом ФГБУ НИИАГ им. Д.О.Отта СЗО РАМН.
Результаты и обсуждение
Первую группу составили 35 женщин в возрасте от 48 до 52 лет (средний возраст – 50,6±1,8 года) в перименопаузальном периоде с проявлениями климактерического синдрома различной степени выраженности. На основании результатов гормонального обследования у всех пациенток была подтверждена гипергонадотропная недостаточность яичников (уровень ФСГ составил 67,4±18,3 МE/мл, уровень ЛГ – 33,7±11,2 МE/мл).
Во вторую группу вошли 28 женщин с длительностью постменопаузы от 2 до 7 лет (в среднем 4,2±1,7 года) в возрасте от 52 до 58 лет (средний возраст – 55,3±2,9 года) с проявлениями климактерического синдрома.
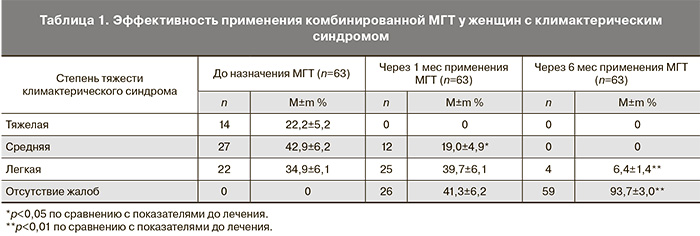
Тяжесть климактерического синдрома оценивалась на основании проведенного анкетирования. У 14 (22,2%) женщин отмечался климактерический синдром тяжелой степени, у 27 (42,9%) пациенток – средней степени тяжести, у 22 (34,9%) обследуемых – легкой степени. Известно, что основным компонентом для купирования проявлений климактерического синдрома является эстрогенный. Согласно современным принципам подбора МГТ – «использование минимально-эффективных доз для достижения максимального эффекта терапии», у 14 (22,2%) больных с тяжелой степенью выраженности климактерического синдрома и у 13 (20,6%) больных со средней степенью выраженности климактерического синдрома была рекомендована доза эстрадиола гемигидрата в виде геля для наружного применения 1,0 мг. У остальных пациенток с климактерическим синдромом средней и легкой степени доза эстрадиола гемигидрата составила 0,5 мг. Известно, что целесообразно начинать МГТ с минимальной адекватной дозы эстрогенного компонента, которую можно повысить в случае необходимости [1]. Доказано, что низкие и ультранизкие дозы также эффективны для купирования проявлений климактерического синдрома. Как и при применении эстрогенов, рекомендуется использовать прогестагены в минимально эффективной дозе с целью минимизации возможных побочных эффектов и рисков, однако следует помнить, что основной целью назначения прогестагенного компонента у женщин с интактной маткой является защита эндометрия от пролиферативного влияния эстрогенов [1, 2]. Кроме того, одним из принципов подбора МГТ является индивидуальный выбор режима и длительности гормональной терапии, способа введения препаратов с учетом показаний, противопоказаний и факторов риска [1].
Основанием для рекомендации трансдермального способа применения эстрогенного компонента и интравагинального введения прогестагенного компонента было наличие у пациенток какой-либо соматической патологии из нижеперечисленных. У 4 (6,4%) женщин отмечено наличие желчно-каменной болезни, артериальная гипертензия I-II степени наблюдалась у 14 (22,2%) пациенток, варикозная болезнь (варикозное расширение вен нижних конечностей) отмечена у 11 (17,5%) женщин, избыток массы тела диагностирован у 13 (20,6%) обследуемых (ИМТ составил 27,3±1,9), ожирение I степени – у 5 (7,9%) пациенток (ИМТ находился в пределах 32,5±1,4).
Несомненно, перед назначением МГТ женщинам с избытком массы тела и ожирением проводился глюкозо-толерантный тест (ГТТ), рекомендовались меры по снижению веса. После проведения ГТТ у 8 (12,7%) женщин было выявлено нарушение толерантности к глюкозе, у 2 (3,2%) больных – сахарный диабет 2-го типа. Пациентки с артериальной гипертензией обследовались у кардиолога, и назначение МГТ сочеталось с гипотензивной терапией. У 9 (14,3%) женщин диагностирована гиперхолестеринемия. На основании совокупности клинических проявлений и результатов клинико-лабораторного обследования у 10 (15,9%) пациенток был установлен метаболический менопаузальный синдром.
Женщины с варикозной болезнью были консультированы флебологом, рекомендовано ношение компрессионного трикотажа, пяти пациенткам (7,9%) до начала применения МГТ была выполнена флебэктомия. Кроме того, на основании проведенного лабораторного обследования перед назначением МГТ у 7 (11,1%) пациенток было отмечено незначительное повышение уровня АЛТ (38,4±3,6 ЕД/л), гипербилирубинемия отмечена у 8 (12,7%) женщин, что потребовало проведения УЗИ печени с последующим назначением гепатопротекторов (эссенциале) и/или желчегонных препаратов (хофитол), применение которых привело к нормализации данных показателей.
У 15 (23,8%) пациенток из группы риска (наличие у родственников первой линии тромбозов и инсультов в анамнезе, а также у пациенток с избытом массы тела, ожирением, артериальной гипертензией и варикозной болезнью) проводилось углубленное обследование свертывающей системы крови. На основании результатов расширенной коагулограммы, определения уровня D-димера, показателей внутрисосудистой агрегации тромбоцитов у 23% женщин потребовалось назначение антиагрегантов (кардиомагнила, тромбо-асса, курантила). По показаниям проводилось определение генов свертывающей системы крови. Ни у одной пациентки не было выявлено мутации в генах по фактору V (Лейдена) и фактору II (протромбина).
Согласно протоколу исследования и для исключения «масок климактерического синдрома», связанных с патологией щитовидной железы, у всех пациенток проводилось определение уровня ТТГ. На основании полученных данных у 5 (7,9%) женщин был диагностирован субклинический гипотиреоз, что потребовало назначения заместительной терапии левотироксином. На фоне лечения у всех пациенток было достигнуто эутиреоидное состояние. Также у данной группы пациенток изучалось наличие антител к тиреопероксидазе и тиреоглобулину, проводилось УЗИ щитовидной железы. На основании полученных результатов у 4 (6,4%) больных был установлен диагноз аутоиммунного тиреоидита, у 3 (4,8%) женщин – узлового нетоксического зоба, из них двум пациенткам потребовалось проведение тонкоигольной аспирационной биопсии с подтверждением коллоидного узла.
При анализе сопутствующих гинекологических заболеваний отмечено, что миома матки (интрамуральная, интрамурально-субсерозная, с максимальными размерами миоматозного узла не превышающим 2,3 см) наблюдалась у 8 (12,7%) женщин, аденомиоз – у 6 (9,5%) больных. В анамнезе у 3 (4,8%) больных был установлен наружный генитальный эндометриоз, простая железисто-кистозная гиперплазия эндометрия – у 4 (6,4%), полипы эндометрия (железистый, железисто-фиброзный) – у 5 (7,9%) женщин. У 18 (28,6%) женщин выявлен диффузный фиброаденоматоз молочных желез, у 4 (6,4%) пациенток – фиброзно-кистозная болезнь молочных желез, что потребовало консультации и дальнейшего наблюдения у маммолога.
На основании проведенной по показаниям двухэнергетической рентгеновской абсорбциометрии поясничного отдела позвоночника и проксимального отдела бедренной кости, у 11 (17,5%) больных был диагностирован остеопенический синдром, из них у 2 пациенток – выраженный остеопенический синдром (T-критерий – 2,3±0,4SD), что потребовало дополнительного назначения препаратов кальция в сочетании с витамином D3 на фоне проводимой МГТ.
Во время проведения второго визита (через 1 месяц от начала применения МГТ) было отмечено отсутствие пациенток с климактерическим синдромом тяжелой степени, значительно снизилось число пациенток с климактерическим синдромом средней степени выраженности (до 19,1%) (табл. 1), однако у данной группы пациенток было рекомендовано повышение дозы эстрогенного компонента до 1,0 мг.
У подавляющего большинства пациенток с первоначально легкой степенью тяжести климактерического синдрома жалобы практически исчезли, однако общее число пациенток с нейровегетативными и психоэмоциональными проявлениями легкой степени увеличилось до 39,7%, так как в эту группу вошли женщины, первоначально имевшие климактерический синдром тяжелой и средней степени тяжести (табл. 1).
Согласно результатам проведенного УЗИ органов малого таза, выполненного через 1 и 6 месяцев от начала применения МГТ, толщина эндометрия (М-эхо) не превышала 4 мм (в среднем 3,2±0,7 мм) у пациенток в постменопаузе и находилась в пределах от 4 до 7 мм (в среднем 5,5±1,3 мм) у женщин в перименопаузе, получающих гормональную терапию в циклическом режиме. Полученные данные свидетельствуют о хорошем контроле эндометрия и достаточном антипролиферативном влиянии используемой дозы прогестагенного компонента. Кроме того, на фоне проводимой МГТ у женщин с миомой матки не было отмечено тенденции к росту миоматозных узлов, хотя известна роль не только эстрогенного, но и прогестагенного компонента в процессе формирования и роста миом [5].
Анализируя результаты менограмм у женщин в перименопаузе, получающих МГТ в циклическом режиме, следует отметить, что только у 3 (4,8%) пациенток в течение первых двух циклов начало менструально-подобной реакции наблюдалось за 2–3 дня до окончания применения микронизированного прогестерона, а в дальнейшем, как и у остальных женщин, начало менструально-подобной реакции совпадало с окончанием применения прогестагена. У всех пациенток в постменопаузе, получающих гормональную заместительную терапию в непрерывном режиме, отмечалась стабильная аменорея. Недавно появились сообщения о возможном недостаточном защитном влиянии небольших доз микронизированного прогестерона на эндометрий [6], поэтому в данном исследовании у всех пациенток использовали дозу 200 мг.
На фоне проводимой МГТ все пациентки отмечали значительное улучшение качества жизни и достоверное уменьшение проявлений выраженности климактерического синдрома. Наблюдались невыраженные побочные эффекты, преимущественно легкой степени, которые не привели к отказу от проводимой МГТ. Наиболее часто встречающимся и практически единственным побочным эффектом у 8 (12,7%) женщин была мастодиния, что объясняется исходной мастопатией (у 22 (34,9%) женщин). Кроме того, согласно данным литературы, частота мастодинии на фоне различных схем эстроген-прогестагенной гормональной терапии в среднем составляет 17%. На фоне применения мастодинона через 2 цикла данный побочный эффект был устранен у всех пациенток. Известно, что ткани молочных желёз при фиброзно-кистозных изменениях, в большей степени при пролиферативных формах, характеризуются высоким содержанием рецепторов к прогестерону, что определяет их высокую чувствительность к эндогенному прогестерону и прогестагенам [7]. В одном из исследований было показано, что применение микронизированного прогестерона у женщин с фиброзно-кистозной болезнью приводит к снижению выраженности клинических симптомов заболевания (продолжительности, интенсивности и характера масталгии) [7]. Кроме того, вопрос о возможном влиянии МГТ на повышение частоты рака молочной железы по-прежнему остается актуальным и дискуссионным. Согласно Консенсусу по МГТ (2013) определено, что повышенный риск рака молочной железы первоначально ассоциирован с добавлением прогестагенного компонента к эстрогенной терапии и относится только к длительному применению МГТ [2]. Поэтому выбор прогестагенного компонента крайне важен. Известно, что не все прогестины одинаковы. Различный тип, доза, путь введения могут определять клинические эффекты относительно защиты эндометрия, сердечно-сосудистых эффектов, влияния на центральную нервную систему и молочные железы. В одном из исследований было показано, что применение микронизированного прогестерона в составе МГТ не сопровождается повышением частоты рака молочной железы [8].
Результаты повторных биохимических анализов и свертывающей системы крови у пациенток, получающих МГТ на фоне гепатопротекторов и/или антиагрегантов, показали, что вышеперечисленные показатели находятся в пределах физиологических значений. Согласно данным литературы, применение микронизированного прогестерона, не обладающего андрогенными и минералкортикоидными свойствами, в составе комбинированной терапии с трансдермальным применением эстрогенного компонента, не оказывает негативного влияния на массу тела, АД, липиды крови, уровень инсулина, С-реактивного белка, а также не повышает риск венозной тромбоэмболии [9, 10].
Следует отметить, что в двух группах пациенток назначение МГТ находилось в так называемых рамках «окна терапевтического воздействия» (возраст не старше 60 лет и длительность менопаузы не превышает 10 лет), когда польза от применения гормональной терапии значительно превышает возможные риски.
Важно, что после окончания шестимесячного курса МГТ все пациентки, включенные в исследование, продолжили применение данной терапии, что свидетельствует о высокой приверженности к проводимому лечению.
Заключение
На основании проведенного обследования показано, что применение препарата праджисан в составе циклической и непрерывной схем терапии у женщин с климактерическим синдромом различной степени выраженности сопровождается хорошей переносимостью, эффективным контролем эндометрия, низкой частотой побочных эффектов, что позволяет рекомендовать его как один из препаратов выбора в качестве прогестагенного компонента комбинированной МГТ.



