Заболевания, ассоциированные с паппиломавирусной инфекцией (ПВИ), на сегодняшний день являются одними из самых распространенных заболеваний, передаваемых половым путем [1].
Исследования, посвященные изучению новых методов лечения данной группы заболеваний, несомненно актуальны [2].
Клинические проявления ПВИ разнообразны. Вирус обладает большой контагиозностью и поражает различные слои населения. Практически любой человек, так или иначе, в различные периоды своей жизни подвержен заболеваниям, ассоциированными с ПВИ.
Условно можно выделить две формы проявлений ПВИ – эндофитную и экзофитную. Экзофитная представлена остроконечными кондиломами, являющимися наиболее характерным проявлением ПВИ. Остроконечные кондиломы (соndilomata acuminata) представляют собой одиночные или множественные сосочковые фиброэпителиальные разрастания на поверхности кожных покровов и слизистых оболочек. Цвет этих образований может варьировать и зависит от кровенаполнения: от бледно-розового до красно-коричневого. Остроконечные кондиломы могут быть представлены образованиями на тонкой ножке, широком основании, в виде одиночного узелка или разрастаний множественных – в виде «цветной капусты».
Поверхность кондилом покрыта многослойным плоским эпителием и нередко кератинизирована, в подлежащей строме располагаются сосуды. Возникающие в ряде случаев воспаление, расстройство микроциркуляции и отек способствуют присоединению вторичной инфекции.
Причиной остроконечных кондилом в 90% случаев является ВПЧ 6-го или 11-го типа [3]. Кроме того, при наличии остроконечных кондилом может выявляться ВПЧ типов 16, 18, 31, 33 и 35 (как правило, сочетаясь с ВПЧ 6 или 11). В этом случае иногда определяются участки интраэпителиальной неоплазии, особенно у лиц, инфицированных ВИЧ-инфекцией. В дополнение к аногенитальным бородавкам, ВПЧ типов 6 и 11 ассоциированы с паппиломатозными поражениями конъюнктивы, носа, полости рта, гортани.
Остроконечные кондиломы обычно протекают бессимптомно, но в зависимости от размера и анатомического расположения характеризуются проявлениями зуда и боли в области поражения. Остроконечные кондиломы возникают обычно в определенных анатомических областях, в том числе вокруг Introitus у женщин, под крайней плотью пениса, могут образоваться одновременно на нескольких областях аногенитального тракта, например, шейке матки, влагалища, уретры, промежности, кожных покровов перианальной области и мошонки. Интраанальные бородавки наблюдаются преимущественно у лиц, практикующих анальный секс, но они также могут возникнуть у мужчин и женщин, не имеющих опыта нетрадиционных половых контактов [4].
Диагностика остроконечных кондилом в первую очередь основана на визуальном осмотре.
Остроконечные кондиломы могут быть подвержены биопсии, если:
- диагноз не ясен;
- поражения не отвечают на стандартную терапию;
- течение болезни ухудшается во время терапии;
- поражение нетипично;
- бородавки пигментированные, плотные, малоподвижны или неподвижны, кровоточат или изъязвлены.
Использование ДНК-тестирования ВПЧ для диагностики аногенитальных кондилом не рекомендуется, потому что результаты исследования не изменят тактику лечения.
Применяемые методы лечения папилломавирусной инфекции в настоящее время нельзя признать вполне удовлетворительными, в связи с чем тактика ведения пациентов неоднозначна и балансирует между уклоном в наблюдение или агрессивное деструктивное лечение. По поводу типичных экзофитных кондилом мнение большинства исследователей однозначно складывается в пользу терапии [5]. Наиболее перспективным считается комплексный комбинированный метод терапии, когда локальное удаление кондилом проводится на фоне системного противовирусного лечения.
Определенный интерес в связи с этим представляет аллокин-альфа – противовирусное иммуномодулирующее средство природного происхождения, действующим веществом которого является цитокиноподобный пептид аллоферон-1 [6]. При подкожном введении препарат индуцирует синтез эндогенных интерферонов и активирует системы естественных клеток-киллеров. Эффективен относительно инфекций, вызванных вирусами гриппа А и В, гепатита В, герпеса, папилломы человека [7].
На основе аллоферона была разработана инъекционная лекарственная форма, которая выпускается под названием аллокин-альфа [8]. Аллокин-альфа – это противовирусное средство – олигопептид, по фармакологическому действию близкий к интерферону-альфа, но обладающий отличным от него механизмом действия, а именно являющийся как индуктором синтеза эндогенных интерферонов, так и активатором системы естественных клеток-киллеров [9].
Повышение концентрации интерферона отмечается через 2 ч после введения препарата и сохраняется на высоком уровне (в 2–2,5 раза выше обычного фонового) на протяжении 6–8 ч со снижением до исходных значений к концу суток. Повышенная функциональная активность естественных клеток-киллеров наблюдается в течение 7 дней после введения препарата. Аллокин-альфа является селективным специфическим стимулятором функциональной активности естественных киллеров, что связано с непосредственным усилением цитотоксической активности этих клеток, а не с увеличением их количества.
Терапевтическое действие аллоферона направлено на усиление распознавания вирусных антигенов иммунокомпетентными клетками и уничтожение очагов вирусной инфекции. Аллоферон, наряду с антивирусной активностью, обладает противоопухолевым действием, что было впервые обнаружено в опытах на животных с трансплантированными опухолями [6].
Мы провели обследование 30 женщин с остроконечными кондиломами гениталий, обратившихся в научно-поликлиническое отделение Центра, с последующим их лечением. Возраст женщин варьировал от 18 до 40 лет (средний возраст 26,2±1,3 года), давность заболевания составила от 1 до 12 месяцев (в среднем 28,3±4,5 дня от начала возникновения местных проявлений).
Пациенткам проводилось комплексное обследование, которое включало клинико-визуальное обследование, расширенную вульвовагино- и кольпоскопию. Как дополнительный метод диагностики был использован метод ПЦР с определением ВПЧ 21-го типа в режиме реального времени.
Основные жалобы характеризовались наличием высыпаний и зудом в области наружных половых органов и влагалища. При осмотре у всех пациенток в области больших, малых половых губ, входа во влагалище и на стенках влагалища обнаруживались мягкие папилломатозные фиброэпителиальные разрастания, иногда напоминающие цветную капусту.
Всем пациентам проводился подсчет патологических элементов перед началом исследования, после 3 инъекций аллокина-альфа (через 6 дней) и после окончания лечения. До лечения было зарегистрировано от 15 до 58 элементов.
Пациенткам был назначен препарат аллокин-альфа в дозе 1,0 мг подкожно через день, всего на курс – 6 инъекций. Перед применением препарат растворяли в 1 мл физиологического раствора.
Клинико-визуальное обследование пациенток (осмотр кожи и слизистых гениталий) проводили до лечения, через 6, 12, 30, 60 и 90 дней. Определение ВПЧ методом ПЦР в режиме реального времени проводили до лечения и через 90 дней после начала терапии.
Оценку клинической эффективности терапии проводили с учетом динамики субъективных (зуд) и объективных клинических симптомов (количество кондилом, размер), увеличением длительности ремиссии.
Шкала оценки эффективности:
- 1 – отсутствие эффекта;
- 2 – слабая эффективность;
- 3 – умеренная эффективность;
- 4 – выраженная эффективность.
Критериями эффективности были: 1) отсутствие жалоб (зуд, жжение); 2) нормализация состояния кожных покровов и слизистых гениталий; 3) отрицательные ДНК-тесты на ВПЧ; 4) отсутствие рецидивов.
При исследовании соскобов из урогенитального тракта при помощи ПЦР в режиме реального времени у 26 (86,6%) пациенток был выделен ДНК ВПЧ в клинически значимом титре.
У 24 женщин были обнаружены 6-й или 11-й тип ВПЧ, причем у 18 женщин – оба вышеуказанных типа. Кроме этих типов ВПЧ были выявлены и другие – 16-й (3 женщины), 18-й (4), 56-й (6), 33-й (4), 31-й (8), 52-й тип (1). При этом у 4 женщин обнаружено 5 типов вирусов, у 6 – 4 типа, у 16 – 2 и у 8 – по 1 типу.
На фоне применения аллокина-альфа отметили уменьшение зуда в области высыпаний все больные: после первой инъекции 12 человек, после 2-й – 9, после 3-й – 5 пациентов.
На 5–6-й день отмечалось снижение количества кондилом у 19 больных: мелкие формы регрессировали, часть крупных уменьшались в размерах.
Через месяц после начала лечения отмечался регресс ОК: полное исчезновение у 19 пациенток, у 10 пациенток количество элементов ОК значимо уменьшилось. У одной пациентки наблюдался полный регресс ОК в первичной области поражения, но были обнаружены новые ОК в перианальной области.
Таким образом, применение аллокина-альфа мы оценили как полностью эффективное за счет регресса субъективных ощущений патологического процесса, и частично эффективное – при регрессе большей части высыпных элементов. Отсутствие положительной динамики в течение процесса на протяжении всего лечения не было ни у одной пациентки.
Все пациентки отмечали положительный результат от проводимой терапии. Необходимо отметить, что ни в одном случае побочных явлений и аллергических реакций в процессе лечения не наблюдалось.
Через 90 дней после проведенного лечения у 1 пациентки был диагностирован рецидив заболевания.
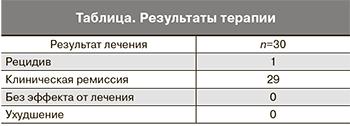 Данные о результатах терапии представлены в таблице.
Данные о результатах терапии представлены в таблице.
Проведенное наблюдение показало высокую эффективность препарата аллокин-альфа в лечении пациенток с остроконечными кондиломами гениталий. Клиническая ремиссия отмечалась у женщин в 96,6% случаев при отсутствии осложнений и побочных реакций.
Частые рецидивы и реинфекция являются особенностью заболеваний, ассоциированных с ПВИ. Именно состояние иммунной защиты организма влияет на вероятность персистенции вируса папилломы человека и препятствует возникновению рецидивов заболевания.
Применение современных препаратов, обладающих выраженным иммуномодулирующим и противовирусным действием, позволяет повысить эффективность лечения заболеваний, ассоциированных с папилломавирусной инфекцией, усиливая защитные механизмы иммунной системы и подавляя репликацию вируса, способствует более полной элиминации возбудителя, результатом чего является снижение количества рецидивов клинических проявлений ПВИ, уменьшение возможности реинфекции и длительной персистенции ВПЧ.



