Акушерские кровотечения прочно входят в четверку основных причин материнской смертности не только в России, но и во многих развитых странах. Так, в Великобритании показатель массивных акушерских кровотечений в 2011 году составил 3,7 на 1000 родов [1], а материнская смертность по этой причине была 0,39 на 100 000 (2006–2008 гг.); в России в 2011 году частота массивных кровотечений – 23,07 на 1000 родов, показатель материнской смертности от кровотечений – 2,61 на 100 000.
В протокол терапии массивных акушерских кровотечений, помимо методов остановки, входит восполнение кровопотери препаратами крови. По данным S. Catling (2007), 3–4% всех гемотрансфузий в Великобритании проводится для лечения акушерских кровотечений [1]. Известно, что переливание компонентов донорской крови сопряжено с целым рядом неблагоприятных эффектов: температурные, анафилактические и гемолитические трансфузионные реакции, ассоциированное с трансфузией острое повреждение легких и объемные перегрузки. Хотя и редко, однако существует риск вирусного, бактериального, паразитарного инфицирования. Лабораторно доказанным является факт угнетения функции иммунной системы после гемотрансфузии. У больных в критическом состоянии переливание крови связано с повышенным риском сепсиса, продленной искусственной вентиляции легких (ИВЛ) и полиорганной недостаточности [3, 4].
Рост количества родоразрешений путем кесарева сечения во всем мире приводит к высокой вероятности гемотрансфузии, достигающей 25,1% [5].
В последние 5 лет в британской медицинской литературе широко обсуждается вопрос об осуществлении интраоперационной реинфузии крови (ИРК) при кровотечениях во время акушерских операций. Основной целью внедрения ИРК является стремление уменьшить использование донорской крови. Несмотря на дороговизну приборов для ИРК и расходных материалов к ним, затраты на заготовку и хранение 1 дозы донорской крови превышают стоимость 1 процедуры аппаратной аутогемотрансфузии. Применение ИРК также сокращает длительность стационарного лечения пациенток [6].
Эксперименты по сбору крови, теряемой при операциях, и возврата ее пациенту начались почти 200 лет назад [7]. В 1825 году James Blundell применил «реинфузию» крови для лечения послеродовых кровотечений [8].
Конец XIX – начало XX века отмечен попытками ученых всего мира использовать кровь, излившуюся в ту или иную полость, для ее возвращения пациенту. Первым промышленно выпущенным в 1971 году аппаратом для интраоперационной реинфузии стал ATS100 фирмы Bentley. Однако он не решал проблемы сохранения целости эритроцитов. Требовалась разработка специальных фильтров, так как попадание разрушенных эритроцитов приводило к повышению уровня свободного гемоглобина, активации свертывания и, как следствие, расстройству гемокоагуляции.
В 1968 году урологи из клиники Mayo в Нью-Йорке J.D. Wilson и H.F. Taswell применили аппарат, ставший прототипом современного. Суть его работы заключалась в отделении эритроцитов от плазмы и других форменных элементов крови. Суспензия отмытых эритроцитов в физиологическом растворе затем переливалась пациенту [9].
Промышленное производство основанных на этом принципе устройств началось в США в 1976 году. Термин «cell saver» произошел от наименования первого аппарата для интраоперационной реинфузии Cell Saver (Haemonetics, США). Аппараты фирмы Haemonetics отличались большей безопасностью и эффективностью, позволявшей собирать, стабилизировать, фильтровать, отмывать и реинфузировать эритромассу. Подобные образцы стали выпускать и другие фирмы, название же Cell Saver («спасатель клеток») стало общепринятым по отношению ко всем аппаратам, применяемым для ИРК. Таким образом, начался новый виток развития реинфузии – интраоперационная аппаратная реинфузия аутоэритроцитов (ИРА) с помощью Cell Saver.
Несмотря на факт широкого внедрения ИРА в сосудистую, кардиохирургию, травматологию и ортопедию, в акушерской практике метод стал применяться позже [10]. В 2005 году National Institute for Clinical Excellence Великобритании опубликовал рекомендательный документ об интраоперационной аппаратной реинфузии аутоэритровзвеси в акушерстве в Англии, Уэльсе и Шотландии. В 2007 году в руководстве Royal College of Obstetricians and Gynaecologists считалось необходимым интраоперационное применение Cell Saver при ожидаемой кровопотере более 1500 мл [11–13].
Применение ИРА в акушерстве одобрено такими организациями, как Obstetric Anaesthetists Association (Великобритания), National Institute for Clinical Excellence (Великобритания), Association of Anaesthetists of Great Britain and Ireland, American College of Obstetricians and Gynecologists [14, 15].
Однако в акушерских протоколах «Management of Obstetric Hemorrhage» Американского Конгресса акушеров и гинекологов (ACOG, 2011) аутокровь не включена в перечень необходимых препаратов для возмещения кровопотери. Лишь в разделе, посвященном placenta accreta, есть указания на необходимость интраоперационного сбора крови [16]. При этом основным аргументом, ограничивающим использование ИРА, является страх переливания крови, возможно, содержащей околоплодные воды. Согласно многочисленным исследованиям, аутоэритроциты благодаря отмыванию и фильтрации очищаются от тканевого фактора, сквамозных клеток, ламеллярных телец, избытка калия [17, 18]. Предотвратить изоиммунизацию рекомендуется введением адекватной дозы anti-D Ig [19, 20], так как переливаемая кровь может содержать эритроциты плода.
В России интраоперационная реинфузия аутоэритроцитов во время кесарева сечения впервые осуществлена в Научном центре акушерства, гинекологии и перинатологии РАМН в 1993 г. [21].
После этого появились работы, указывающие на безопасность и эффективность данной методики [21–23]. При изучении ультраструктуры, ультрацитохимии и морфофункционального состояния эритроцитов при ИРА были подтверждены характеристики, типичные для нормальных красных кровяных клеток [23, 24].
Современные данные литературы сфокусированы главным образом на безопасности применения данной методики при акушерских кровотечениях. В отечественных литературных источниках имеется крайне скудная информация о возможностях и преимуществах ИРА, недостаточно подробно изложен опыт использования аппаратов Cell Saver при массивных кровопотерях.
В Центре планирования семьи и репродукции г. Москвы ИРА осуществляется с 2006 года, когда впервые во время кесарева сечения был использован аппарат Haemonetics Cell Saver 5+, который представляет собой пятое поколение систем для получения и переливания аутологичных эритроцитов. В данной работе представлен наш опыт работы с аппаратом Cell Saver.
Материал и методы исследования
С целью выявления преимуществ переливания аутоэритроцитов при использовании Cell Saver перед трансфузией донорских эритроцитов мы провели ретроспективный анализ 149 историй родов, сопровождавшихся кровотечением. Роды происходили с 1997 по 2013 гг. в Перинатальном медицинском центре и Центре планирования семьи и репродукции г. Москвы. В исследование были включены родоразрешенные путем кесарева сечения пациентки, кровопотеря в родах у которых составила 2000 мл и более (≥30% объема циркулирующей крови (ОЦК)). Критериями исключения были самопроизвольные роды, врожденная патология свертывающей системы крови. I группу составили 44 пациентки, которым проводилось переливание донорских эритроцитов с целью восстановления кислородно-транспортной функции крови, коррекции постгеморрагической анемии. У остальных 105 родильниц проведена ИРА аппаратом Haemonetics Cell Saver 5+. Из них 49 женщинам дополнительно потребовалось переливание донорских эритроцитов. Эти пациентки составили II группу. У 56 пациенток, объединенных в III группу, восполнение кровопотери проводилось только аутоэритроцитами. Все пациентки предварительно информировались о преимуществах и рисках ИРА. Было получено письменное согласие перед реинфузией аутоэритроцитов.
Теряемая во время кесарева сечения кровь, смешиваясь с антикоагулянтом, собиралась двухканальным шлангом в резервуар Haemonetics Cell Saver 5+ (Haemonetics Corp., Braintree, MA, USA), где отфильтровывались мелкие кусочки тканей, сгустки крови и другие макроструктуры. В качестве антикоагулянта использовался цитрат декстрозы. Степень разрежения вакуум-аспиратора поддерживалась на уровне 100 мм рт. ст. и могла достигать 200 мм рт. ст. в ситуациях массивного кровотечения. Высокое разрежение, увеличивая скорость всасывания крови, травмирует эритроциты. Поэтому мы избегали чрезмерной скорости сбора крови. Из резервуара кровь попадала во вращающийся колокол. В результате центрифугирования эритроциты отделялись, а плазма вместе со свободным гемоглобином, антикоагулянтом, активированным фактором свертывания, тромбоцитами выносилась из колокола. Затем эритроциты промывались физиологическим раствором. В дальнейшем суспензия эритроцитов в физиологическом растворе поступала в мешок для реинфузии. Реинфузия с использованием лейкоцитарного фильтра Purecell RC начиналась во время операции кесарева сечения, завершаясь интраоперационно или в течение 1–2 ч после окончания сбора крови.
Всем резус-негативным пациенткам после окончания операции профилактически вводился анти-резус иммуноглобулин (300 мкг).
Анализ полученных данных проведен с использованием статистических непараметрических критериев, не зависящих от характера распределения – критерия Манна–Уитни и χ2, а также традиционно используемого в биомедицинских исследованиях t-критерия Стьюдента для нормально распределенных переменных. При проведении попарного сравнения заданных групп пациентов определялась достоверность различия между всеми признаками, при этом использовались следующие уровни значимости различий: р<0,05; р<0,01; р<0,001.
Результаты исследования
Обследованные группы пациенток не отличались по возрасту, особенностям менструальной функции и гинекологических заболеваний, паритету, частоте абортов в анамнезе. Факт применения вспомогательных репродуктивных технологий и количество многоплодных беременностей были одинаковыми в обеих группах.
Во II и III группах пациенток врастание плаценты в рубец на матке после кесарева сечения встречалось в 5 раз чаще по сравнению с I группой. Общее число пациенток с предлежанием плаценты в группах было одинаковым.
Обследуемые группы не отличались по времени возникновения массивного кровотечения. Интраоперационно оно развилось у 34 (77,3%) пациенток I группы, у 41 (83,7%) пациенток II группы и 48 (85,7%) женщин III группы. У остальных родильниц диагностировано кровотечение в раннем и позднем послеродовом периоде.
У 34 (77,3%) пациенток I группы, 43 (87,8%) пациенток II группы и 49 (87,5%) пациенток III группы кесарево сечение было начато на фоне регионарного обезболивания. При возникновении кровотечения переход на общую анестезию с интубацией трахеи чаще требовался у пациенток I группы. Операция была продолжена на фоне регионарной анестезии у 5 (11,4%) пациенток I группы, 35 (71,4%) пациенток II и 41 (73,2%) пациенток III группы.
 I и III группы были сходными по объему общей кровопотери в родах. В I группе кровопотеря составила 2500 (2250; 3000) мл или 38 (35; 46)% ОЦК, в III группе 2450 (2000; 2850) мл или 37 (30; 44)% ОЦК. Пациентки II группы теряли в родах в среднем 3500 (2800; 4200) мл крови или 54 (43; 65)% ОЦК, что превосходит аналогичный показатель в I и III группах (р<0,0001).
I и III группы были сходными по объему общей кровопотери в родах. В I группе кровопотеря составила 2500 (2250; 3000) мл или 38 (35; 46)% ОЦК, в III группе 2450 (2000; 2850) мл или 37 (30; 44)% ОЦК. Пациентки II группы теряли в родах в среднем 3500 (2800; 4200) мл крови или 54 (43; 65)% ОЦК, что превосходит аналогичный показатель в I и III группах (р<0,0001).
Исходный уровень гемоглобина не отличался у обследованных пациенток, составляя в I группе 110±15 г/л, во II группе – 114±13 г/л, в III группе – 114 ±12 г/л (р=0,29).
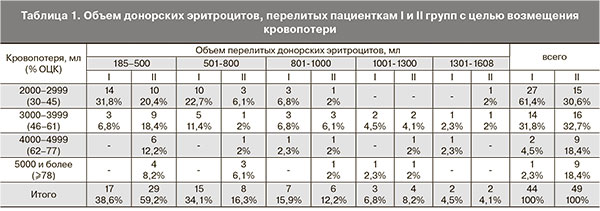
В I группе пациенток объем перелитых донорских эритроцитов варьировал от 185 до 1470 мл, составляя в среднем 678,2±308,8 мл. Во II группе гемотрансфузия проводилась в объеме 203–1608 мл, в среднем – 580,5±352,4 мл. Пациенткам II группы требовалось меньшее количество донорских эритроцитов (р<0,00001) (табл. 1).
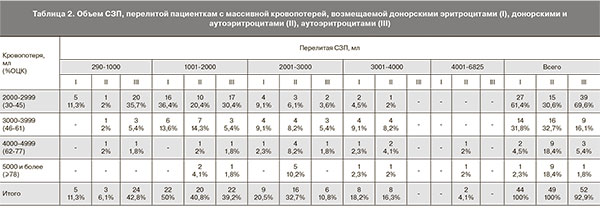
Как видно из табл. 1, у большинства пациенток II группы (59,2%) объем перелитых донорских эритроцитов не превышал 500 мл (р=0,05). Несмотря на то что кровопотеря во II группе была выше, количество перелитых донорских эритроцитов осталось одинаковым в I и II группах Всем пациенткам I и II групп проводилось переливание свежезамороженной плазмы (СЗП). В III группе СЗП применялась у 52 (92,9%) пациенток, у 4 родильниц этой группы при кровопотере до 3000 мл (<67% ОЦК) в состав инфузионной терапии СЗП не включалась. В I группе объем требуемой СЗП варьировал от 600 до 3870 мл, в среднем 1953±867 мл. Во II группе объем СЗП составил в среднем 2260±1090 мл (от 290 до 6825 мл), в III – 1248±549 мл (от 500 до 2645 мл). Пациенткам III группы требовалось меньшее количество СЗП для восполнения кровопотери, тогда как в I и II группах различия были незначимыми (р<0,0001) (табл. 2).
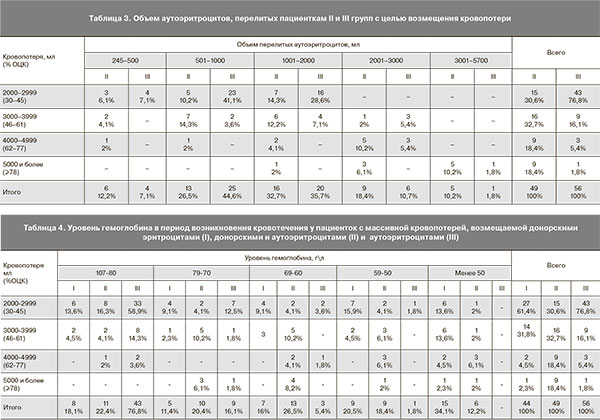
II и III группы не отличались по объему реинфузии: 1648 (760; 2140) мл, минимально 245 мл, максимально 5700 мл – у пациенток II группы, 1000 (780; 1475) мл, минимально 453 мл, максимально 4100 мл – у пациенток III группы (р=0,29) (табл. 3).
Согласно данным табл. 3, у 30 (61,2%) пациенток II группы и 27 (48,2%) пациенток III группы объем реинфузии превысил 1000 мл аутоэритроцитов. Статистически значимых отличий не выявлено (р=0,19).
Был проанализирован уровень гемоглобина у пациенток I, II и III групп интраоперационно (на пике кровопотери), через 6 часов после родоразрешения и остановки кровотечения, а также на 2-е и 7-е сутки послеродового периода (табл. 4).
Интраоперационно максимальное снижение уровня гемоглобина произошло в I группе – до 59±20 г/л, во II группе до 70±20 г/л, в III группе до 91±16 г/л (р<0,00001). Во время операции кесарева сечения у 31 (70,5%) пациентки I группы уровень гемоглобина был менее 70 г/л. Во II группе аналогичные показатели определялись у 28(57,1%) пациенток, в III – у 4 (7,1%). Это объясняется отсроченным началом трансфузии донорских эритроцитов, требующим проведения проб на совместимость, тогда как аутотрансфузия начинается через 10 минут от момента возникновения кровотечения. Однако отличия между I и II группами являются статистически незначимыми (р=0,6).
Через 6 часов после завершения операции и остановки кровотечения наибольшее снижение уровня гемоглобина отмечено у пациенток I группы – 75±12 г/л. У пациенток II группы показатель был 82±15 г/л, III группы – 92±14 г/л, (р<0,05). Через 6 часов после родоразрешения снижение уровня гемоглобина менее 70 г/л было зафиксировано у 10 (22,7%) пациенток I группы, 11 (22,4%) пациенток II группы и 4 (7,1%) пациенток III группы. Отличия между группами статистически незначимы (р=0,05).
На 2-е сутки послеродового периода минимальные значения уровня гемоглобина были у пациенток I группы, составляя 73±15 г/л, у пациенток II группы 80±13 г/л и 93±16 г/л у пациенток III группы (р<0,05). На 2-е сутки уровень гемоглобина менее 70 г/л определялся у 22 (50%) родильниц I группы, 10 (20,4%) родильниц II группы и 5 (8,9%) родильниц III группы. Имеет место статистически значимое отличие между пациентками I и II, I и III групп (р<0,0001).
На 7-е сутки после родоразрешения среднее значение гемоглобина у пациенток I группы было 81±10 г/л, у пациенток II группы 83±12, г/л и у пациенток III группы 92±14 г/л. Наиболее высокий уровень гемоглобина отмечен у пациенток III группы (р<0,0001). На 7-е сутки после родов количество пациенток с уровнем гемоглобина менее 70 г/л было одинаковым во всех группах: у 7 (9,1%) пациенток I группы, 5 (10,2%) пациенток II группы и 3 (5,4%) пациенток III группы (р=0,2).
Продленная искусственная вентиляция легких проводилась 30 (68,2%) пациенткам I группы и 19 (18,1%) пациенткам II (17 пациенток) и III (2 пациентки) групп (р<0,0001). Длительность ее не отличалась у родильниц I и объединенной II и III групп, составляя 3 ч (1 ч30 мин; 6 ч 15 мин) и 3 ч (2 ч 15 мин; 4 ч) соответственно (р=0,88).
Длительность пребывания пациенток I группы пациенток в отделении интенсивной терапии составила 40,5 (30; 49,5) ч, II группы – 32 (23; 46) ч.
Родильницы III группы находились в отделении интенсивной терапии менее длительно – 21 (19; 23) ч (р<0,0001). Более суток интенсивная терапия требовалась 35 (79,5%) пациенткам I группы, 34 (69,4%) пациенткам II группы и 12 (21,4%) пациенткам III группы. Таким образом, пациентки III группы реже находились в палате интенсивной терапии более 24 ч.
Выписка пациенток I группы производилась на 11-е (9; 15) сутки послеродового периода, пациенток II группы – на 9-е (8; 12) сутки, III группы – на 8-е (8; 10) сутки. Пациентки III группы выписывались домой раньше пациенток I и II групп (р<0,0001).
Обсуждение
Несмотря на первоначальные опасения относительно безопасности, ИРА успешно использована в сотнях наблюдений по всему миру. Мы, как и другие авторы, не столкнулись с такими осложнениями процедуры, как эмболия околоплодными водами, инфекционные поражения и коагулопатия [19, 25]. Использование Cell Saver (Haemonetics Cell Saver 5+) в комбинации с лейкоцитарным фильтром удаляет из аспирированной крови клетки трофобласта, чешуйки плода и лейкоциты [18].
National Institute for Clinical Excellence в своем руководстве (2005) в качестве показаний к применению ИРА определяет кесарево сечение у пациенток с предлежанием или врастанием плаценты [12]. В рекомендациях RCOG (2011) применение ИРА обосновано у пациенток с высоким риском массивного кровотечения (более 1500 мл) и при отказе женщин от переливания донорской крови [14].
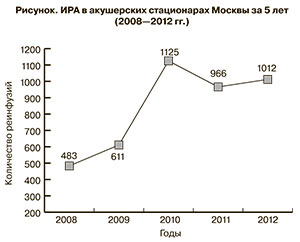
За последние 5 лет (2008–2012 гг.) в Центре планирования семьи трансфузия аутологичных эритроцитов произведена 828 пациенткам. Это привело к снижению использования донорских эритроцитов, что важно как для здоровья пациенток, так и в экономическом аспекте.
В настоящее время 29 из 32 родовспомогательных учреждений г. Москвы оснащены Cell Saver. За аналогичный период времени в Москве аппаратная реинфузия эритроцитов применена у 4197 пациенток. За последние годы отмечено двукратное увеличение частоты использования аппарата Cell Saver 5+ в акушерских стационарах Москвы (см. рисунок).
Согласно проведенным нами исследованиям, у пациенток III группы (восполнение кровопотери исключительно аутоэритроцитами) в состав инфузионной терапии входил меньший объем СЗП, длительность лечения в палате интенсивной терапии была наименьшей и редко превышала 24 ч, пациентки выписывались из стационара, как правило, на 8-е сутки послеродового периода. Во всех исследованных временных интервалах (интраоперационно – в момент кровотечения, через 6 ч, на 2-е и 7-е сутки после перенесенной кровопотери) эти родильницы демонстрировали наиболее высокие показатели уровня гемоглобина.
Хотя объем кровопотери во II группе (возмещение ауто- и донорскими эритроцитами) превышал таковой в I группе (донорские эритроциты), уровень гемоглобина у родильниц II группы интраоперационно, через 6 ч, на 2-е и 7-е сутки после родов был выше по сравнению с аналогичными показателями в I группе.
На основании вышеприведенных собственных данных следует подчеркнуть значимость использования реинфузии аутоэритроцитов и рекомендовать широкое внедрение в акушерскую практику аппарата Cell Saver.