В Российской Федерации бесплодны 17% всех супружеских пар, то есть около 6 млн; из них 3 млн нуждаются в проведении вспомогательных репродуктивных технологий (ВРТ) [1, 2]. Эффективность экстракорпорального оплодотворения (ЭКО) варьирует от 30 до 45%. Среди ВИЧ-инфицированных пар 60% не могут забеременеть самостоятельно, а эффективность программ ВРТ у данной категории пациентов не превышает 25% [3, 4]. У пациентов с ВИЧ лидирующим является трубно-перитонеальный фактор бесплодия, который имеет место в 27–56% случаев. Причиной нарушения проходимости маточных труб может являться сам вирус, который, по мнению некоторых авторов, способствует развитию воспалительных заболеваний органов малого таза [5].
Не исключено, что возникновению воспаления способствуют передаваемые половым путем инфекции, выявляющиеся у данной категории женщин чаще, чем в популяции неинфицированных ВИЧ пациенток [6, 7]. Частота эндокринного бесплодия среди ВИЧ-инфицированных пациенток, по разным данным, составляет от 15 до 31% [8, 9].
Некоторые авторы объясняют снижение фертильности у ВИЧ-инфицированных женщин преждевременным снижением или истощением овариального резерва, особенно среди женщин с низким уровнем CD4 лимфоцитов, сопутствующими вирусными гепатитами [10]. Выявлено, что молодые ВИЧ-инфицированные пациентки имеют склонность к образованию персистирующих функциональных кист яичников, что свидетельствует о нарушении процесса овуляции [11, 12].
Выявлено отсутствие достоверных различий в количестве и качестве получаемых эмбрионов у серопозитивных к ВИЧ и серонегативных пар. Однако процент клинических беременностей, по данным исследований, достоверно ниже у серопозитивных женщин [13, 14]. В проведенном N.R. Mugo и соавт. исследовании у 49% исследуемых женщин с ВИЧ-инфекцией по результату гистологического исследования был выявлен хронический эндометрит при отсутствии яркой клинической картины заболевания [15].
Низкая эффективность программ ЭКО у ВИЧ-позитивных пациентов, при отсутствии достоверных различий между качеством ооцитов и эмбрионов у ВИЧ-позитивных и ВИЧ-негативных лиц, может свидетельствовать о нарушении имплантации эмбрионов на фоне структурных изменений эндометрия при стертой клинической картине.
До настоящего времени обнаружение ВИЧ в клетках репродуктивных органов женщины (ооцитах, фолликулярной жидкости, эндометрии) связывали с контаминацией менструальной кровью. Однако заслуживают внимание результаты исследований, свидетельствующие о наличии детектируемой вирусной нагрузки в эндометрии при отсутствии РНК ВИЧ в крови. Это подтверждает прямое токсическое воздействие ВИЧ на ткань эндометрия с последующим развитием структурных изменений в нем [16].
Учитывая высокий процент воспалительных и структурных изменений в эндометрии, особую значимость в повышении эффективности программ ЭКО приобретает прегравидарная подготовка у данной категории пациенток. Высокая частота хронического эндометрита у ВИЧ-позитивных пациенток обусловливает необходимость расширения показаний к лечебно-диагностической гистероскопии перед процедурой ЭКО.
Цель исследования: оценка возможности повышения эффективности ВРТ у ВИЧ-инфицированных пациенток с бесплодием после лечебно-диагностической гистероскопии.
Материал и методы исследования
В период 2015–2016 гг. 121 ВИЧ-инфицированной пациентке была проведена программа ЭКО. Из них 63 пациенткам предварительно (за 2–3 цикла до программы ЭКО) проведена лечебно-диагностическая гистероскопия с мануальной вауумной аспирацией эндометрия – основная группа, 58 пациенткам гистероскопия не проводилась (контрольная группа). Рандомизация методом конвертов.
Критерии включения в основную группу: репродуктивный возраст (19–35 лет); трубно-перитонеальный фактор бесплодия; ВИЧ-инфекция 3, 4А,Б стадии; отсутствие противопоказаний к ЭКО; отсутствие противопоказаний к гистероскопии; проведенная за 2–3 цикла до ЭКО гистероскопия с мануальной вакуумной аспирацией эндометрия.
Критерии исключения из основной группы: поздний репродуктивный возраст; стадии ВИЧ инфекции 1,2,4В,5; другие факторы бесплодия; наличие противопоказаний к ЭКО, гистероскопии.
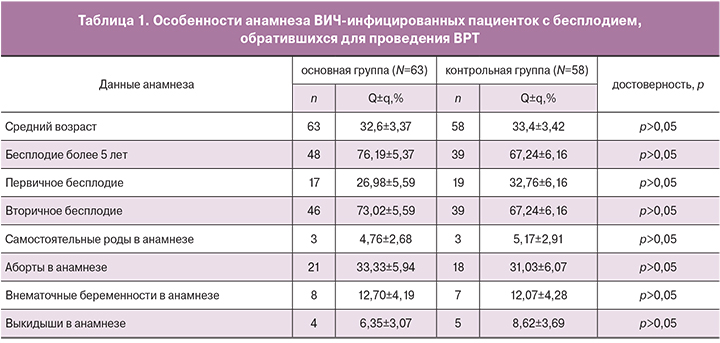
 Средний возраст пациенток основной группы составил 32,6±3,37 года.
Средний возраст пациенток основной группы составил 32,6±3,37 года.
Критерии включения в контрольную группу: репродуктивный возраст (19–35 лет); трубно-перитонеальный фактор бесплодия; ВИЧ-инфекция 3, 4А,Б стадии; отсутствие противопоказаний к ЭКО; отсутствие гистероскопии в анамнезе.
Критерии исключения из контрольной группы: поздний репродуктивный возраст; стадии ВИЧ инфекции 1,2, 4В, 5; другие факторы бесплодия; наличие противопоказаний к ЭКО.
Средний возраст пациенток контрольной группы составил 33,4±3,42 года.
При клиническом обследовании женщин всех групп использовались общепринятые методы: сбор анамнеза, общий осмотр. Гинекологический анамнез включал оценку менструальной функции, количество и исходы беременностей, гинекологические заболевания. Наряду с клиническим осмотром всем пациенткам проводились гинекологический бимануальный осмотр, исследование в зеркалах
Обследование согласно приказу МЗ РФ № 107н от 30.08.12 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Ультразвуковое исследование было проведено на аппарате Mindray DP-50 (Китай) конвексными датчиками частотой 2,0–5,0 МГц трансвагинальным доступом в гинекологической программе. Всем пациенткам на этапе подготовки к программе ЭКО проводилось трансвагинальное сканирование на 5–7-й день менструального цикла.
Гистероскопия проведена всем пациенткам основной группы в первую фазу менструального цикла. Процедура проведена по стандартному протоколу жидкостной гистероскопии (в качестве расширяющей среды использован 0,9% раствор натрия хлорида). Гистероскопию проводили с помощью аппарата «Карл Шторц».
Морфологический раздел исследования включал гистологическое исследование биопсированного материала эндометрия. Материал биоптатов и аспирата фиксировали в 10% нейтральном формалине, заключали в парафин, делали срезы толщиной 5 мкм и окрашивали гематоксилином и эозином. Гистологические заключения формулировали в соответствии с современными стандартами и с учетом требований Международной классификации болезней 10-го пересмотра (МКБ 10).
Всем пациенткам проспективной и контрольной группы на этапе обследования перед программой ВРТ проведена количественная оценка урогенитального микробиоценоза методом «Фемофлор». Результаты исследования выражались как в абсолютных (геном-эквивалентах – ГЭ/образец), так и в относительных показателях (%), которые рассчитывались программным обеспечением прибора IQ5 Multicolor Real-Time PCR Detection System фирмы BIO-RAD (США).
Статистическая обработка данных c применением прикладных программ для IBM SPSS Statistics 22. Использованы методы оценки средних значений и стандартных ошибок, t-критерий Стъюдента.

Результаты исследования и их обсуждение
При сравнении данных анамнеза основной и контрольной групп достоверных различий получено не было (табл. 1). Средний возраст пациенток обеих групп не превышал 34 лет (32,6 в основной группе и 33,4 в контрольной группе). У большей части пациенток как основной группы, так и группы контроля ранее были беременности, но большая их часть закончилась прерыванием (33,3% в основной группе и 31% в группе контроля). У 12% женщин как основной, так и контрольной группы имела место эктопическая беременность, потери беременности в сроках выкидыша произошли у 6,4% пациенток основной группы и 8,6% пациенток контрольной группы. Только 5% исследуемых женщин родили детей, этот показатель не имел достоверных различий в обеих группах.
По результатам ультразвукового исследования (УЗИ) эндометрия основной и контрольной групп достоверных различий получено не было (табл. 2). Патология отсутствовала в 54% случаев в основной группе и в 57% случаев в группе контроля. В структуре патологии эндометрия чаще всего выявлялись полипы – в 24% случаев у пациенток основной группы и в 22% случаев у женщин контрольной группы. Признаки эндометрита (неоднородная структура и асимметрия толщины стенок эндометрия; неоднородная структура субэндометриального слоя; гиперэхогенные включения с акустическим феноменом, характерным для пузырьков газа; расширение полости матки за счет жидкостного содержимого) были выявлены при УЗИ у 12% пациенток обеих групп. В 3% случаев выявлено нарушение отторжения эндометрия с менструацией, признаки гиперплазии эндометрия обнаружены у 6% пациенток основной группы и у 5% пациенток контрольной группы.
Всем пациенткам основной группы на этапе прегравидарной подготовки проводилась лечебно-диагностическая гистероскопия, что позволило уточнить характер патологии, дополнительно обнаружить недиагностированную при УЗИ патологию эндометрия, провести гистологическое исследование и лечение. В результате проведенного гистологического исследования эндометрия пациенток основной группы патология была выявлена у 79,4% пациенток, что в 1,7 раза чаще, чем по данным УЗИ, согласно результатам которого патология эндометрия выявлялась в 46% случаев. Спектр подтвержденной гистологически патологии эндометрия отражен на рис. 1.
По структуре патологии эндометрия у женщин основной группы в 27% выявлены признаки хронического воспаления эндометрия – из них в 87% случаев имелись все гистологические критерии эндометрита (обнаружены инфильтраты лимфоидных клеток, скопления плазматических клеток, склеротические изменения стенок спиральных артерий), в 13% случаев картина была «неполной» – признаки эндометрита выявлены не в полном объеме. В 33,3% случаев выявлены гиперпластические процессы эндометрия, а в 19,1% случаев – сочетание обоих патологических процессов. Только 20,6% пациенток не имели патологии эндометрия по данным гистологических заключений.
 Всем пациенткам после проведенной гистероскопии (до результата гистологии) назначался дидрогестерон по 10 мг 2 раза в день с 16-го по 25-й день цикла; далее при получении заключения о наличии признаков воспаления в ткани эндометрия добавлялась противовоспалительная терапия, в случае выделения патогенной и условно-патогенной микрофлоры из отделяемого цервикального канала – антибактериальная терапия, подобранная с учетом чувствительности выделенного микроорганизма. Наиболее часто использовалась комбинация препаратов (доксициклин с метронидазолом на 2 недели). По данным нашего исследования, выделение условно-патогенной флоры зарегистрировано в 17,5% в основной и в 17,8% в контрольной группе. Оценка биоценоза методом полимеразной цепной реакции в режиме реального времени (фемофлор-16) показала, что у 43% в основной группе и у 51% в контрольной группе выявлен абсолютный нормоценоз, в 19,6% в основной группе и в 24,4% в контрольной группе выявлен относительный нормоценоз. Антибактериальная терапия назначалась 12,7% пациенток основной и 12,1% пациенток контрольной группы. Физиотерапевтическое лечение данной группе пациенток не проводилось.
Всем пациенткам после проведенной гистероскопии (до результата гистологии) назначался дидрогестерон по 10 мг 2 раза в день с 16-го по 25-й день цикла; далее при получении заключения о наличии признаков воспаления в ткани эндометрия добавлялась противовоспалительная терапия, в случае выделения патогенной и условно-патогенной микрофлоры из отделяемого цервикального канала – антибактериальная терапия, подобранная с учетом чувствительности выделенного микроорганизма. Наиболее часто использовалась комбинация препаратов (доксициклин с метронидазолом на 2 недели). По данным нашего исследования, выделение условно-патогенной флоры зарегистрировано в 17,5% в основной и в 17,8% в контрольной группе. Оценка биоценоза методом полимеразной цепной реакции в режиме реального времени (фемофлор-16) показала, что у 43% в основной группе и у 51% в контрольной группе выявлен абсолютный нормоценоз, в 19,6% в основной группе и в 24,4% в контрольной группе выявлен относительный нормоценоз. Антибактериальная терапия назначалась 12,7% пациенток основной и 12,1% пациенток контрольной группы. Физиотерапевтическое лечение данной группе пациенток не проводилось.
Коррекция выявленных гиперпластических процессов эндометрия заключалась в назначении только дидрогестерона, поскольку само по себе проведение мануальной вакуумной аспирации эндометрия позволяет удалить патологические очаги в эндометрии.
Всем пациенткам, согласно приказу Министерства здравоохранения РФ от 30 августа 2012 г. № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» назначали антиретровирусную терапию. Одним из критериев начала программы ЭКО у ВИЧ-инфицированной женщины, согласно приказу, является неопределяемая вирусная нагрузка в крови (менее 100 копий ВИЧ в 1 мл крови) [1]. В ранее опубликованных нами работах была выявлена возможность репликации ВИЧ в слизистой оболочке матки при отсутствии вирусной нагрузки в крови [16]. По данным вирусологического исследования 29 пациенток, ВИЧ в тканях эндометрия выявлен в 76% случаев, причем у 11% женщин при неопределяемой вирусной нагрузке в крови ВИЧ был выявлен в тканях эндометрия, у 65% ВИЧ выявлен из крови и эндометрия. Только у 24% пациенток на этапе подготовки к ЭКО ВИЧ из эндометрия не был выделен. Учитывая доказанную возможность репликации ВИЧ в эндометрии с развитием признаков хронического эндометрита, проведение ВРТ рекомендовано не позднее второго цикла после лечебно-диагностической гистероскопии и последующего лечения. Это обусловлено необходимостью снижения вероятности повторного «обсеменения» эндометрия вирусом, поскольку жизненный цикл продуктивно инфицированной клетки составляет 22 дня [17].
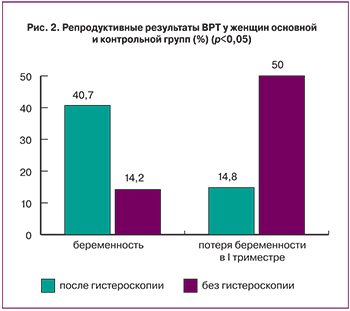
После проведенной гистероскопии и лечения пациентки включались в программу ЭКО. У 88% пациенток основной группы и 82% контрольной группы проведен протокол с антагонистами, остальным пациенткам проведен длинный протокол с агонистами (12% пациенток основной и 18% пациенток контрольной групп). В результате программы ЭКО у пациенток основной группы беременность наступила в 40,7% случаев, тогда как в контрольной группе этот показатель не превысил 14,2% (p<0,05). Достоверно отличается процент потери беременности в первом триместре – он оказался значительно ниже у женщин, которым была проведена гистероскопия – 14,% (против 50% в контрольной группе) (p<0,05). Возможно, улучшение репродуктивных исходов в циклах после предварительного проведения лечебно-диагностической гистеросокпии, связано не только с индукцией децидуализации эндометрия, увеличением секреции цитокинов, интерлейкинов, макрофагов, необходимых для имплантации [18], но и с удалением при мануальной вакуумной аспирации эндометрия патологического очага скопления ВИЧ.
Заключение
ВИЧ-инфицированные пациентки с трубно-перитонеальным бесплодием имеют повышенную склонность к развитию патологии эндометрия в сравнении с бесплодными пациентками без ВИЧ – в 79,4% гистологических заключений выявляется патология эндометрия. При этом УЗИ эндометрия у ВИЧ-инфицированных пациенток выявляет патологию лишь в 46% случаев. Низкая диагностическая ценность УЗИ, вероятно, связана с возможностью репликации ВИЧ в слизистой оболочке матки, который вызывает развитие недиагностируемого по УЗИ эндометрита. Проведение лечебно-диагностической гистероскопии не ранее чем за два цикла до ЭКО позволяет удалить пораженный вирусом эндометрий и провести своевременное лечение выявленной по гистологии патологии.
Поэтому для правильной оценки качества эндометрия, определения противопоказаний к ЭКО, а также лечебной тактики на этапе прегравидарной подготовки, проведение гистероскопии является целесообразным для всех серопозитивных женщин с трубно-перитонеальным генезом бесплодия, как в конкордантной, так и в дискордантной по ВИЧ паре. Это позволяет увеличить эффективность ВРТ: частота наступления беременности увеличивается в 2,7 раза, а частота невынашивания беременности в первом триместре снижается в 3,5 раза.



