Герпесвирусные инфекции, в особенности вирус простого герпеса (ВПГ), являются самыми распространенными в мире, составляя в среднем 65,2–70,3% среди пациенток репродуктивного возраста [1, 2]. По данным глобальной оценки распространенности герпесвирусных инфекций, более 0,5 млрд человек в мире инфицированы ВПГ 2 типа, с верификацией 25 млн новых случаев в год, в большей степени у женщин в сравнении с мужчинами, с рецидивированием возникших на его фоне заболеваний в 90% случаев [3, 4]. Способность ВПГ практически пожизненно персистировать в паравертебральных ганглиях нервной системы обеспечивает ему защиту от иммунной системы, а возникающая на этом фоне иммуносупрессия создает предпосылки для активации условно-патогенной вагинальной микрофлоры [5, 6]. В условиях пандемии и на постковидном пространстве обретает значение новая парадигма: возникновение интегрального эффекта различных вирусных инфекций [7, 8]. Иммунодефицит, вызываемый длительно персистирующими герпесвирусными инфекциями, возникает на фоне вырабатываемых вирусами белков, блокирующих рецепторы к иммунокомпетентным клеткам, что способствует разрушению специфического иммунного ответа [9, 10]. На этом фоне пациентки оказываются предрасположенными к реализации других вирусных инфекций [11]. Многочисленными метаанализами установлена корреляция герпетических ассоциантов вагинального микроэкологического статуса с ВПЧ-ассоциированными заболеваниями [12]. Создаваемые вирусами простого герпеса условия для активации вируса папилломы человека (ВПЧ) с возникновением опухолевых заболеваний цервикального эпителия имеют значительную эпидемиологическую и медико-социальную значимость [13]. Иммунные дисфункции, возникающие на фоне герпесвирусных инфекций, создают предпосылки для длительной персистенции условно-патогенных и патогенных бактериальных и грибковых ассоциантов с поражением вагинального и цервикального эпителия [14]. Следует учитывать и значительные изменения условий для существования и размножения вагинальной микробиоты у пациенток с персистирующими вагинальными герпесвирусными инфекциями, характеризующиеся резистентностью микроорганизмов к проводимой терапии [15]. Устойчивость возбудителей инфекций половых путей (ИПП) к антибактериальной терапии в основном связана с двумя причинами – биологической (эволюция резистентности) и социальной (злоупотребление антибиотиками и противовирусными препаратами и селекция резистентной флоры), что создает предпосылки для частого рецидивирования инфекционного процесса, до 55–63% [16, 17]. Часто рецидивирующие вульвовагиниты, возникающие на фоне герпесвирусных инфекций, являются предпосылкой для оптимизации комплексного лечения и последующей профилактики рецидивирования данных заболеваний путем оптимизации интимной гигиены. Проблема усовершенствования лечебных технологий вульвовагинитов актуализировала необходимость последующей превенции микробиоты в эпоху глобальной резистентности возбудителей к традиционной терапии и профилактики активации и длительной персистенции герпесвирусных агрессий [18, 19].
Поскольку на фоне вульвовагинитов наблюдается локальная иммуносупрессия, у латентно персистирующего ВПГ появляется реальная возможность активации, что не всегда имеет явные клинические проявления. Исходя из этого наряду с антибактериальной терапией целесообразно предусмотреть и противовирусную. В настоящем исследовании в качестве локальной противовирусной терапии был выбран препарат «Панавир» в форме суппозиториев, обладающий прямым противовирусным действием [20]. Для пролонгирования полученного эффекта и профилактики рецидивирования необходимо применение интимной гигиены с противовирусным эффектом [21, 22]. Предпочтением в назначении интимной гигиены после лечения вульвовагинитов смешанной и кандидозной этиологии при персистирующих герпесвирусных инфекциях явилось на втором этапе после стандартной антибактериальной терапии косметическое средство для интимной гигиены «Панавир Интим Нормафлор» 40 мл, в виде спрея, в состав которого входят молочная кислота, глицирризинат аммония, полисахариды побегов Solanum tuberosum («Панавир»), способствующие восстановлению естественного уровня рН, поддержанию кислотно-щелочного баланса микрофлоры, создающих неблагоприятные условия для оставшейся после антибактериальной терапии патогенной и условно-патогенной микрофлоры, профилактирующие дальнейшую персистенцию герпесвирусных и бактериальных инфекций на местном уровне [23].
Цель исследования: оптимизация лечения и интимной гигиены при смешанных и кандидозных вульвовагинитах у пациенток с персистирующей герпесвирусной инфекцией.
Материалы и методы
Были обследованы и пролечены 164 пациентки со смешанным и кандидозным вульвовагинитом, развившимся на фоне персистирующих герпесвирусных инфекций. Исследование проводилось на базах женских консультаций и медицинских центров Екатеринбурга и Свердловской области. Обследование включало в себя анамнестическое, общеклиническое исследование. Было проведено лабораторное обследование: рН-метрия влагалища, полимеразная цепная реакция (ПЦР) на ВПГ 2 типа, ПЦР на ВПЧ, тест «Фемофлор». ДНК из вагинального содержимого для проведения теста «Фемофлор» выделяли с использованием комплекта реагентов ПРОБА-ГС (ООО «НПО ДНК-Технология», Москва). Исследование осуществляли методом ПЦР с детекцией результатов в режиме реального времени (ПЦР-РВ) и использованием реагентов «Фемофлор-16» (ООО «НПО ДНК-Технология», Москва). Оценку микробиоценоза влагалища выполняли согласно инструкции теста «Фемофлор»: при выявлении доли нормофлоры в составе более 90%, количестве Ureaplasma spp., Mycoplasma spp., Candida spp. менее 104 ГЭ/мл – абсолютный нормоценоз, при содержании Ureaplasma spp., Mycoplasma spp., Candida spp. более 104 ГЭ/мл – условный нормоценоз; при выявлении доли нормофлоры от 20 до 80% – умеренный (аэробный или анаэробный) дисбиоз, а при снижении ее содержания ниже 20% – выраженный дисбиоз [24]. Пациентки были включены в исследование в соответствии с критериями включения и исключения.
В I группу вошли 83 пациентки с установленным диагнозом «смешанный вульвовагинит», которые после обследования для назначения терапии были разделены на 3 подгруппы. В 1А группе (n=31) назначался комплексный препарат тернидазол 200 мг + неомицина сульфат 100 мг + нистатин 100 тыс. МЕ + преднизолона метасульфобензоат натрия 3 мг («Тержинан») по 1 вагинальной таблетке 1 раз в день утром № 10 и «Панавир» по 1 суппозиторию 1 раз в день вечером № 10 в сочетании, на втором этапе назначалось косметическое средство для интимной гигиены «Панавир интим» в виде спрея с применением 1 раз в день № 14 с последующим применением 1 раз в 3 дня еще 2 недели. В 1B группе (n=32) назначался комплексный препарат тернидазол 200 мг + неомицина сульфат 100 мг + нистатин 100 тыс.МЕ + преднизолона метасульфобензоат натрия 3 мг («Тержинан») по 1 вагинальной таблетке 1 раз в день утром № 10 и «Панавир» по 1 суппозиторию 1 раз в день вечером № 10 в сочетании, на втором этапе было назначено косметическое средство для интимной гигиены «Панавир Интим Нормафлор» в виде спрея 1 раз в день № 14 с последующим применением 1 раз в 3 дня еще 2 недели. Группу 1С (сравнения) составили 20 пациенток, которым была назначена стандартная терапия [25]: комплексный препарат тернидазол 200 мг + неомицина сульфат 100 мг + нистатин 100 тыс.МЕ + преднизолона метасульфобензоат натрия 3 мг («Тержинан») по 1 вагинальной таблетке 1 раз в день № 10. Распределение пациенток по группам при назначении терапии проводились рандомизированно – методом случайной выборки.
Во II группу вошла 81 пациентка с установленным диагнозом «кандидозный вульвовагинит», которым был назначен антимикотик сертоконазол однократно. На втором этапе группа была разделена на 3 подгруппы. Во 2А группе (n=30) был назначен «Панавир» по 1 суппозиторию 1 раз в день № 10, затем назначалось косметическое средство для интимной гигиены «Панавир интим» в виде спрея с применением 1 раз в день № 14 с последующим применением 1 раз в 3 дня еще 2 недели; во 2B группе (n=31) был назначен «Панавир» по 1 суппозиторию 1 раз в день № 10, затем назначалось косметическое средство для интимной гигиены «Панавир Интим Нормафлор» в виде спрея 1 раз в день № 14 с последующим применением 1 раз в 3 дня еще 2 недели. Группу 2С (сравнения) составили 20 пациенток, которым была назначена стандартная терапия: сертоконазол однократно. Распределение пациенток по группам при назначении терапии проводились рандомизированно – методом случайной выборки.
Группу контроля (III) для оценки микробиологического статуса составили 20 человек (относительно здоровые пациентки без заболеваний шейки матки, вульвы и влагалища). Использовали метод параллельных групп, не отличающихся значительно по возрасту, паритету, сопутствующим заболеваниям. Длительность исследования составила 3 месяца. На протяжении всего исследования не разрешался прием других препаратов и средств для интимной гигиены.
Критерии включения в I группу: бактериологически подтвержденный диагноз «смешанный вульвовагинит»; персистирующий ВПГ 2 типа в анамнезе, положительная ПЦР на ВПГ 2 типа; длительность заболевания от 1 до 7 дней; отсутствие терапии до отбора в исследование; возраст 18–45 лет; рост, вес без ограничений; раса, национальность, профессия, регион без ограничений, информированное согласие. Критерии включения во II группу: бактериологически подтвержденный диагноз «кандидозный вульвовагинит»; персистирующий ВПГ 2 типа в анамнезе, положительный ПЦР на ВПГ 2 типа; длительность заболевания от 1 до 7 дней; отсутствие терапии до отбора в исследование; возраст 18–45 лет; рост, вес без ограничений; раса, национальность, профессия, регион без ограничений; информированное согласие. Критерии исключения: возраст женщин менее 18 и более 45 лет; беременность; лактация; наличие тяжелой экстрагенитальной и гинекологической патологии; отсутствие информированного согласия.
Наблюдение за пациентками осуществляли через 14 дней, 40 дней, 3 месяца после назначения комплексной терапии для оценки эффективности. Основные критерии эффективности: исчезновение клинической симптоматики (боль, жжение, зуд), улучшение самочувствия, комплаенс терапии, динамика структуры вагинальной микробиоты по тесту «Фемофлор». Оценка вагинального дискомфорта проводилась с использованием шкалы Вонга–Бейкера.
Статистический анализ
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics версии 23.0. Для количественных данных, имеющих нормальное распределение, применялись: n, CI, где n – число наблюдений, CI – доверительный интервал. Для количественных данных, не подчиняющихся закону нормального распределения, в качестве меры центральной тенденции выбрана медиана, в качестве интервальной оценки – 25-й и 75-й квартили. Значимость различий проверяли с помощью критерия χ2 Пирсона с поправкой Йейтса, с критическим уровнем значимости p<0,05. Для оценки взаимосвязи между показателями определялся коэффициент ранговой корреляции Спирмена (r), средней (0,7≥r≥0,5) и высокой (r≥0,7) степеней связи при уровне значимости p≤0,05–0,00.
Результаты и обсуждение
Средний возраст пациенток, включенных в исследование, составил 25±6,4 года.
Анализ жалоб пациенток основных групп продемонстрировал значительные межгрупповые различия. В частности, у пациенток I группы при сравнении с жалобами пациенток II группы значительно чаще отмечались дискомфорт во влагалище, обильные желтые выделения (61 (96,8%) и 38 (62,3%) случаев соответственно (χ²=6,54; р=0,002)). Пациентки II группы значительно более часто при сравнении с I группой жаловались на зуд, жжение – в 52 (85,3%) и 41 (65,1%) наблюдениях соответственно (χ²=5,22; р=0,003), что обусловлено доминированием грибов рода Candida. Клинические проявления у пациенток I группы характеризовались желтыми выделениями из половых путей, гиперемией вагинального эпителия, гиперемией экзоцервикса в 52 (82,5%) наблюдениях. У 32 (50,7%) пациенток I группы имелись клинические признаки активации генитальных герпесвирусных инфекций в виде специфических высыпаний. Во II группе доминировали творожистые выделения из половых путей в сочетании с гиперемией вагинального эпителия, признаками экзоцервицита в значимо меньшем количестве, чем в I группе – 33 (54,1%) случая (χ²=6,728; р=0,002), что свидетельствовало о более значительном влиянии доминирующей смешанной флоры на экзоцервикс.
При бактериоскопическом исследовании вагинального содержимого у пациенток основных группах выявлено повышенное содержание лейкоцитов с доминированием смешанной флоры, повышением индекса воспаления больше 1, значительно более часто встречающееся в I группе при сравнении со II и с группой контроля (χ²=4,362; р=0,0043 и χ²=7,693; р=0,001 соответственно).
При изучении результатов молекулярно-биологического исследования выявлено изменение структуры цервико-вагинальной микробиоты в I и II группах в сторону дисбиотических нарушений со значительными межгрупповыми различиями, обусловленными различными доминирующими возбудителями. В структуре умеренных и выраженных дисбиоценозов у пациенток I группы (n=63) выявлялся смешанный аэробно-анаэробный дисбиоз. Наибольшая величина бактериальной репликации у пациенток I группы определялась у G. vaginalis в ассоциации с Clostridium и Fusobacterium в сочетании с представителями аэробного компонента в виде кишечной группы (Enterobacteriасeae spp.), Staphylococcus spp., Streptococcus spp. – у 66,7% респонденток (95% СI: 43,7–85,5). Анализ структурных компонентов микробиоты II группы выявил доминирование в клинически значимых титрах Candida spp. в сочетании с представителями аэробно-анаэробной флоры в 90,2% (95% СI: 74,9–99,2, р=0,001) (табл. 1).
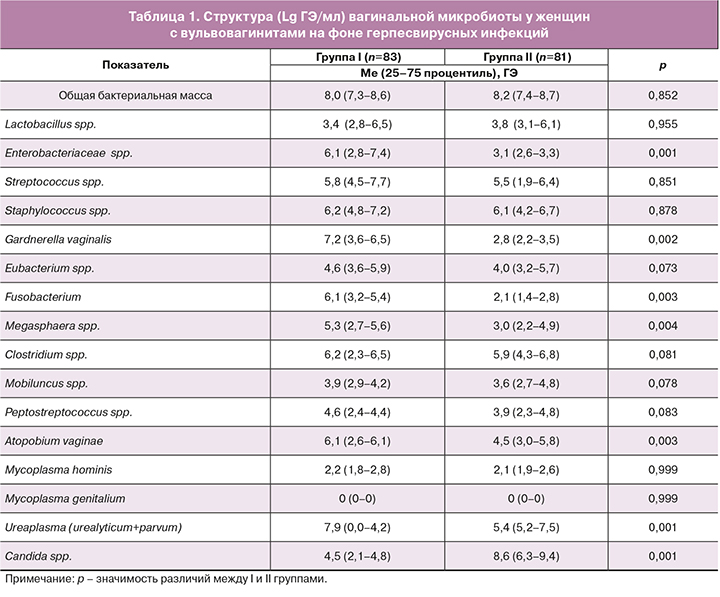
Результаты молекулярно-биологического исследования в группе контроля (III) продемонстрировали в основном состояние микробиоты в виде абсолютного нормоценоза – 65,0% случаев и условного нормоценоза, выявленного у 7 (35,0%) женщин и обусловленного присутствием Ureaplasma spp. и Candida spp. в количестве менее 104 ГЭ/мл.
Обследование на ВПЧ пациенток I и II групп продемонстрировало его наличие у 38 (60,3%) и 35 (57,3%) женщин соответственно с незначительными различиями между собой (р=0,734). При этом выявлена сильная положительная корреляционная связь наличия экзоцервицита у пациенток со смешанными и кандидозными вульвовагинитами на фоне герпесвирусных и папилломавирусных инфекций (r=+0,794), что не противоречит результатам зарубежных и отечественных исследователей [26, 27] и демонстрирует интегральный эффект вирусных инфекций. Наличие признаков экзоцервицита у большинства пациенток обеих групп при незначимых различиях (р=0,845) может объясняться тем, что условно-патогенные микроорганизмы при активном размножении могут вызывать секрецию провоспалительных цитокинов на фоне адгезивных контактов с инвазией эпителиальных клеток [28], что может приводить впоследствии к развитию воспалительного процесса в цервикальном эпителии. Воздействие на экзоцервикс в условиях иммунодефицитного состояния может осуществляться также анаэробами, а также выделяющимися в процессе их размножения нитрозаминами. Ряд работ демонстрируют воздействие на экзоцервикс факторами агрессии, продуцируемыми грибами рода Candida [29]. Присутствие в этих условиях ВПЧ дает вирусу дополнительный шанс в реализации онкогенного потенциала и диктует необходимость адекватной терапии.
Изучение вагинального рН продемонстрировало значительные различия между пациентками основных групп и женщинами группы контроля, в частности, смещение рН в щелочную сторону (рН≥5,0) у женщин I и II групп, в III группе рН=4,5 (р=0,001). Известно, что изменение рН среды в щелочную сторону способствует продукции микроорганизмами высокоактивных веществ с возможным повреждением иммунокомпетентных клеток и развитием локального иммунодефицита [30]. Незначительные межгрупповые различия (I и II групп) в данном показателе (р=0,673) могут свидетельствовать о единстве патогенетических механизмов возникновения цервикального воспалительного процесса на фоне вагинального дисбиоза, независимо от лидирующих возбудителей и диктует необходимость оптимизации комплексного лечения пациенток с включением на этапе реабилитации интимной противовирусной гигиены.
Через 14 дней после начала терапии у пациенток I группы (1А, 1B, 1С подгрупп) выявлено отсутствие жалоб и побочных явлений у 96,7, 96,8, 80,0% пациенток соответственно. Через 40 дней восстановление вагинального биотопа и рН среды (абсолютный и относительный нормоценоз) отмечалось у 25 (80,6%) пациенток 1А группы, что статистически значимо отличалось от данного показателя 1B группы – 30 (93,8%) женщин со значительным преимуществом абсолютного нормоценоза (χ²=6,573; р=0,004). В 1С группе восстановление лактобациллярной флоры с ацидификацией выявлено лишь у 9 (45,0%) пациенток, что статистически значимо отличалось от аналогичного показателя в группах 1А и 1B (χ²=5,498; р=0,006 и χ²=9,421; р=0,001 соответственно). Сравнительная характеристика видов вагинального микробиоценоза у пациенток I группы (1А, 1B, 1С подгрупп) до и после лечения, а также в сравнении с группой контроля условно здоровых пациенток (III) представлена в таблице 2.

Восстановление лактобациллярной флоры у пациенток 1B группы на фоне применения противовирусной интимной гигиены в расширенном варианте с молочной и глицирризиновой кислотами «Панавир Интим Нормафлор» свидетельствовало о значительной роли ацидификации для сохранения и поддержания гомеостаза вагинальной микробиоты при персистирующих герпесвирусных инфекциях.
Контрольный визит через 3 месяца после проведения терапии продемонстрировал наличие рецидивирующего вульвовагинита в 1А группе в 6 (19,3%) с умеренным и выраженным дисбиозом, что значительно отличалось от группы 1С, где выявлено рецидивирование в 8 (40,0%) случаях (χ²=8,437; р=0,001). Следует отметить лишь 2 случая рецидивирования вульвовагинита в 1B группе (6,2%), что значимо отличалось от аналогичного показателя в 1А и 1С группах (р=0,002 и р=0,001 соответственно). Таким образом, включение в терапию смешанных вульвовагинитов наряду с антибактериальной терапией противовирусного препарата «Панавир» в виде суппозиториев и на втором этапе спрея «Панавир Интим» снижало рецидивирование процесса в 2,1 раза. Применение спрея «Панавир Интим Нормафлор» снижало рецидивирование заболевания в 6,4 раза.
Полученные данные свидетельствовали о значительной роли противовирусной терапии и дальнейшей противовирусной интимной гигиены с дополнительной ацидификацией глицирризиновой и молочной кислотой при лечении смешанного вульвовагинита и восстановлении вагинального биотопа у пациенток с персистирующими герпесвирусными инфекциями, поскольку «Панавир Интим Нормафлор» способствует восстановлению естественного уровня рН, поддержанию кислотно-щелочного баланса микрофлоры, создает неблагоприятные условия для оставшейся после антибактериальной терапии патогенной и условно-патогенной микрофлоры, профилактирует дальнейшую персистенцию герпесвирусных и бактериальных инфекций на местном уровне
Во II группе через 14 дней у пациенток 2А, 2B и 2C групп исчезли жалобы у 29 (96,6%), 26 (83,9%), 17 (85,0%) пациенток соответственно, с незначительными межгрупповыми различиями (р=0,845, р=0,796, р=0,538 соответственно). Через 40 дней восстановление вагинального биотопа и рН среды отмечалось у 28 (93,3%) пациенток 2А группы, что значимо отличалось от данного показателя 2B группы – 16 (51,6%) (χ²=9,358; р=0,001) и свидетельствовало о неблагоприятном влиянии молочной кислоты на восстановление вагинальной микробиоты у пациенток с кандидозным вульвовагинитом. Данный феномен может объясняться повышенным синтезом полисахаридов маннанов молочной кислотой, под слоями которых маскируется компонент клеточной стенки грибов – бета-глюкан – «патоген-ассоциированный молекулярный паттерн», благодаря чему грибы «скрываются» от иммунокомпетентных клеток и в результате активно размножаются [31]. В группе 2С восстановление лактобациллярной флоры с ацидификацией выявлено лишь у 11 (55,0%) пациенток, что статистически значимо отличалось от аналогичного показателя в группе 2А (χ²=8,326; р=0,001) и незначимо – от показателя в группе 2B (χ²=1,116; р=0,587). Полученные данные свидетельствовали о значительной роли сочетания противокандидозной терапии с противовирусной и дальнейшей противовирусной интимной гигиены с помощью спрея «Панавир Интим» при лечении кандидозного вульвовагинита у пациенток с персистирующими герпесвирусными инфекциями.
Контрольный визит через 3 месяца после проведения терапии продемонстрировал наличие рецидивирующего кандидозного вульвовагинита во 2А группе в 1 (3,3%) случае, в 2B группе – в 7 (22,5%) случаях, во 2С группе рецидивирование процесса выявлено в 6 (30%) случаях. Таким образом, включение в терапию кандидозных вульвовагинитов, наряду с антимикотиками, противовирусного препарата «Панавир» в виде суппозиториев и на втором этапе спрея «Панавир Интим» снижало рецидивирование процесса в 9,1 раза. Применение спрея «Панавир Интим Нормафлор» снижало рецидивирование заболевания лишь в 1,3 раза. Полученные данные свидетельствовали о значительной роли противовирусной терапии и дальнейшей противовирусной интимной гигиены без дополнительной ацидификации глицирризиновой и молочной кислотой при лечении кандидозного вульвовагинита и восстановлении вагинального биотопа у пациенток с персистирующими герпесвирусными инфекциями.
В процессе применения спрея «Панавир Интим Нормафлор» по данным оценки дискомфорта по шкале Вонга–Бейкера установлено, что средняя оценка интенсивности дискомфорта в области гениталий снизилась с 5,68 до 2,13 балла. 96,31% пациенток отметили хорошую переносимость спрея.
Выводы
1. У пациенток с вульвовагинитами, развившимися на фоне герпесвирусных инфекций, наряду с антибактериальной терапией целесообразно применение противовирусного препарата «Панавир» в форме суппозиториев для лечения генитального герпеса независимо от наличия клинических проявлений.
2. Для профилактики рецидивирования смешанных вульвовагинитов на фоне герпесвирусных инфекций на 2-м этапе после антибактериальной и противовирусной терапии целесообразно назначение спрея «Панавир Интим Нормафлор» с активными противовирусными компонентами, с последующей рекомендацией назначения данного спрея для длительного применения в качестве интимной гигиены
3. Для профилактики рецидивирования кандидозных вульвовагинитов на фоне герпесвирусных инфекций на 2-м этапе после антимикотиков и противовирусной терапии целесообразно назначение спрея «Панавир Интим» с последующей рекомендацией назначения данного спрея для длительного применения в качестве интимной гигиены



