По данным Всемирной организации здравоохранения, опубликованным в 2018 г., осложнения, возникшие во время беременности и родов или в послеродовом периоде, ежедневно являются причиной смерти 800 женщин и 7700 новорожденных [1].
К акушерским индикаторам неблагоприятного исхода родовспоможения принято относить следующие события: 1) оценка по шкале Апгар менее 7 баллов через 5 минут; 2) переливание крови; 3) родовая черепно-мозговая травма; 4) интранатальная гибель плода или неонатальная смерть новорожденного весом более 2500 г; 5) материнская смерть; 6) поступление матери в отделение интенсивной терапии; 7) релапаротомия; 8) непредвиденное поступление в отделение интенсивной терапии новорожденных весом больше чем 2500 г и более чем на 24 ч; 8) разрыв матки [2].
Многие неблагоприятные исходы являются неизбежным следствием патологического процесса, то есть непредотвратимы, а факторы их наступления – неуправляемы. Однако акушерство является той областью медицины, в которой факторы наступления неблагоприятного исхода требуют самого пристального внимания и изучения. Во-первых, роды являются превалирующей причиной госпитализации в развитых странах и только в США обусловливают не менее 4 млн госпитализаций ежегодно. Во-вторых, акушерская помощь связана с повышенными социальными ожиданиями, связанными с потребностями каждой семьи в рождении здорового ребенка. В-третьих, судебно-медицинский климат акушерства исторически имеет высокий уровень финансовых притязаний к врачам и медицинским организациям, что делает неблагоприятные исходы финансово дорогостоящими для системы здравоохранения и эмоционально тяжелыми как для пациентки и ее семьи, так и для акушера-гинеколога [3].
В Российской Федерации показатели материнской смертности c 2012 по 2017 гг. снизились на 23,5% и достигли минимального значения за всю историю – до 8,8 случая на 100 тыс. детей, родившихся живыми. Однако в 2018 г. эти показатели снова выросли до 9,1 случая на 100 тыс. детей. Несмотря на положительную в целом тенденцию, стабильно высокой в структуре причин материнской смертности остается доля экстрагенитальных заболеваний (болезни системы кровообращения, органов дыхания, органов пищеварения, инфекционные и паразитарные болезни, в т.ч. ВИЧ и туберкулез, новообразования, болезни нервной, мочеполовой системы, сахарный диабет), которые и образуют группу непрямых причин акушерской смерти [4].
В зарубежных исследованиях также отмечается, что неудовлетворительная дородовая помощь, в том числе связанная с ненадлежащей диагностикой и лечением экстрагенитальной патологии, входит в число 10 ведущих преодолимых факторов материнской и перинатальной смерти, поскольку обусловливает 4,9% неблагоприятных исходов [5].
Поскольку случаи материнской смертности в силу достижений современного акушерства в развитых странах становятся редким явлением, их анализ постепенно утрачивает научную значимость из-за небольшого набора статистических данных. Однако материнская смертность признается «верхушкой» айсберга, поскольку значительно больше женщин переживают во время беременности, родов и в послеродовом периоде серьезные осложнения с высоким риском смертельного исхода, обусловленные теми же факторами, что и сама по себе материнская смертность.
Практически все развитые страны сталкиваются с ненадлежащим вниманием к соматической патологии беременных, особенно на догоспитальном этапе. Согласно проведенному в США ретроспективному когортному исследованию более 11 тыс. беременных, только 12,5% пациенток проходят ранний скрининг на гестационный сахарный диабет (ГСД). У беременных с ожирением III степени данный показатель выше (48,6%), однако все равно не достигает даже половины наблюдаемых женщин [6].
Между тем многочисленные исследования показывают значительный (более чем в 2 раза) рост частоты сахарного диабета у беременных за прошедшие 20 лет [7]. На рубеже XX–XXI вв. сформировалось и определение ГСД как непереносимости глюкозы с началом беременности или первым ее выявлением в период гестации [8, 9]. С начала 2000-х гг. международным консорциумом исследователей гипергликемии и неблагоприятных исходов беременности (Hyperglycemia and Adverse Pregnancy Outcomes Study – HAPO) публикуются данные о том, что не только ГСД, но и беременные с гипергликемией, не диагностируемой как ГСД, подвержены риску неблагоприятных перинатальных исходов [10]. Лечение легкой гипергликемии снижает связанные с ней риски [11, 12]. Изучение гипергликемии и неблагоприятных исходов беременности заставило пересмотреть критерии ГСД, сформированные еще в 1964 г. [13].
На основе полученных HAPO данных в США, Японии, ФРГ и ряде других развитых стран были приняты новые критерии ГСД; в Российской Федерации в 2013 г. утверждены клинические рекомендации (протокол лечения) «ГСД: диагностика, лечение, послеродовое наблюдение».
Однако в последние годы вышли данные и других исследователей, которые, развивая полученные результаты и дополняя их, свидетельствуют о необходимости самого пристального внимания к проблеме гипергликемических нарушений у беременных для улучшения перинатальных исходов, снижения частоты тяжелых осложнений (родового травматизма, макросомии плода, неонатальной гипергликемии и т.д.). Отчасти результаты этих исследований получили отражение в клинических рекомендациях «ГСД. Диагностика, лечение, акушерская тактика, послеродовое наблюдение», разработанных Российской ассоциацией эндокринологов и Российским обществом акушеров-гинекологов в 2020 г. [14].
Цель исследования: представить результаты ретроспективных когортных исследований, охватывающих не менее тысячи женщин с диагностированным сахарным диабетом, выявленным как до, так и во время беременности, а также c гипергликемией, не диагностируемой как сахарный диабет, в сравнении с пациентками с нормальным уровнем глюкозы. Оценить эти результаты на предмет риска наступления неблагоприятных исходов беременности и родов в зависимости от наличия гипергликемических нарушений у женщины. Проанализировать влияние коррекции гипергликемических нарушений у беременной на исход беременности и родов.
Материалы и методы
При подготовке обзора использовались данные, опубликованные в открытой печати на русском и английском языках, в том числе полученные после публикации отчетов HAPO в 2008–2014 гг. Поиск осуществлялся по базе данных PubMed до июня 2020 г. Изученные материнские факторы включали в себя материнский возраст, индекс массы тела, концентрацию глюкозы в плазме. Оцениваемые переменные исхода: преждевременные роды, низкий/высокий вес при рождении, мертворождение, родовые травмы. Систематический обзор следует принципам PRISMA. Соответствующие метаанализы были выполнены.
Результаты
HAPO рандомизированы истории 23 316 родов. Среди исходов этих родов зафиксировано 2 случая материнской смертности (один – из-за легочной эмболии, другой – из-за дыхательной недостаточности, вторичной к пневмонии), 14 случаев эклампсии, 321 случай серьезных пороков развития у новорожденного и 130 перинатальных смертей (89 плодов и 41 новорожденный или младенец) (заболеваемость 5,6 на 1000). Критериями исключения для проведенного исследования явились следующие характеристики пациенток: возраст моложе 18 лет, неопределенная дата последней менструации и отсутствие ультразвуковой оценки между 6-й и 24-й неделей гестационного возраста, невозможность пройти пероральный глюкозотолерантный тест (ПГТТ) в течение 32 недель беременности, многоплодная беременность, зачатие с помощью индукции овуляции гонадотропином или ЭКО, диагностика диабета во время либо до текущей беременности и его терапия, заражение ВИЧ, вирусом гепатита B или C.
Авторы анализировали первичные и вторичные исходы. К первичным исходам (т.е. основным неблагоприятным событиям) они относили вес при рождении выше 90-го центиля для гестационного возраста, первичное кесарево сечение, клиническую неонатальную гипогликемию и уровень С-пептида в пуповинной крови выше 90-го центиля (гиперинсулинемия плода). Вторичными неблагоприятными исходами (производными от основных) признавали преждевременные роды (до 37 недель беременности), дистоцию плечиков или плечевые травмы, необходимость интенсивной неонатальной помощи, гипербилирубинемию и преэклампсию. Дополнительно собирались данные о возможных тяжелых неблагоприятных последствиях (смерть, родовая травма и серьезный порок развития).
Была установлена взаимосвязь частоты неблагоприятных исходов в зависимости от уровня глюкозы при ПГТТ.
Авторы также установили взаимосвязь частоты первичных исходов в зависимости от уровня глюкозы при ПГТТ, разделив концентрацию глюкозы в плазме на 7 категорий (табл. 1): натощак: 1) менее 4,2 ммоль/л; 2) от 4,2 до 4,4 ммоль/л; 3) от 4,5 до 4,7 ммоль/л; 4) от 4,8 до 4,9 ммоль/л; 5) от 5,0 до 5,2 ммоль/л; 6) от 5,3 до 5,5 ммоль/л; 7) ≥5,6 ммоль/л; через 1 ч: ≤5,8 ммоль/л; 2) от 5,9 до 7,3 ммоль/л; 3) от 7,4 до 8,6 ммоль/л; 4) от 8,7 до 9,5 ммоль/л; 5) от 9,6 до 10,7 ммоль/л; 6) от 10,8 до 11,7 ммоль/л; 7) ≥11,8 ммоль/л); через 2 ч: 1) ≤5,0 ммоль/л); 2) от 5,1 до 6,0 ммоль/л; 3) от 6,1 до 6,9 ммоль/л; 4) от 7,0 до 7,7 ммоль/л; 5) от 7,8 до 8,7 ммоль/л; 6) от 8,8 до 9,8 ммоль/л; 7) ≥9,9 ммоль/л.
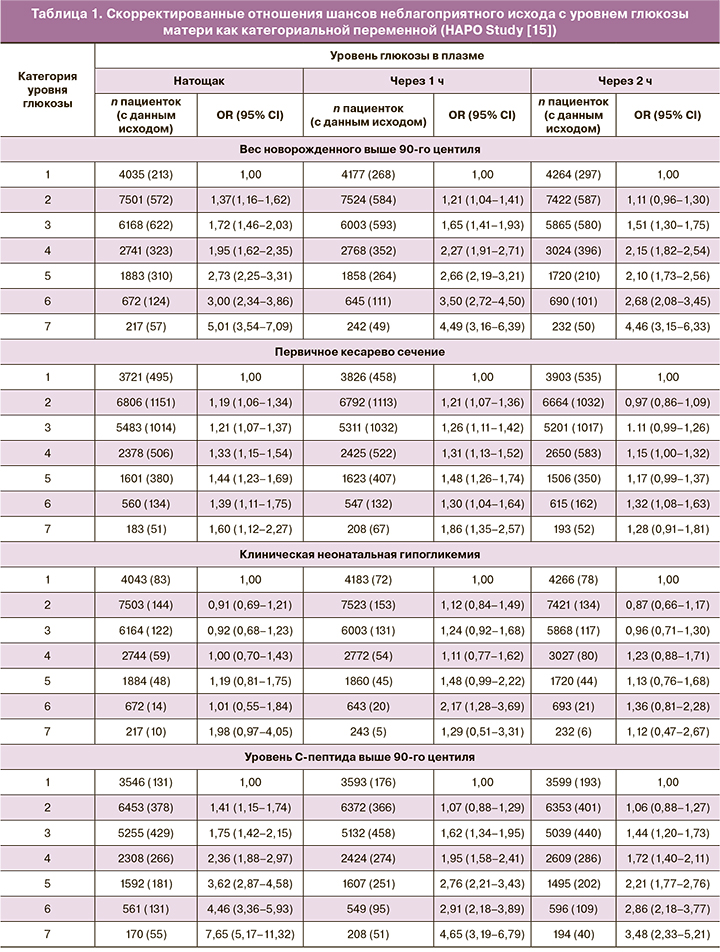
При увеличении уровня глюкозы у матери (натощак) частота неблагоприятного перинатального исхода возрастала. Так, частота крупного плода (вес новорожденного выше 90-го центиля) при самом низком уровне глюкозы (1-я категория) составляла всего 5,3%, тогда как при самом высоком (7-я категория) – 26,3%, частота первичного кесарева сечения – соответственно 13,3% и 27,9%, частота клинической гипергликемии новорожденных – соответственно 3,7% и 32,4%, частота уровня С-пептида выше 90-го центиля – соответственно 3,7% и 32,4%.
Далее авторами показана взаимосвязь уровня глюкозы в плазме как категориальной переменной с каждым первичным исходом. Указывается отношение шансов (OR) такого исхода для каждой категории в сравнении с самой низкой категорией. Показатели глюкозы для каждой категории приведены выше. Коррекция делалась c учетом конкретного исследовательского центра, возраста, индекса массы тела (ИМТ), роста пациентки, никотинового статуса и употребления алкоголя, наличия или отсутствия диабета в семейном анамнезе, гестационного срока при проведении ПГТТ, пола новорожденного, наличия или отсутствия факта госпитализации перед родами, среднего артериального давления.
Выявлено значительное увеличение веса новорожденного по мере роста показателей гликемии у матери. Различия в среднем весе при рождении между самой низкой и самой высокой категориями уровней глюкозы в плазме натощак, через 1 и 2 ч составляли от 242 до 305 г. ОR для первичного кесарева сечения было значимым прежде всего в самой высокой категории 1-часового уровня глюкозы (1,86). Взаимосвязь клинической неонатальной гипогликемии с гликемией матери убедительно не прослеживалась. При этом установлена сильная взаимосвязь между уровнем С-пептида в пуповинной крови выше 90-го процентиля и материнской гликемией: OR=7,65 (95% CI 5,17–11,32) для самой высокой категории уровня глюкозы в плазме натощак.
В исследовании HAPO также показано OR неблагоприятных перинатальных исходов при повышении концентрации глюкозы в плазме на 1 стандартное отклонение (SD): 0,4 ммоль/л натощак, 1,7 ммоль/л через 1 ч и 1,3 ммоль/л через 2 ч. Результаты отражены в таблице 2.
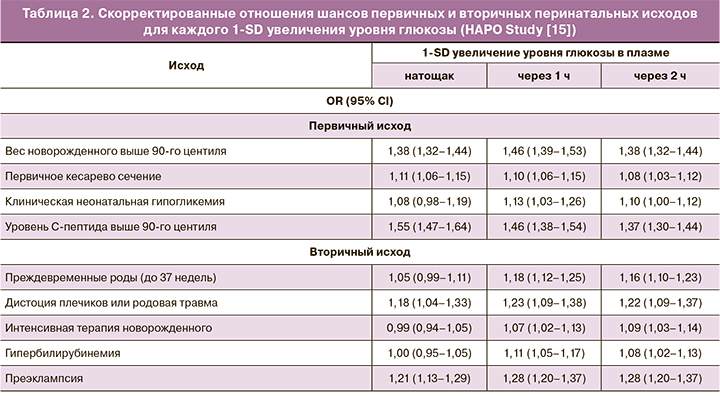
Наиболее сильные ассоциации были обнаружены при преэклампсии, для которой OR для каждого 1-SD увеличения в каждом измерении глюкозы составляло 1,21–1,28, и при дистоции плечиков или родовой травме (приблизительно 1,20).
Исследование HAPO не позволило с достаточной статистической точностью установить взаимосвязь материнской гликемии и рисков перинатальной смерти [15].
К выводу об отсутствии повышенного риска перинатальной смертности при ГСД пришла и австралийская группа авторов, исследовавших в эти же сроки непереносимость углеводов у беременных женщин. При этом авторы оценивали возможность снижения частоты других перинатальных осложнений (макросомии, дистоции плечиков, родовых травм), а также задержки интеллектуального развития ребенка за счет своевременного и адекватного лечения ГСД.
В группу вмешательства были включены женщины c одноплодной или двухплодной беременностью между 16-й и 30-й неделями гестации, у которых уровень глюкозы в плазме натощак составлял <7,8 ммоль/л и 7,8–11 ммоль/л в течение 2 ч после 75-граммовой нагрузки. Исключались женщины с более серьезной гликемией, а также получавшие ранее лечение в связи с ГСД либо имевшие хронические соматические заболевания, за исключением гипертонической болезни.
Пациентки из группы вмешательства консультировались диетологом, 4 раза в день контролировали уровень глюкозы до тех пор, пока он не находился в рекомендованном диапазоне (натощак от 3,5 до 5,5 ммоль/л, перед приемом пищи – не >5,5 ммоль/л, в течение 2 ч после приема пищи – не >7,0 ммоль/л). Затем проводили ежедневный мониторинг. 100 пациенток (20%) получали терапию инсулином в дозах, скорректированных на основе уровня гликемии (при наличии не менее двух результатов натощак ≥5,5 ммоль/л или после приема пищи ≥7,0 ммоль/л до 35-й недели беременности; ≥8,0 ммоль/л после приема пищи после 35-й недели беременности; при однократном показателе глюкозы ≥9,0 ммоль/л в капиллярной крови). Пациентки контрольной группы не знали о непереносимости глюкозы, лечение при наличии данных за ГСД получали по показаниям, в том числе 17 пациенток (3%) – инсулинотерапию.
Перинатальной смерти не было среди младенцев в группе вмешательства, но было пять перинатальных смертей (три мертворождения и две смерти новорожденных) среди младенцев в группе рутинного ухода. Два случая антенатальной гибели не получили объяснения, дефекты родовспоможения выявлены не были. Еще один случай, наступивший на 35-й неделе беременности, был обусловлен преэклампсией и задержкой внутриутробного развития. Причины неонатальной смерти: врожденная аномалия и асфиксия во время родов. Значимых различий между группами при возникновении дистоции плечиков не выявлено.
Вторичные исходы у новорожденных от матерей в группе вмешательства и в контрольной группе отражены в таблице 3.
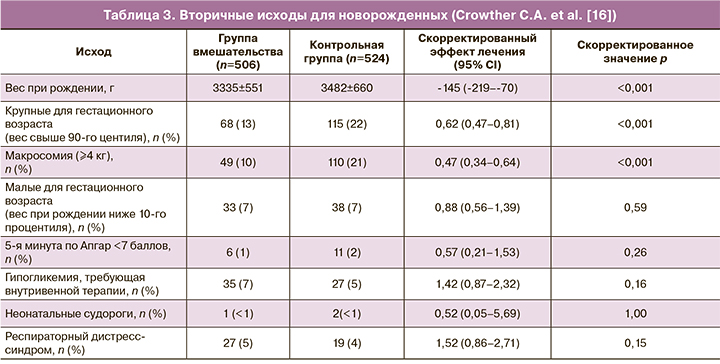
Приведенные результаты демонстрируют, что младенцы, рожденные от женщин в группе вмешательства, имели значительно более низкий средний вес при рождении, чем младенцы, рожденные от женщин в группе рутинного ухода (р<0,001), и они также родились в более раннем гестационном возрасте в связи с более высокой частотой индукции родов. Значительно меньше младенцев в группе вмешательства были большими для гестационного возраста при рождении, и значительно реже встречалась макросомия [16].
Таким образом, авторы приведенных исследований сходятся во мнении, что гипергликемия матери имеет одним из вторичных неблагоприятных исходов для новорожденных крупный вес ребенка для гестационного возраста – свыше 90-го центиля (RR=0,62; 95% CI 0,47–0,81; р<0,001).
Проведенное позднее, в 2018 г., ретроспективное когортное исследование 69 210 историй одноплодных родов в госпитале г. Брисбена (Австралия) показало повышенный риск серьезных неблагоприятных исходов (комплекс тяжелых ацидозов при рождении, Апгар менее 3 баллов через 5 минут, неонатальная реанимация, смерть) у детей в ≥97-й центильной группе (RR 1,51; 95% CI 1,30–1,75) [17].
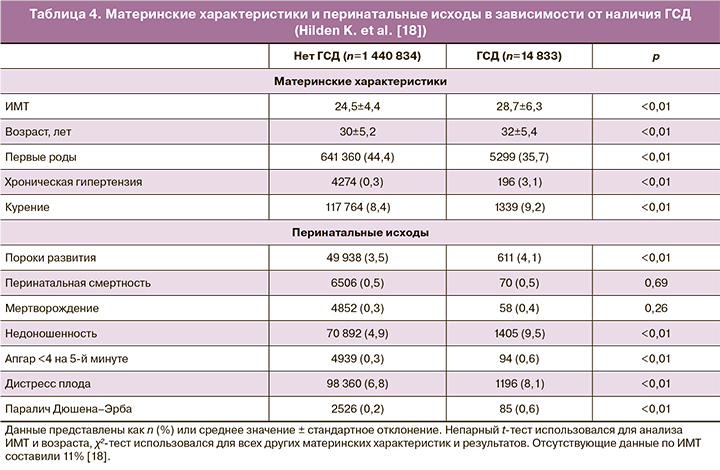
Взаимосвязь ГСД и неблагоприятных акушерских исходов установлена в исследовании Hilden K. et al. (2019). После исключения женщин с диабетом 1-го и 2-го типов до беременности, а также женщин с многоплодной беременностью в группу исследования вошли 1 294 006 женщин с данными индеса массы тела (ИМТ) на ранних сроках беременности. У 14 833 женщин (1%) был диагностирован ГСД. Данные по ИМТ отсутствовали у 11% женщин, однако доля ГСД у женщин без информации об ИМТ была такой же (1%), как и у женщин с данными ИМТ. Из всех исследованных женщин 35,9% имели ИМТ ≥25 кг/м2, а 11,3% – ИМТ ≥30 кг/м2. Среди женщин с ГСД 67,7% имели избыточный вес или ожирение, а 37,6% страдали ожирением.
Полученные данные отражены в таблице 4.
Несмотря на длительный период исследования, в литературе по-прежнему отмечается недостаточное количество качественных данных о влиянии различных вмешательств (в их сравнении) на состояние здоровья женщин с ГСД и на последствия ГСД для состояния здоровья их детей.
Так, в обзоре Martis R. et al. проанализированы данные 128 рандомизированных контролируемых исследований (РКИ), включающих 27 сравнений, 17 984 женщины, 16 305 младенцев и 1441 ребенка. Высказано суждение только об одном эффективном вмешательстве для лечения женщин с ГСД, предполагающем коррекцию образа жизни беременной для снижения риска большого гестационного периода и, соответственно, крупного плода (OR 0,60; 95% CI 0,50–0,71; 6 РКИ; n=2994; уровень доверия средний). Наоборот, вредные для здоровья формы поведения (употребление табака, отсутствие физической активности, нездоровое питание, употребление алкоголя и т.д.) повышают риск неблагоприятных последствий, обусловленных ГСД (OR 1,20; 95% CI 0,99–1,46; 4 РКИ; n=2699; уровень доверия средний). Были также получены данные о повышенном риске гипертонических расстройств беременности, обусловленных применением инсулина (OR 1,89; 95% CI 1,14–3,12; 4 РКИ; n=1214; уровень доверия средний). Доказательства влияния применения инсулина на снижение осложнений, неблагоприятных исходов признаны неубедительными: преэклампсия (OR 1,14; 95% CI 0,86–1,52; 10 РКИ; n=2060), кесарево сечение (OR 1,03; 95% CI 0,93–1,14; 17 РКИ; n=1988), длительный гестационный срок (OR 1,01; 95% CI 0,76–1,35; 13 РКИ; n=2352), перинатальная смерть или тяжелая заболеваемость (OR 1,03; 95% CI 0,84–1,26; 2 РКИ; n=760) [19].
Заключение
1. Исследования, проведенные в течение двух последних десятилетий, подтверждают необходимость уделять самое пристальное внимание гипергликемическим нарушениям у беременных с целью снижения риска неблагоприятных перинатальных исходов.
2. Выявлено значительное увеличение веса новорожденного по мере роста показателей гликемии у матери. Каждое повышение концентрации глюкозы в плазме на 1 стандартное отклонение увеличивает риск преэклампсии, дистоции плечиков или родовой травмы.
3. Взаимосвязь материнской гликемии и рисков перинатальной смерти не установлена.
4. ГСД увеличивает риски тяжелых перинатальных осложнений: Апгар <4 баллов на 5-й минуте, дистресс плода, паралич Дюшена–Эрба.
5. Авторы современных исследований поставили под сомнение влияние применения инсулина на снижение частоты тяжелых перинатальных осложнений и неблагоприятных материнских исходов. Вместе с тем, с применением инсулина связывают повышенный риск гипертонических расстройств при беременности.



