В последние годы инфекционно-воспалительные заболевания органов малого таза (ВЗОМТ) занимают лидирующее положение в структуре гинекологической патологии. Росту нозологии способствовали инфекции, передаваемые преимущественно половым путем (ИППП), получившие широкое распространение в связи с низким уровнем сексуальной культуры, ранним началом половой жизни, промискуитетом [1–3]. Не подлежит сомнению, что основой медикаментозного лечения любого воспалительного процесса, является антибактериальная терапия. В то же время гинекологические больные значительно больше восприимчивы и к другим бактериальным инфекциям экстрагенитальной локализации. Также следует учитывать широко распространенную практику самолечения с применением различных препаратов, в том числе и для нормализации выделений из влагалища, приводящую к нарушению естественного антагонизма микроорганизмов.
В результате подавления нормальной сапрофитирующей микрофлоры и появления резистентности к препаратам усиленно и беспрепятственно размножаются грибы и условно-патогенные бактерии. Изменение микробиоценоза половых путей проявляется как увеличением количества условно-патогенных микроорганизмов и контаминацией несвойственных данному виду бактерий мест обитания, так и уменьшением количества и состава нормофлоры и прежде всего лактобацилл [4, 5]. В микробиоценозе влагалища здоровых женщин присутствуют до 9 видов лактобактерий аэробного и анаэробного происхождения, их титр достигает 108–109 КОЕ/мл. Чаще всего выделяют L. crispatus, L. jensenii, L. Plantarum, L. gasseri и L. iners, обозначаемые собирательным названием Lactobacillus acidophilus. Продукция лактобактериями молочной кислоты за счет ферментации гликогена, содержащегося в клетках многослойного плоского эпителия влагалища, приводит к окислению влагалищной среды, создающему неблагоприятные условия для роста условно-патогенных и патогенных микроорганизмов [6, 7]. В лабораторных опытах на 166 клинических штаммах патогенных и условно-патогенных микроорганизмов показано, что каждый из изученных пробиотических штаммов L. Acidophillus обладает индивидуальным спектром антибактериальной активности. Бактерии характеризовались высокой степенью адгезии, выраженной способностью к формированию биопленки, которая с помощью механизма конкурентного исключения предотвращала колонизацию условно-патогенными и патогенными микроорганизмами. Эксперименты in vitro показали, что адгезия лактобактерий возрастает при повышении концентрации эстрогена [8]. При назначении per vaginum эстрогены всасываются, минуя метаболизм в печени, и в то же время оказывают более выраженное влияние на эпителий влагалища [9,10].
Другой важный защитный механизм полезных штаммов лактобактерий включает продукцию перекиси водорода, окисляющего агента, уничтожающего патогенные микроорганизмы за счет продукции свободных радикалов. Наиболее высокие перекисьобразующие функции зарегистрированы у Lactobacillus jensenii, Lactobacillus gasseri., колонии которых более стабильны у пациенток с нормальной микрофлорой. В противоположность этому у пациенток с рецидивирующим бактериальным вагинозом влагалище чаще колонизируется штаммами лактобацилл, не способными продуцировать перекись водорода [9–11].
Антагонизм лактобактерий в отношении микроорганизмов обусловлен также продукцией антимикробных и антибиотикоподобных субстанций: лизоцима, бактериоцинов (лактацинов), короткоцепочечных жирных кислот, диацетила. Имеются многочисленные сведения о влиянии лактобацилл на систему иммунитета, которое проявляется в стимуляции фагоцитарной активности нейтрофилов, макрофагов, синтеза иммуноглобулинов, образования интерферонов, интерлейкинов и фактора некроза опухолей [12].
На основании вышеизложенного следует заключить, что нарушения микробиоценоза влагалища требуют коррекции, в том числе и при бактериальном вагинозе, рецидивирующем в ряде случаев даже после длительной системной антибактериальной терапии [13]. Наиболее физиологичными по регулирующему влиянию на микрофлору справедливо считаются препараты из живых бактерий нормального биоценоза, свободные от побочного действия химических препаратов. В настоящее время уже накоплен большой мировой опыт применения эубиотиков для нормализации флоры кишечника после применения антибактериальной терапии. Предпринимаются попытки, часто безуспешные, восстановления микробиоценоза влагалища с помощью различных штаммов лактобактерий (при их пероральном или местном применении). Интересны результаты исследования, проведенного в августе 2012 года в Норвегии [14], в котором принимали участие женщины, получившие длительный курс антибактериальной терапии с последующим применением препаратов лактобактерий, период наблюдения составил 2 года. Капсулы с лактобактериями применялись как вагинально, так и системно. Колонизацию влагалища лактобактериями наблюдали при интравагинальном введении у 17 из 43 женщин; ни у одной женщины при системном применении капсул с лактофлорой колонизации влагалища вводимыми микроорганизмами не произошло.
 Из зарегистрированных на территории России препаратов, содержащих лактобактерии, наиболее хорошо изучены свойства и клиническая эффективность швейцарского эубиотика гинофлора Э. Высокие дозы жизнеспособных лактобактерий, входящих в состав препарата, способствуют восполнению естественной флоры генитального тракта. Эстриол обеспечивает восстановление вагинального эпителия, насыщение его гликогеном. Лактоза, входящая в состав вагинальных таблеток, быстро ферментируется лактобактериями в молочную кислоту.
Из зарегистрированных на территории России препаратов, содержащих лактобактерии, наиболее хорошо изучены свойства и клиническая эффективность швейцарского эубиотика гинофлора Э. Высокие дозы жизнеспособных лактобактерий, входящих в состав препарата, способствуют восполнению естественной флоры генитального тракта. Эстриол обеспечивает восстановление вагинального эпителия, насыщение его гликогеном. Лактоза, входящая в состав вагинальных таблеток, быстро ферментируется лактобактериями в молочную кислоту.
В 80-х годах прошлого века было показано, что L. acidophilus KS400, продуцирует in vitro большое количество молочной кислоты и перекиси водорода [15]. Установлена ингибирующая активность штамма L. acidophilus KS400 в отношении роста E. coli, S. aureus и Candida albicans [15]. Результаты многоцентровых, рандомизированных, плацебо-контролируемых исследований, проведенных с 1996 по 2010 г., продемонстрировали эффективность применения комбинации Lactobacillus acidophilus KS400 и 0,03 мг эстриола – гинофлора Э – у пациенток с инфекцией влагалища различной этиологии, а также для восстановления микробиоценоза влагалища после антибактериальной терапии. Было установлено, что нормальный индекс микрофлоры значительно увеличился в основной группе (лечение комбинацией лактобактерии – эстриол) по сравнению с его значением в группе плацебо. При этом при дальнейшем наблюдении число рецидивов в основной группе было в 1,5 раза ниже – 7,9%, чем в группе плацебо – 12,6%.
Целью настоящего исследования была оценка эффективности локального применения гинофлора Э у пациенток с жалобами на выделения и дискомфорт во влагалище, обусловленными нарушениями количественного и качественного состава нормофлоры.
Материал и методы исследования
Проведено обследование и лечение 40 женщин с предварительным диагнозом рецидивирующий бактериальный вагиноз, дисбиоз микрофлоры влагалища. Все пациентки предъявляли жалобы на выделения, дискомфорт, связанный с зудом и жжением во влагалище.
Проведено комплексное обследование, включающее рН-метрию выделений, аминовый тест с 10% гидроксидом калия (КОН), микроскопическое и молекулярно-генетическое исследование материала, полученного из влагалища, цервикального канала. Для определения уровня рН влагалищных выделений, полученных из зеркала, использовали индикаторные полоски со шкалой от 2.4 до 7.0. С целью определения летучих аминов, свидетельствующих о доминировании анаэробной флоры, на предметном стекле смешивали влагалищные выделения с 1–2 каплями 10% КОН, появление или усиление «рыбного» запаха расценивалось как положительный результат.
При микроскопии мазки окрашивались по Граму и оценивались по шкале Ньюджента – стандартной десятибалльной шкале, основанной на оценке трех бактериальных морфологических типов (морфотипов) влагалища: А – Лактобациллы, B – Вагинальная гарднерелла и бактероиды, C – Мобилункус. Количество полученных баллов суммировали (A+B+C): 0–3 балла – нормальная микрофлора, 4–6 баллов – промежуточная микрофлора, 7–10 баллов – бактериальный вагиноз.
 Для молекулярно-генетического исследования использовали тест-систему с набором реагентов – флороценоз (количественное сравнение содержания конкретных представителей нормо- и условно-патогенной биоты с общей бактериальной массой (ОБМ)). Оценивалось качество взятия соскоба и адекватность результата исследования с помощью специального параметра – контроля взятия материала, сравнивалось количество лактобактерий с ОБМ; оценивалось количество условных патогенов в ОБМ; изучались: нормофлора (Lactobacillus spp.), факультативно-анаэробные (Enterobacterium spp., Streptococcuss pp., Staphylococcus spp.), облигатно-анаэробные микроорганизмы (Gardnerella vaginalis, Atopobium vaginae). У всех женщин были исключены ИППП.
Для молекулярно-генетического исследования использовали тест-систему с набором реагентов – флороценоз (количественное сравнение содержания конкретных представителей нормо- и условно-патогенной биоты с общей бактериальной массой (ОБМ)). Оценивалось качество взятия соскоба и адекватность результата исследования с помощью специального параметра – контроля взятия материала, сравнивалось количество лактобактерий с ОБМ; оценивалось количество условных патогенов в ОБМ; изучались: нормофлора (Lactobacillus spp.), факультативно-анаэробные (Enterobacterium spp., Streptococcuss pp., Staphylococcus spp.), облигатно-анаэробные микроорганизмы (Gardnerella vaginalis, Atopobium vaginae). У всех женщин были исключены ИППП.
Все пациентки получали гинофлор Э по 1 вагинальной таблетке на ночь № 12 на курс. На протяжении исследования проводилось 4 визита, включающих: осмотр в зеркалах слизистых гениталий до лечения, далее через 30 и 60 и 90 дней после лечения с лабораторным контролем.
Обработка полученных данных проводилась на персональном компьютере с помощью пакета программ Microsoft Office XP и дополнительной программы с набором функций для Excel, реализующих непараметрические методы проверки статистических гипотез.
Эффективность лечения оценивали по клинической эффективности – исчезновение жалоб и клинических проявлений и лабораторной эффективности – нормализация данных микроскопии и молекулярно-генетического исследования «флороценоз».
Результаты исследования
Средний возраст больных составил 29,0±2,3 года. Обследование показало, что на одну женщину с нарушениями микрофлоры гениталий в среднем приходилось 4–6 курсов антибактериальной терапии за год по поводу генитальной и экстрагенитальной патологии. При сборе анамнестических данных обращала внимание высокая частота перенесенных гинекологических заболеваний. Среди них отмечались такие как воспалительные заболевания органов малого таза, бесплодие, кистозные изменения яичников, операции на яичниках.
Результаты клинического обследования больных
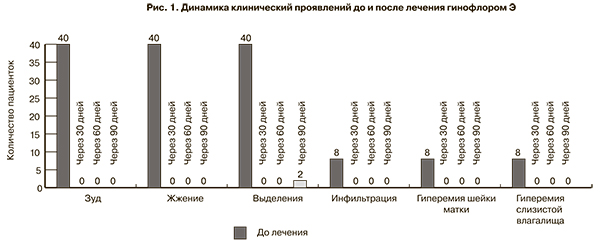
При осмотре в зеркалах отмечали сливкообразные, гомогенные, кремообразные выделения в заднем и боковых сводах влагалища. Слизистая шейки матки и влагалища без патологии зарегистрирована у 32 больных, гиперемированная и инфильтрированная – в 8 случаях. Во время первого визита констатировано исчезновение зуда и жжения в области гениталий на 2–3-й день применения гинофлора Э у всех женщин. Через 30 и 60 дней после проведенной терапии жалоб у пациенток не было, при осмотре в зеркалах патологических изменений со стороны слизистых влагалища, шейки матки и выделений не отмечали. При контрольном обследовании через 90 дней после лечения зарегистрированы обильные кремообразные выделения с запахом у 2 пациенток. Полученные данные представлены на (рис. 1).
Результаты рН-метрии
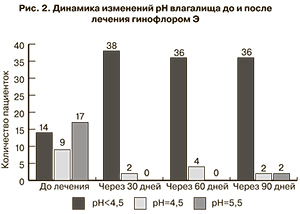
При измерении рН отделяемого влагалища с помощью индикаторных полосок до лечения гинофлором Э отмечали показатели рН=5.0 у 17 женщин, рН=4,5 у 9, рН<4,5 – у 14. Через 30 дней после терапии pH<4,5 наблюдали у 38 исследуемых, рН=4,5 в 2 случаях; через 60 дней слабокислая реакция с pH<4,5 регистрировалась у 36 женщин, рН=4,5 – у 4; через 90 дней pH<4,5 зарегистрирована у 36 пациенток, рН=4,5 – у 2, рН=5,5 – у 2 (рис. 2).
Результаты исследования летучих аминов
При проведении реакции с 10% раствором КОН до лечения положительный аминотест зарегистрирован у 9 пациенток. На 30-й и 60-й день после терапии гинофлором Э тест был отрицательным у всех женщин, что свидетельствовало о доминировании лактофлоры с высокой перекисьпродуцирующей активностью. Через 90 дней после проведенной терапии отрицательный анализ был в 38 случаях, положительный – в 2.
Результаты микроскопического обследования больных
При микроскопическом исследовании мазков, окрашенных по Граму, в вагинальном отделяемом соотношение количества лейкоцитов к эпителиальным клеткам 1:1 регистрировалось у 32 женщин, 2:1 – у 8; в мазке из цервикального канала – не более 10 в поле зрения у всех обследованных. В контрольном исследовании через 30 дней после проведенной терапии гинофлором Э у всех женщин регистрировалось соотношение количества лейкоцитов к эпителиальным клеткам в вагинальном отделяемом в соотношении 1:1, в мазке из цервикального канала – не более 10 в поле зрения.
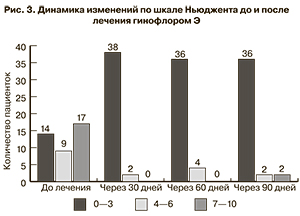
 При интерпретации результатов по шкале Ньюджента у 17 пациенток отмечали соотношение от 7 до 10 (бактериальный вагиноз), у 9 – 4–6 баллов (промежуточный тип), у 14 – 0–3 балла (отсутствие бактериального вагиноза). Через 30 дней после лечения выделения из цервикального канала и влагалища оценены в пределах от 0 до 3 баллов у 38 пациенток, от 4 до 6 баллов – у 2. На контрольном визите через 60 дней отсутствие нарушений в составе флоры зафиксировано у 36, у 4 больных – промежуточный тип. На последнем визите наблюдения состояние 36 пациенток не изменилось – при исследовании выделений зарегистрировано 0–3 балла, тогда как у 2 больных из 4 с промежуточным типом произошло смещение микробиоценоза в бактериальный вагиноз (рис. 3).
При интерпретации результатов по шкале Ньюджента у 17 пациенток отмечали соотношение от 7 до 10 (бактериальный вагиноз), у 9 – 4–6 баллов (промежуточный тип), у 14 – 0–3 балла (отсутствие бактериального вагиноза). Через 30 дней после лечения выделения из цервикального канала и влагалища оценены в пределах от 0 до 3 баллов у 38 пациенток, от 4 до 6 баллов – у 2. На контрольном визите через 60 дней отсутствие нарушений в составе флоры зафиксировано у 36, у 4 больных – промежуточный тип. На последнем визите наблюдения состояние 36 пациенток не изменилось – при исследовании выделений зарегистрировано 0–3 балла, тогда как у 2 больных из 4 с промежуточным типом произошло смещение микробиоценоза в бактериальный вагиноз (рис. 3).
Результаты молекулярно-генетического обследования больных с набором реагентов флороценоз
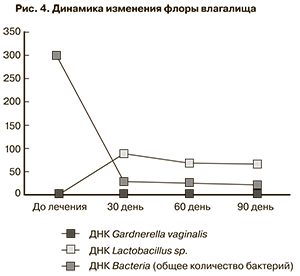
При изучении влагалищных выделений при помощи молекулярно-генетического метода с количественной оценкой с набором реагентов «флороценоз» было обнаружено, что независимо от дня менструального цикла количество лактобацилл было снижено у всех женщин. При интерпретации результатов у 17 пациенток соотношение количества лактофлоры к ОБМ расценено как дисбиоз анаэробный (бактериальный вагиноз) – количество Lactobacterium sрp. значительно снижено, повышено количество Gardnerella vaginalis, у 23 человек – мезоценоз – количество Lactobacterium sрp. несколько ниже количества Bacteria. В контрольном исследовании через 30 дней после проведенной терапии гинофлором Э нормоценоз – количество Lactobacterium sрр. соответствовало количеству Bacteria констатирован у 38 женщин, мезоценоз – количество Lactobacterium spp. несколько ниже количества Bacteria, количество Gardnerella vaginalis повышено – у 2 пациенток. На осмотре через 60 дней отсутствие нарушений в составе флоры зафиксировано в 36 случаях – нормоценоз, у 4 – мезоценоз. На последнем визите наблюдения качество выделений у 36 пациенток не изменилось, регистрировался нормоценоз, у 2 женщин из 4 с мезоценозом состав флоры сместился в сторону анаэробного дисбиоза – количество Lactobacterium sрp. снизилось, количество Gardnerella vaginalis повысилось – рис. 4.
Таким образом, назначение гинофлора Э приводило к достоверному увеличению количества лактобактерий и нормализации самочувствия. Полученные результаты перекликаются с данными двойного слепого плацебо-контролируемого исследования с участием 354 пациенток, свидетельствующими, что применение вагинальных таблеток, содержащих 50 мг лиофилизата L. acidophilus и 0,03 мг эстриола, в 1,5 раза снижает вероятность рецидива влагалищных инфекций после антибактериальной терапии.
Выводы
Жалобы на выделения и дискомфорт во влагалище после антибактериальной терапии в отсутствии лейкоцитоза в большинстве случаев обусловлены нарушением микробиоценоза, в частности снижением уровня лактобактерий.
В результате применения гинофлора Э курсом 1 таблетка в течение 12 дней у 95% женщин нормализовались клинические и лабораторные показатели.
Ни в одном случае нами не зарегистрировано нежелательных побочных явлений и/или аллергических реакций.
Высокая клиническая эффективность, хорошая переносимость позволяет рекомендовать препарат к широкому применению у пациентов после курсов антибактериальной терапии.



