Аномальные маточные кровотечения (АМК) у пациенток репродуктивного возраста встречаются с частотой до 30% и отрицательно влияют на качество жизни женщин [1]. Причинами АМК может быть как органическая патология, так и неорганическая [2]. В 2011 г. была разработана «Классификационная система FIGO (PALM-COEIN) причин АМК у небеременных женщин репродуктивного возраста», которая в 2018 г. была пересмотрена [3, 4]. Межменструальные кровотечения на фоне регулярного цикла более характерны для полипов эндометрия, хронического эндометрита и овуляторной дисфункции. Нерегулярные, непрогнозируемые длительные и/или обильные кровянистые выделения, чаще возникающие после задержек менструаций, более характерны для гиперплазии эндометрия [2].
В то же время по-прежнему глобальной проблемой здравоохранения во всем мире является анемия. Причем женщины страдают этим заболеванием чаще мужчин [5]. Наиболее частой причиной анемии является дефицит железа [6]. В свою очередь, причиной дефицита железа у женщин в большинстве случаев становится кровопотеря, связанная с нарушением менструального цикла [5, 6]. Общеизвестен тот факт, что железодефицитные состояния (ЖДС) коррелируют с нарушениями когнитивной функции, еще более существенно ухудшают качество жизни и сопровождаются снижением работоспособности [7]. При этом латентный дефицит железа (ЛДЖ) и железодефицитная анемия (ЖДА) у женщин могут долго оставаться без коррекции: после выписки из стационара за медицинской помощью к гинекологу в амбулаторных условиях пациентки обращаются редко, считая достигнутый в стационаре гемостаз единственно необходимым методом лечения. Как результат – пациентки репродуктивного трудоспособного возраста с симптомами гипоксии на фоне тяжелой анемии приходят на прием к терапевту.
Цель исследования: оценить эффективность коррекции ЖДС при хронических АМК у пациенток репродуктивного возраста.
Материалы и методы
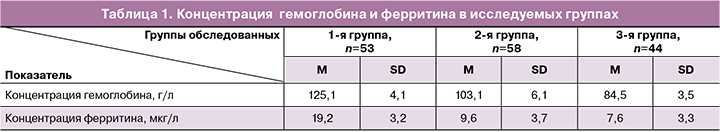
Проведено исследование, в которое включены 155 женщин репродуктивного возраста, госпитализированных с хроническим АМК в отделение гинекологии БУЗ Омской области «Клинический родильный дом №6». Из них 53 пациентки были с диагностированным ЛДЖ (1-я группа) и 102 женщины – с ЖДА (2-я группа – 58 пациенток с ЖДА легкой степени, 3-я группа – 44 пациентки с ЖДА средней степени) (табл. 1).
Критерии включения: возраст 18–45 лет; подписанное информированное согласие пациентки на участие в исследовании; диагностированное хроническое АМК (кровотечение, чрезмерное по продолжительности, объему и/или частоте, повторяющееся более 3 месяцев).
Критерии исключения: возраст младше 18 и старше 45 лет; отказ пациентки от участия в исследовании; олиго- и аменорея; беременность; менопауза и кровотечение в постменопаузе; острые заболевания или обострение хронических заболеваний в течение 6 месяцев до исследования; применение гормональных препаратов (в том числе препаратов гормональной контрацепции и менопаузальной или заместительной гормональной терапии), кровоостанавливающих лекарственных средств, витаминно-минеральных комплексов, биологически активных добавок к пище или препаратов железа в течение 6 месяцев до исследования.
Клинико-анамнестическое обследование включало опрос с уточнением репродуктивного анамнеза, наличия соматических и гинекологических заболеваний. Общеклинические методы лабораторного обследования включали определение уровня сывороточного железа (СЖ), общей железосвязывающей способности сыворотки (ОЖСС), ферритина и показателей общего анализа крови – гемоглобина, количества эритроцитов, среднего объема эритроцитов (MCV), содержания гемоглобина в эритроците (МСН). ЖДА легкой степени диагностировалась при концентрации гемоглобина 91–119 г/л и уровне ферритина <15 мкг/л; ЖДА средней степени фиксировали при уровне гемоглобина 90–71 г/л и уровне ферритина <15 мкг/л. При уровне гемоглобина ≥120 г/л ЛДЖ устанавливали по изменению уровня ферритина <30 мкг/л [8, 9].
Для лечения ЖДС использовали препарат «Ферретаб комп.», содержащий в одной капсуле для перорального приема 163,56 мг железа фумарата (эквивалентно 50 мг железа) и фолиевую кислоту 500 мкг. Режим терапии выбирался в зависимости от диагноза: ЛДЖ – суточная доза 1 капсула; ЖДА легкой степени – суточная доза 2 капсулы; ЖДА средней степени – суточная доза 3 капсулы.
Эффективность лечения оценивалась через 4 и 12 недель в 1-й и 2-й группе пациенток и через 4, 12 и 24 недели у пациенток 3-й группы. Клинический и лабораторный контроль включал оценку жалоб, связанных с ЖДС, концентрацию гемоглобина и ферритина.
Статистический анализ
Анализ выполнялся с использованием программного пакета Statistica 10.0 Rus. Проверка нормальности распределения выполнялась с помощью теста Колмогорова–Смирнова. При нормальном распределении данных они представлены в виде средних значений (М) и стандартного отклонения (SD). При распределении, отличном от нормального, определяли медиану (Ме) и интерквартильный интервал (25; 27). Качественные признаки представлены абсолютными (n) и относительными (%) частотами. При сравнении 3 и более зависимых групп по количественным признакам применялся одномерный дисперсионный анализ повторных наблюдений (ANOVA). Для расчета статистической значимости качественных различий применялся хивадрат (χ2) для независимых групп. Критический уровень значимости при проверке статистических гипотез принят за р<0,05.
Результаты
Анализ эффективности лечения ЖДС выполнялся среди всех включенных в исследование пациенток, соответствующих критериям включения. Группы исследованных были репрезентативны по возрасту (р=0,32): пациентки 1-й группы составляли возрастную группу от 28 до 42 лет (32,2; 39,4), 2-й группы – от 26 до 45 лет (28,5; 34,9), возраст пациенток 3-й группы составлял от 30 до 45 лет (34,7; 43,4). К младшей возрастной группе от 18 до 25 лет принадлежали 12/155 (7,8%) пациенток, к группе от 26 до 33 лет – 38/155 (24,5 %), от 34 до 40 лет – 43/155 (27,7%), от 40 до 45 лет – 62/155 (40,0%) женщины. Исходные данные пациенток представлены в таблице 2.
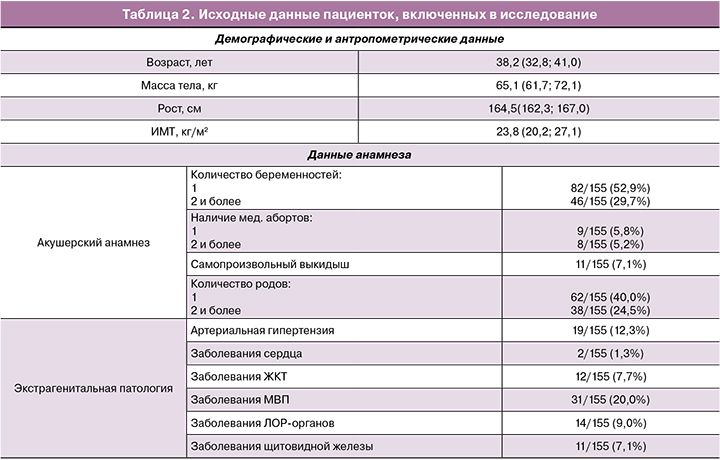
Анализ акушерского анамнеза у пациенток исследуемых групп также не выявил статистически значимых различий (р=0,14): среди пациенток 1-й группы роды в анамнезе были у 35/53 (66,0%) женщин, во 2-й группе – у 37/58 (63,6%), в 3-й группе – у 28/44 (63,6%) пациенток. Среди включенных в исследование 27/155 (17,4%) не имели беременностей, у 28/155 (18,1%) пациенток в анамнезе отмечалось спонтанное или искусственное прерывание беременности.
Сопутствующая экстрагенитальная патология отмечалась у 64 (41,3%) женщин, включенных в исследование. Чаще других в исследуемых группах регистрировались заболевания мочевыводящих путей (у 9/53 (9,4%) пациенток 1-й группы, 12/58 (20,7%) женщин во 2-й группе и 10/44 (22,7%) обследованных 3-й группы), артериальная гипертензия (5/53 (9,4%), 7/58 (12,1%), 7/44 (15,9%) соответственно) и болезни ЛОР-органов (5/53 (9,4%), 4/58 (6,9%), 5/4 (11,4%) соответственно). Патология щитовидной железы встречалась у 3/53 (5,7%) женщин 1-й группы, 4/58 (6,9%) женщин 2-й группы и у 4/44 (9,1%) обследованных 3-й группы. Чуть чаще соматически заболевания выявлены в группе 3, однако статистически значимых различий с группами 1 и 2 не получено (р=0,73 и 0,21 соответственно).
При госпитализации пациентки предъявляли жалобы на кровянистые выделения из половых путей. Симптомы, потенциально связанные с дефицитом железа, испытывали 77/155 (49,7%) пациенток: усталость, снижение работоспособности – 71/155 (45,8%); эпизоды головокружения, головную боль – 31/155 (20,0%); шум в ушах – 12/155 (7,7%); учащенное сердцебиение, чувство нехватки воздуха – 15/155 (9,7 %); извращение вкуса и обоняния (тяга к несъедобным продуктам и резким химическим запахам) – 12/155 (7,7%); выпадение волос, ломкость ногтей – 22/155 (14,2%).
Почти половина – 77/155 (49,7%) женщин сообщили, что ранее никогда не обследовались на предмет диагностики дефицита железа. Среди 78/155 (54,0%) пациенток, которым указанное исследование проводилось, ЖДА или дефицит железа вне беременности был установлен у 51/78 (65,4%), при этом только 38/78 (48,7%) из них получали лечение препаратами железа, в течение 6 месяцев до включения в исследование никакие железосодержащие лекарственные средства и биологически активные добавки указанные женщины не принимали.
Исходные средние значения концентрации гемоглобина и ферритина в исследуемых группах представлены в таблице 1. Всем пациенткам была назначена комплексная терапия, включающая транексамовую кислоту (суточная доза 3–4,5 г) и Ферретаб комп. по 1–3 капсулы в день (50–150 мг элементарного железа + 0,5–1,5 мг фолиевой кислоты) в зависимости от текущего статуса (ЛДЖ или ЖДА). Кроме того, 123/155 (79,4%) пациенткам было выполнено выскабливание стенок полости матки под контролем гистероскопии: 37 пациенткам 1-й группы, 42 – группы 2 и всем женщинам 3-й группы. Результаты гистологического исследования эндометрия показали, что чаще других хронические АМК возникали на фоне полипа эндометрия (у 17/37 (45,9%) пациенток 1-й группы, 20/42 (47,6%) женщин во 2-й группе и 23/44 (52,3%) обследованных 3-й группы), гиперплазии эндометрия без атипии (10/37 (27,1%), 14/42 (33,3%), 8/44 (18,2%) соответственно) и хронического эндометрита (5/37 (13,5%), 6/42 (14,3%), 11/44 (25,0%) соответственно). Эндометрий соответствовал фазе менструального цикла у 5/37 (13,5%) женщин 1-й группы, 2/42 (4,8%) женщин 2-й группы и у 2/44 (4,5%) обследованных 3-й группы. Полученные данные соответствуют данным литературы. Исследования последних лет свидетельствуют о том, что хронические АМК характерны для полипов эндометрия, хронического эндометрита, овуляторной дисфункции и гиперплазии эндометрия [2].
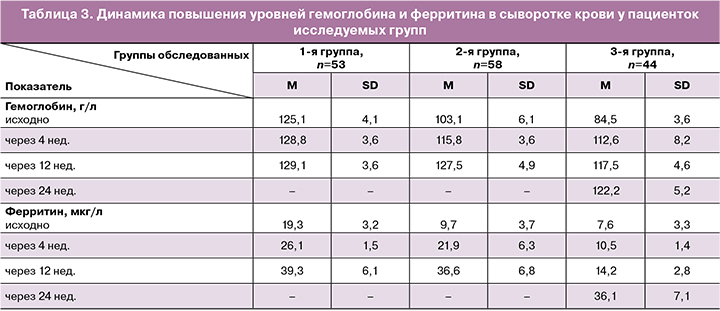
Пациентки с ЛДЖ (n=53) получали 100 мг элементарного железа и 1 мг фолиевой кислоты в двух капсулах препарата «Ферретаб комп.». Средняя концентрация гемоглобина в данной группе повысилась на фоне 12-недельного курса терапии с 125,1 (4,1) г/л до 129,0 (3,6) г/л (р<0,05), концентрация ферритина – с 19,2 (3,2) мкг/л до 39,3 (6,1) мкг/л (р<0,05). Женщины с концентрацией ферритина ниже 30 мкг/л продолжили прием препарата «Ферретаб комп.» по 1 капсуле в день до достижения целевых значений показателя запаса железа.
Женщины с ЖДА легкой (n=58) и средней степени (n=44) получали соответственно 100 и 150 мг элементарного железа в составе препарата «Ферретаб комп.». в течение 12 недель. В результате терапии было отмечено повышение концентрации гемоглобина во 2-й группе в среднем с 103,1 (6,1) г/л до 127,5 г/л (4,9) (р<0,001) и ферритина – с 9,7 (3,7) мкг/л до 36,5 (6,8) мкг/л (p<0,001). Терапия была продолжена у женщин, не достигших целевых значений ферритина. Так, все женщины группы 3 получали указанный препарат железа до 24 недель, и за этот промежуток времени концентрация гемоглобина у них повысилась в среднем с 84,5 (3,5) г/л до 122,2 г/л (5,2), p=0,01, а концентрация ферритина – с 7,6 (3,3) мкг/л до 36,0 (7,1) мкг/л (p=0,01) (табл. 3).
Кроме того, через 12 недель лечения была дана оценка динамике симптомов, потенциально связанных с дефицитом железа, у женщин, получавших «Ферретаб комп.» Результаты анализа свидетельствовали о снижении частоты жалоб на усталость и снижение работоспособности в 1,7 раза. Указанная жалоба была зарегистрирована у 71/155 (45,8%) пациентки до начала терапии и у 41/155 (26,5%) женщины через 12 недель после лечения. Кроме того, статистически значимое улучшение получено при оценке жалоб на головокружение, онемение конечностей, шум в ушах и извращение вкуса и обоняния: до начала лечения перечисленные жалобы были выявлены у 31/155 (20,0%), 17/155 (11,0%), 12/155 (7,7%), 12/155 (7,7%) пациенток соответственно. Через 12 недель лечения головокружение сохранялось у 11/155 (7,1%) женщин, онемение конечностей – у 5/155 (3,2%) обследованных, шум в ушах – у 3/155 (1,9%), извращение вкуса и обоняния – у 1/155 (0,6%) пациенток.
Уменьшение симптомов ЖДА на фоне приема препарата «Ферретаб комп.» может свидетельствовать о клинической эффективности антианемической терапии. Нежелательных явлений в исследуемых группах не выявлено, все пациентки отмечали хорошую переносимость препарата.
Обсуждение
Хронические АМК тесно ассоциированы с железодефицитными состояниями [10]. Распространенность ЖДА и ЛДЖ у женщин репродуктивного возраста заслуживает особого внимания, так как ЖДА является самым частым гематологическим осложнением в акушерстве [11]. Потребность в железе у беременной женщины возрастает на 50%, и его недостаточное поступление может привести к тяжелым последствиям. Поэтому выявление железодефицитных состояний и их своевременная коррекция являются важной составной частью прегравидарной подготовки. Для обеспечения приверженности к терапии оральными препаратами железа следует ориентироваться на выбор препарата с хорошей переносимостью, которая, в свою очередь, обеспечивается несколькими компонентами: возможностью пролонгированного высвобождения активных веществ, особенностями солей, связывающих железо, и других ингредиентов лекарственного средства, вводимых в состав препарата для улучшения усвоения минерала. Одним из обоснованных вариантов выбора клинициста является Ферретаб комп., в состав которого входят органическая соль (фумарат) железа и фолиевая кислота. Совместное применение железа и фолиевой кислоты оправдано не только улучшением всасывания железа, но и самостоятельной ролью фолатов в обеспечении гомеостаза [12]. Согласно рекомендациям ВОЗ, дотация фолиевой кислоты в периконцепционный период и во время беременности может варьировать от 400 мкг до 5 мг/сут (при высоком риске пороков развития плода) в комплексе с 30–60 мг железа [13]. Этим рекомендациям полностью соответствует состав препарата «Ферретаб комп.»: при терапии ЛДЖ доза фолиевой кислоты в двух капсулах составляет 1 мг, а увеличение фолатной дотации при ЖДА до 1,5 мг обосновано дополнительными нуждами метаболизма и кроветворения, обусловленными наличием манифестного дефицита железа.
Заключение
Таким образом, важной является оценка врачом амбулаторного приема клинического анализа крови с исследованием уровня гемоглобина, количества эритроцитов, MCV, МСН и концентрации ферритина у женщин репродуктивного возраста после госпитализации по поводу АМК. Применение препарата «Ферретаб комп.» является предпочтительным вариантом выбора для пациенток с железодефицитными состояниями благодаря наличию в нем фолиевой кислоты, необходимой женщинам репродуктивного возраста, возможности варьирования дозы и хорошей переносимости.



