В наши дни недостаточность железа встречается наиболее часто в ряду дефицита различных микроэлементов. Согласно результатам крупнейшего международного исследования, примерно 1,2 млрд жителей планеты имеют железодефицитную анемию (ЖДА) и 2,5 млрд – латентный дефицит железа (ЛДЖ) [1, 2]. В наибольшей степени склонны к развитию анемии дети и подростки, женщины фертильного возраста, включая беременных, и пожилые люди. Опубликованы данные Всемирной организации здравоохранения (ВОЗ), демонстрирующие, что ЖДА относится к одному из наиболее распространенных в настоящее время заболеваний среди женщин в мире: риск развития данного состояния составляет 50–86%, а частота выявления среди небеременных женщин репродуктивного возраста стоит на первом месте, доходя до 30% (что эквивалентно более чем 0,5 млрд женщин в возрасте 15–49 лет) [2–5]. В общей популяции беременных доля пациенток с ЖДА, определенной по уровню гемоглобина в крови, составляет в среднем 36,5%, варьируя от 21 до 80%, а выявленная по содержанию сывороточного железа – от 49 до 99% [3, 6, 7]. К окончанию гестационного периода железодефицитное состояние (ЖДС) развивается почти у каждой беременной [8, 9].
Анализ данных из опубликованных за последние годы источников, проведенный членами экспертного совета «Актуальные вопросы железодефицита в Российской Федерации» (2020), продемонстрировал недостаток точных сведений о распространенности ферродефицита в Российской Федерации (РФ), обусловленный объективными сложностями сбора статистической информации по данной проблеме [5].
По данным Министерства здравоохранения РФ, в 2021 г. 35,4% завершенных беременностей в РФ сопровождалось ЖДА различной степени тяжести [10]. Анемия имеет неблагоприятное влияние на течение гестации, а также обуславливает неблагоприятные репродуктивные исходы, такие как преждевременные роды, ассоциирована с низкой массой тела плода и снижением запасов железа у ребенка, что может привести к нарушению его дальнейшего развития, включая плохое когнитивное и двигательное развитие [11–13].
Для диагностики ЖДС и оценки эффективности его лечения как особо значимый показатель всегда рассматривалась концентрация гемоглобина в крови. Однако раннее выявление этого состояния, по мнению экспертов ВОЗ (2020), связано с определением концентрации сывороточного ферритина (СФ) как наиболее специфичного маркера ферродефицита в организме [14].
Понижение уровня СФ обнаруживается при ЛДЖ, когда в костном мозге выявляется полное истощение ресурсов железа и эритропоэтина. Для данного состояния характерны отсутствие явных клинических симптомов ЖДС, наличие уровня гематологических показателей и эритроцитарных индексов в пределах нижней границы референтного диапазона, отсутствие морфологических изменений клеток в мазках периферической крови [15, 16].
Величину СФ можно использовать и при выборе сроков начала лечения ЖДС в период гестации. Так, Норвежский совет по надзору за здравоохранением (Statens helsetilsyn, 2001) рекомендует разработанную им схему следующего назначения препаратов железа (ПЖ) беременным, в основу которой положена оценка СФ до 12 недель гестации. При уровне его более 60 мкг/л ПЖ не показаны; в интервале от 20 до 60 мкг/л назначение ПЖ нужно с 20-й недели беременности; при показателе менее 20 мкг/л прием ПЖ необходим с 12-й недели; уровень СФ менее 15 мкг/л требует немедленного начала терапии гипосидероза [17]. Такой подход позволяет своевременно начать лечение ЖДС ПЖ и предупредить развитие ЖДА и ассоциированных с ней осложнений беременности.
К одной из важнейших особенностей ЖДС относится их успешная коррекционная конвертируемость при своевременной терапии ПЖ, существенно различающимися по биодоступности, эффективности и безопасности компенсации ферродефицита. Однако низкий комплаенс пациенток из-за частого наличия тех или иных побочных эффектов требует назначения препаратов, лишенных этих недостатков [18, 19].
По нашему мнению, препаратом выбора для терапии ЖДС должно быть лекарственное средство, содержащее достаточное количество железа в сочетании с агентами, повышающими его всасывание, а также позволяющее в наибольшей степени защитить слизистую оболочку пищеварительного тракта от раздражающего действия ионов железа без ущерба для биодоступности препарата.
Этим критериям отвечает Ферлатум Фол, разработанный в лаборатории компании «Италфармако» (Милан, Италия) и предназначенный для профилактики и терапии латентного и клинически выраженного дефицита железа и фолатов [20].
Действующими компонентами данного оригинального препарата являются железа протеин сукцинилат (субстанция ITF 282, соединение номер 93615-44-2 по базе данных CAS) и фолиновая кислота.
В 15 мл препарата, содержащегося во флаконе, включено 800 мг железа протеин сукцинилата, эквивалентного 40 мг железа (III); в запечатанный колпачок-контейнер помещено 100 мг порошка, имеющего в составе 0,235 мг кальция фолината пентагидрата, что соответствует 0,185 мг фолиновой кислоты.
Железа протеин сукцинилат – полусинтетический железобелковый комплекс, получаемый путем сукцинилации белка коровьего молока казеина и обогащения его железом (III). Он хорошо преципитирует (выпадает в осадок) в кислой среде, сохраняя прочную связь атомов железа с сукцинилат-анионами и пептидными фрагментами казеина, и растворяется в щелочной среде. Такой уникальный дуализм физико-химических свойств комплекса обуславливает его очевидные преимущества перед другими препаратами – солями железа. При попадании в кислую среду желудка железа протеин сукцинилат благодаря своему белковому носителю преципитирует вокруг ионов железа (III), создавая защитную капсулу, что делает его нерастворимым, тем самым предотвращая повреждение слизистой и защищая само железо. Далее растворение и абсорбция Ферлатум Фол происходят в верхних отделах тонкого кишечника за счет физиологического пищеварения, в результате которого формируются железобелковые частицы, обладающие высокой биодоступностью. Из этих фрагментов в слизистой тощей кишки осуществляется высвобождение ионов железа (III), а затем их активное всасывание в кровь энтероцитами ворсинок [21].
Железа протеин сукцинилат в препарате дополнен его фармакокинетическим и фармакодинамическим синергистом – фолиновой кислотой (представленной кальция фолината пентагидратом), которая является активным метаболитом фолиевой кислоты. Доказано, что дефицит фолиевой кислоты в организме вызывает нарушение процессов роста и развития клеток, приводящее к атеросклерозу и сердечно-сосудистым заболеваниям, дефектам эритропоэза с развитием мегалобластной анемии, снижению антионкологического иммунитета. Во время беременности дефицит фолатов обуславливает изменения в пролиферации и дифференцировке клеток эмбриональных и плацентарных структур с формированием врожденных пороков, повышение частоты фетоплацентарной недостаточности, преэклампсии и преждевременных родов [2].
Также установлено, что недостаток фолатов в организме (например, в период гестации или лактации) замедляет процесс усвоения железа. И наоборот, ферродефицит делает возможным развитие вторичного дефицита фолатов [22, 23].
Рекомендованная FIGO (2019) схема совместного применения ПЖ и фолатов повышает эффективность антианемической терапии, позволяя решить проблему ЖДС и профилактируя одновременно другие фолатзависимые гестационные осложнения, что и используется в Ферлатум Фол [8, 24, 25].
Кроме того, по мнению многих исследователей, данный препарат, относясь к III поколению органических ПЖ, обладает более высокой усвояемостью и лучшей переносимостью, чем неорганические соли железа I поколения [25]. Назначение Ферлатум Фол соответствует клиническим рекомендациям Министерства здравоохранения РФ «Железодефицитная анемия» (2021) [26].
Цель исследования: оценка уровня и частоты железодефицита у беременных женщин в начальный период гестации путем изучения показателей СФ и анализ терапевтической эффективности применения, клинической переносимости и безопасности препарата на основе железа протеин сукцинилата и фолиновой кислоты у пациенток данной группы в сравнении с известными, использующимися в повседневной практике препаратами железа для лечения ферродефицитных состояний.
Материалы и методы
В открытом наблюдательном проспективном неинтервенционном исследовании, проведенном в 2 этапа, участвовали 524 женщины – жительницы Московского региона, состоявшие на учете по беременности в клинике «ВитроКлиник» в период с 2017 по 2022 гг.
Диагноз ЖДС устанавливался на основании клинико-лабораторных показателей и в соответствии с клиническими рекомендациями «Железодефицитная анемия» (2021) [26].
Пациентки включались в исследование после диагностики ЖДС и принятия лечащим врачом решения о проведении курса терапии гипосидероза.
Критериями включения служили: срок гестации до 20 недель; диагноз «E61.1 Недостаточность железа (Латентный дефицит железа)»/«D50 Железодефицитная анемия» по МКБ-10, назначение Ферлатум Фол и иных ПЖ в соответствии со стандартной клинической практикой.
Критериями невключения в исследование являлись: гиперчувствительность к компонентам препарата на основе железа протеин сукцинилата и фолиновой кислоты; наличие патогенетических вариантов анемического синдрома (нежелезодефицитные анемии), при которых назначение данного препарата было нецелесообразно.
Перед началом терапии все пациентки дали добровольное информированное согласие на предложенное лечение, проведение обследования в контрольные дни визитов и обработку их персональных данных.
Исследование проведено в соответствии с этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации [27], основными положениями Руководства по надлежащей клинической практике Международной конференции по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком (ICH GCP E6 (R2), 2016) [28], и другими применимыми в РФ нормативными документами [29].
Одобрение протокола исследования было получено от Этического комитета при медицинском институте ФГБОУ ВО ТулГУ.
На первом этапе всем пациенткам, вошедшим в исследование, в целях выявления дефицита железа кроме общеклинического исследования крови, включающего оценку концентрации гемоглобина (HGB/Hb), гематокрита (HCT/Ht), числа эритроцитов (RBC), эритроцитарных индексов (средний объем эритроцита (MCV), среднее содержание гемоглобина (MCH) и среднюю концентрацию гемоглобина (MCHC) в эритроците, ширину распределения эритроцитов по объему – индекс анизоцитоза (RDW)), проводилось измерение СФ. Мы не определяли концентрацию сывороточного железа из-за наличия у него циркадных ритмов – суточных, недельных и сезонных.
На втором этапе исследования при проведении терапии гипосидероза беременные (n=221) с выявленным ферродефицитом были неизбирательно разделены на 2 подгруппы, сопоставимые по возрасту, особенностям анамнеза, сроку беременности и степени выраженности ЖДС по результатам клинико-лабораторного обследования: пациентки в подгруппе изучения (n=112), включавшей 74 женщины с ЛДЖ и 38 женщин с развившейся ЖДА, получали сочетание железа протеин сукцинилата и фолиновой кислоты (Ферлатум Фол); пациентки в подгруппе сравнения (n=109), включавшей 63 и 46 пациенток с ЛДЖ и ЖДА соответственно, получали соли железа (II) – сульфат, фумарат, глюконат.
Ферлатум Фол назначался в соответствии с инструкцией по его медицинскому применению, одобренной Министерством здравоохранения РФ [20]. Для лечения ЛДЖ использовалось внутрь содержимое 1 флакона, эквивалентное 40 мг железа (III), и содержимое контейнера, эквивалентное 0,185 мг фолиновой кислоты, ежесуточно; для лечения ЖДА суточную дозу препарата увеличивали до 2 флаконов. В группе сравнения применялось от 30 до 120 мг элементарного железа в сутки с индивидуальной титрацией в зависимости от степени выраженности железодефицита.
Вышеуказанные лабораторные гематологические показатели оценивались от начала антианемической терапии, спустя 30 дней с начала лечения и при окончании исследования (60 дней терапии).
Оценка запасов железа в организме беременных пациенток в нашем исследовании проводилась методом твердофазного хемилюминесцентного иммуноферментного анализа на анализаторе Siemens Immulite 2000 (США). Референтные значения СФ соответствовали 30–140 мкг/л.
Статистический анализ
Статистическая обработка полученных данных проводилась с помощью программы STATISTICA 10.0 (StatSoft Inc.).
Результаты и обсуждение
В общей когорте беременных женщин (n=524), включенных в работу, средний возраст составил 34,4 (5,6) года. Для 295/524 (56,3%) женщин данная беременность была первой. 65,3% (342/524) пациенток имели высшее образование. 67,9% (356/524) работали, 2,3% (12/524) учились. Большинство женщин, 81,3% (426/524), на момент наступления беременности состояли в браке.
78,1% (409/524) женщин, включенных в исследование, имели те или иные хронические соматические заболевания. Чаще всего выявлялись субклинический гипотиреоз (15,5%, 81/524) и различные заболевания желудочно-кишечного тракта (ЖКТ) (12,8%, 67/524). У 9,9% (52/524) беременных был диагностирован избыточный вес, а у 6,5% (34/524) – ожирение различной степени.
У 7,1% (37/524) пациенток уже при первичном обращении по данным анамнеза и результатам предоставленных выполненных ими ранее лабораторных исследований диагностирована некомпенсированная до беременности хроническая ЖДА, причем 75,7% (28/37) из них по поводу выявленного в прегравидарном периоде гипосидероза продолжали принимать различные ПЖ.
Клинико-лабораторное обследование, включая оценку уровня СФ, у оставшихся 487 беременных пациенток выявило отсутствие изменений в уровне железа только у 35,3% (172/487) женщин, у 42,4% (207/487) отмечено снижение лишь показателей СФ (ЛДЖ), у 22,2% (108/487) обнаружены те или иные лабораторные признаки ЖДА.
221 беременной женщине с гипосидерозом проведено амбулаторное лечение ПЖ с динамическим лабораторным контролем. Наиболее значимым параметром оценки эффективности терапии гипосидероза в нашей работе являлось содержание гемоглобина и СФ в крови через 60 дней приема лекарственных веществ.
При анализе результатов полученных данных (таблица) исходный уровень СФ до начала первичной антианемической терапии в исследуемой подгруппе пациенток равнялся в среднем 17,2 (6,0) мкг/л, в подгруппе сравнения – 18,7 (5,7) мкг/л. С началом лечения уровни СФ в сыворотке быстро увеличивались и оставались в диапазоне референтных значений на протяжении всего исследования, составив после проведенного курса терапии 36,2 (4,5) и 30,1 (2,5) мкг/л соответственно.
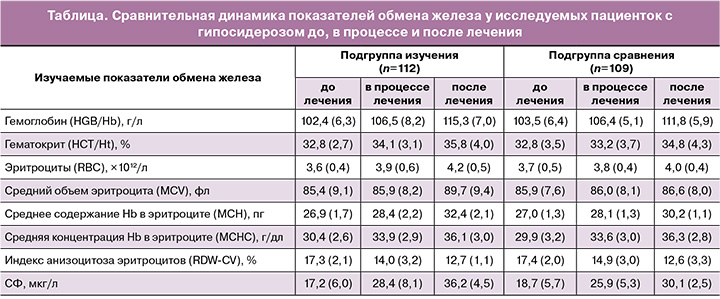
В обеих подгруппах в зависимости от степени тяжести ЖДС в период со дня начала терапии по 30-й день лечения Ферлатум Фол нами наблюдалось сходное увеличение концентрации гемоглобина по сравнению с другими ПЖ.
В нашем исследовании прием беременными препарата на основе комбинации железа протеин сукцинилата и фолиновой кислоты продемонстрировал более значимый терапевтический эффект: средний рост концентрации гемоглобина через 2 месяца приема антианемических лекарственных веществ по сравнению с исходным составил 12,9 г/л у женщин, получавших лечение Ферлатум Фол, относительно 8,3 г/л у женщин, получавших иные ПЖ.
Через 60 дней лечения также отмечено увеличение количества эритроцитов и повышение значений гематокрита относительно исходных величин при указанных двух вариантах медикаментозного лечения (таблица): количество эритроцитов увеличилось с 3,6×1012/л до 4,2×1012/л в подгруппе, получавшей терапию Ферлатум Фол, с 3,7×1012/л до 4,0 – в подгруппе сравнения; гематокрит повысился с 32,8 до 35,8% в группе изучения, с 32,8 до 34,8% – в группе сравнения.
Наши данные подтверждают результаты клинических исследований препарата на основе сочетания железа протеин сукцинилата и фолиновой кислоты, проведенных среди различных групп пациентов, включая беременных женщин, указывающих на связь между приемом Ферлатум Фол и снижением у них проявлений ЖДС.
В 1990 г. Schiassi М. et al. были представлены данные о клинической эффективности и лекарственной переносимости железа протеин сукцинилата, которые были получены при ретроспективном анализе ряда исследований среди 3303 пациентов, получавших Ферлатум в стандартных дозировках в течение 1–2 месяцев. В клинические испытания, в том числе, входили наблюдения за 352 пациентами с уровнем гемоглобина ниже 110 г/л и концентрацией железа в плазме крови менее 40–50 мг/мл, 89% из которых имели клинически развившуюся ЖДА. У всех больных, получавших Ферлатум в течение 30 дней, было отмечено повышение уровня гемоглобина: на 23% – у взрослых, на 13,6% – у женщин с различными гинекологическими заболеваниями и на 12% – у детей. У 126 больных, получавших Ферлатум более длительное время (60 дней), также отмечался стабильный рост уровня гемоглобина на 21,8–23,3% [30].
Juarez-Vazquez J. et al. (2002) осуществили многоцентровое клиническое исследование с участием 371 пациентки в период гестации для сравнительной оценки эффективности приема 80 мг железа протеин сукцинилата с 0,370 мг фолиновой кислоты или без нее при лечении ферродефицита. Итоги работы, опубликованные в British Journal of Obstetrics and Gynecology, демонстрировали положение о том, что терапия указанной комбинацией (в форме Ферлатум Фол) быстрее устраняет проявления ЖДА у беременных женщин в сопоставлении с лечением ПЖ, содержащими только этот микроэлемент. Кроме того, максимальное лечебное действие, не связанное с исходным уровнем фолатов в сыворотке крови, наблюдалось исследователями у пациенток с ЖДА средней и тяжелой степени, что позволило им рекомендовать прием фолиевой кислоты беременным женщинам с ЖДА независимо от концентрации фолиевой кислоты в сыворотке [31].
Итоги рассматриваемых исследований, несмотря на давность их проведения, остаются актуальными до сих пор.
Анализ клинических результатов, осуществленный учеными, включал также оценку переносимости препаратов. Обзор 54 работ с участием 8454 пациентов, представленных в электронных базах данных (PubMed, Cochrane Library), продемонстрировал высокую оценку эффективности и переносимости и самую низкую частоту нежелательных явлений среди пациентов, получавших железа протеин сукцинилат для лечения ЛДЖ и ЖДА, по сравнению с другими оцениваемыми препаратами железа [32].
По данным отчета Schiassi М. et al. (1990), у 3303 пациентов, применявших железа протеин сукцинилат в составе Ферлатум Фол, побочные реакции были зафиксированы лишь в 6,41% случаев [30].
Sallusto A. et al. (1990) в своем анализе сообщили, что лечение препаратами на основе железа протеин сукцинилата хорошо переносилось и вызывало незначительные побочные эффекты, основную часть которых составляли явления желудочно-кишечной непереносимости (диарея, эпигастралгия, тошнота). У железа протеин сукцинилата их частота была существенно ниже по сравнению с другими препаратами (9,4% против 20,4%, р<0,01). При этом только в 39,3% случаев побочных реакций было достоверно установлено наличие связи данных нежелательных проявлений с приемом препарата, тогда как в 29,5% оно было расценено лишь как возможное, а в 15,3% – как маловероятное [33].
Вероятно, такое различие в степени переносимости Ферлатум Фол и препаратов сравнения обусловлено в первую очередь тем, в какой форме железо поступает в слизистую ЖКТ. В экспериментах на крысах, проведенных Urso K. et al. (2021), было показано, что железа протеин сукцинилат и соли двухвалентного железа одинаково эффективны при лечении ЖДА, за 15 дней восстанавливая уровни гемоглобина, гематокрита, эритроцитов, свободного железа и трансферрина. Однако исследование впервые продемонстрировало, что пероральный прием железа протеин сукцинилата не увеличивает уровень гепсидина в сыворотке крови и вызывает минимальное отложение железа в тканях кишечника по сравнению с медикаментами, содержащими свободное железо (II), которые часто вызывают побочные эффекты со стороны ЖКТ [34].
Возможно, именно высвобождение последними ионизированного железа (II) вызывает определенное реактивное раздражение слизистой оболочки ЖКТ, приводящее со временем как к прогрессирующему снижению ее абсорбтивной способности, так и к повышению риска развития гастро-интестинальных побочных реакций.
Напротив, уже упоминавшаяся двойственность физико-химических свойств Ферлатум Фол – нерастворимость в кислой среде и растворимость в щелочной – и определяет его высокую эффективность и лучшую переносимость. Благодаря своему белковому носителю высвобождение ионов железа из данного препарата происходит не в желудке, а в тонком кишечнике, что практически исключает раздражающее воздействие солей железа на слизистую оболочку желудка и объясняет минимальное присутствие при приеме Ферлатум Фол диспепсических побочных реакций, характерных для большинства других ПЖ (болей и жжения в эпигастральной области, отрыжки и «металлического» привкуса во рту).
Можно предположить, что именно поэтому частота отказа от лечения в связи с развитием побочных реакций для Ферлатум Фол, в сравнении с другими ПЖ, крайне невелика. По данным Sallusto A. et al. (1990), в 3303 проанализированных клинических случаях лишь 2,4% больных прервали антианемическое лечение препаратом. Причем большинство побочных реакций были умеренной или даже слабой интенсивности, исключая тем самым наличие однозначной связи между развитием нежелательных реакций и отказом от терапии [33].
Анализ результатов нашей работы также продемонстрировал хорошую клиническую переносимость Ферлатум Фол. Субъективная оценка клинической переносимости в нашей работе достигалась путем наблюдения за возможными побочными реакциями пациентов в обеих подгруппах в течение периода терапии ЖДС и проведения опросов беременных. На фоне приема комбинированного препарата на основе железа протеин сукцинилата и фолиновой кислоты частота встречаемости побочных эффектов была значительно ниже, чем на фоне приема других ПЖ. В целом нами были зарегистрированы 24 нежелательные лекарственные реакции у 19/221 (8,6%) пациенток: о 8 нежелательных реакциях сообщили 7/112 беременных из подгруппы изучения, получавших исследуемый препарат; о 16 нежелательных реакциях информировали 12/109 пациенток из подгруппы сравнения. Только 6,3% беременных, принимавших Ферлатум Фол, указали на наличие побочных реакций, а лечение препаратами с двухвалентным железом вызывало побочные реакции в 11,1% случаев.
В обеих подгруппах женщины предъявляли жалобы, обусловленные возможным воздействием лекарственных средств на ЖКТ: на тошноту/рвоту, боли в эпигастральной области или в животе, запор или диарею. Из них ни одна из зарегистрированных нежелательных реакций не потребовала курсового амбулаторного лечения или госпитализации.
В процессе работы от женщин, участвовавших в исследовании, мы не получили информации о нежелательных реакциях, не указанных ранее в инструкции по медицинскому применению Ферлатум Фол, которые можно было бы связать с приемом данного препарата. Также препарат не был отменен ни у одной пациентки по причине его плохой переносимости.
Ферлатум Фол продемонстрировал быструю и эффективную коррекцию ЖДС при хорошей переносимости и комплаентности с дополнительными преимуществами в виде улучшения жизненной активности и социального функционирования.
Заключение
Таким образом, по нашим данным, уже в начале периода гестации ЖДС выявлены у 352/524 (67,2%) женщин, причем у половины из них в виде ЛДЖ, выявляемого лишь при дополнительном определении уровня СФ.
Клинические результаты нашего исследования подтверждают, что медикаментозная комбинация железа и фолатов (Ферлатум Фол) высокоэффективна при назначении внутрь для быстрой коррекции гипосидероза у беременных женщин. При этом препарат обладает высоким профилем безопасности, хорошей переносимостью и крайне низкой частотой побочных эффектов.



