Общепризнано, что гормональная контрацепция оказывает благоприятное влияние на здоровье женщин, обеспечивает выраженное терапевтическое воздействие при фиброзно-кистозной мастопатии, различных нарушениях менструальной функции, гиперпластических процессах эндометрия и др. [1]. Наибольшей популярностью пользуются комбинированные оральные контрацептивы (КОК), содержащие низкие дозы эстрогена и прогестерона. Кроме доказанного контрацептивного действия, они имеют широкое признание как средства, оказывающие благоприятное воздействие на менструальный цикл, делая менструальные кровотечения регулярными и менее интенсивными, а также устраняя симптомы дисменореи [1, 2]. Однако многие женщины, которым необходима контрацепция, прекращают прием оральных контрацептивов по причине возникновения побочных эффектов и плохой переносимости (например, нерегулярные межменструальные кровотечения, тошнота, головные боли и симптомы, связанные с задержкой жидкости, такие как мастодиния, вздутие и отечность) [3, 4]. В связи с этим проводимые в настоящее время исследования гормональных контрацептивов посвящены сохранению эффективности одновременно с повышением удобства их применения и улучшением переносимости.
Дроспиренон (ДРСП) – гестаген 4-го поколения, обладающий особыми, уникальными свойствами, является производным спиронолактона, фармакологический профиль которого наиболее близок к профилю натурального прогестерона по сравнению с другими прогестинами [4]. В отличие от других гестагенов, он обладает антиминералкортикоидными свойствами, характерными для эндогенного прогестерона. ДРСП противодействует вызванной эстрогенами стимуляции ренин-ангиотензин-альдостероновой системы (РААС), активация которой может привести к задержке натрия и жидкости и таким симптомам, как болезненность молочных желез и отечность.
Клинические исследования КОК, имеющего в составе 30 мкг этинилэстрадиола и 3 мг ДРСП, продемонстрировали, что препарат обладает надежным контрацептивным эффектом и хорошими показателями безопасности, а также уменьшает симптомы, связанные с задержкой жидкости [5–7]. Отмечено, что доза ДРСП 3 мг эквивалентна 25 мг спиронолактона. ДРСП по своим фармакологическим свойствам максимально напоминает натуральный прогестерон, однако антиандрогенные свойства ДРСП выше; также сродство дроспиренона к минералокортикоидным рецепторам в 2–4 раза выше, чем у прогестерона. За счет антиандрогенной активности ДРСП проявляется его терапевтическое влияние на акне и улучшение состояния кожи [8–10]. На основе ДРСП был разработан и создан новый контрацептив, содержащий 20 мкг этинилэстрадиола и 3 мг ДРСП.
Препарат предназначен для перорального одноразового ежедневного приема в течение 24 дней (активные таблетки) с последующим четырехдневным безгормональным интервалом (таблетки плацебо) – в режиме 24+4. Удлиненная схема приема контрацептива и сокращенный безгормональный интервал комбинации этинилэстрадиола и ДРСП снижают частоту возникновения симптомов отмены гормонов, таких как отечность, головные боли, нагрубание и болезненность молочных желез [11–14]. Эти симптомы чаще всего беспокоят женщин именно во время семидневного безгормонального интервала, а не во время периода приема активных таблеток [15–17]. Более того, сокращение безгормонального интервала приводит к более выраженному подавлению функции яичников [18], что должно увеличивать эффективность данного метода контрацепции.
Целью исследования стало изучение контроля менструального цикла, эффективности и безопасности микродозированного монофазного КОК, содержащего 20 мкг этинилэстрадиола и 3 мг ДРСП (режим 24/4).
Материал и методы исследования
В исследование были включены 40 здоровых, сексуально активных женщин 18–45 лет (средний возраст — 26,03±1,26 года), принимавших КОК с 3 мг ДРСП/20 мкг этинилэстрадиола в режиме 24/4 (n=41) (димиа) с целью контрацепции на протяжении 6 циклов и более.
Критерии включения: здоровые женщины, нуждающиеся в контрацепции.
Критерии исключения:
- тромбозы (артериальные и венозные) и тромбоэмболии в настоящее время или в анамнезе (в том числе тромбоз, тромбофлебит глубоких вен; тромбоэмболия легочной артерии, инфаркт миокарда, инсульт, цереброваскулярные нарушения);
- состояния, предшествующие тромбозу (в том числе транзиторные ишемические атаки, стенокардия) в настоящее время или в анамнезе;
- множественные или выраженные факторы риска венозного или артериального тромбоза, в том числе осложненные поражения клапанного аппарата сердца, фибрилляция предсердий, заболевания сосудов головного мозга или коронарных артерий; неконтролируемая артериальная гипертензия, объемное хирургическое вмешательство с длительной иммобилизацией, курение в возрасте старше 35 лет, ожирение с индексом массы тела >30 кг/м2;
- наследственная или приобретенная предрасположенность к венозному или артериальному тромбозу, например, резистентность к активированному протеину С, дефицит антитромбина III,
- дефицит протеина С, дефицит протеина S, гипергомоцистеинемия и антитела против фосфолипидов (наличие антител к фосфолипидам – антитела к кардиолипину, волчаночный антикоагулянт);
- панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе;
- существующее тяжелое заболевание печени (или в анамнезе) при условии, что функция печени и в настоящее время не нормализована;
- тяжелая хроническая или острая почечная недостаточность;
- опухоль печени (доброкачественная или злокачественная) в настоящее время или в анамнезе;
- гормонозависимые злокачественные новообразования половых органов или молочной железы в настоящее время или в анамнезе;
- кровотечение из влагалища неясного генеза;
- мигрень с очаговыми неврологическими симптомами в анамнезе;
- дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция, недостаточность лактазы lapp (лактазная недостаточность у некоторых народностей Севера);
- беременность и подозрение на нее;
- период лактации;
- повышенная чувствительность к препарату или любому из компонентов препарата.
Всех участниц исследования проинструктировали о правильном ведении дневника менструальных кровотечений, в который вносили информацию о каждом цикле.

Методы исследования:
- ультразвуковое исследование органов малого таза;
- диагностическое выскабливание полости матки (по показаниям), аспирационная биопсия эндометрия;
- полимеразная цепная реакция;
- исследование клинического и биохимического анализа крови, коагулограмма;
- гормональное исследование (ФСГ, ЛГ, эстрадиол, прогестерон);
- определение индекса массы тела (ИМТ);
- определение гирсутного числа по шкале Ферримана–Голлвея;
- оценка состояния кожных покровов, наличие угревой сыпи;
- измерение артериального давления;
- обследование молочных желез (по показаниям);
- изучение РАР-мазков (по показаниям).
Все женщины обследуемой группы в процессе диспансерного наблюдения до начала лечения и через три месяца приема димиа заполняли специально разработанную анкету «Оценка состояния Вашего здоровья».
Результаты исследования
Среди обследованных пациенток избыточная масса тела выявлена у 8 женщин (20%), ИМТ в этой группе составил 26,5±0,92 кг/м². Гирсутное число 19–12 баллов определялось у 12 женщин (30%), свыше 12 баллов – у 15% (6 женщин). Таким образом, показатели гирсутного числа были повышены в 45% случаев (у 18 женщин).
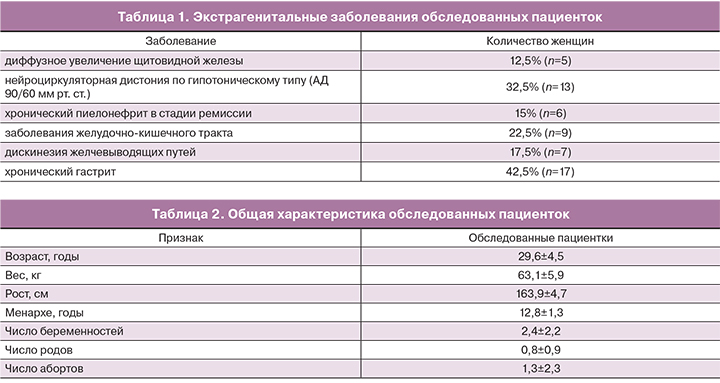
У 65% женщин (n=26) выявлена экстрагенитальная патология, не являющаяся противопоказанием для назначения димии (табл. 1).
Данные акушерского и гинекологического анамнеза у женщин обследуемой группы представлены в табл. 2 и 3.
По результатам динамического клинико-лабораторного обследования (табл. 4) достоверной разницы между соответствующими биохимическими показателями крови до и после приема КОК получено не было.
Женщины строго соблюдали режим проведения исследования: забыли принять одну или более таблеток только 2 (5%) женщины. Варьирование времени приема в пределах 1–2 часов на конечный результат не повлияло.
На фоне приема димии (диапазон приема ежедневной дозы ±1–2 часа) ни одного случая наступления беременности не зарегистрировано. В целом нормально протекали 99,1% циклов (122 цикла), мажущие кровянистые выделения были отмечены у 1 пациентки (2,5%) в течение двух циклов. Получены данные, свидетельствующие об улучшении эмоционального состояния у пациенток с предменструальным синдромом (p<0,05) и о положительной динамике болевого синдрома у пациенток с дисменорей (p<0,001). В течение первых 2 месяцев приема препарата у 20% (n=8) пациенток отмечено наличие адаптационных эффектов. Их спектр и динамика проявлений представлены в табл. 5.
Таким образом, наиболее часто сопровождают прием димии в обследуемой группе мастодиния и мажущие кровянистые выделения в течение 2 месяцев приема.

Через 3 месяца приема количество адаптационных эффектов снизилось до 5% (2 пациентки) (p<0,001). Никто из исследуемых пациенток не прекратил прием препарата досрочно.
Также нами оценивалась продолжительность и интенсивность менструально-подобной реакции (МПР).
Средняя продолжительность менструации до начала приема димии составила 4,72±0,65 дня. Средняя продолжительность МПР через 3 месяца приема димии достоверно снизилась по сравнению с менструацией до начала приема препарата и составила 3,35±0,52 дня, а через 6 месяцев – 3,31±0,64 дня (табл. 6).
Продолжительность МПР через 3 месяца приема димии по сравнению с менструацией до начала приема препарата уменьшилась у 37 из 40 пациенток (92,5%), а через 6 месяцев – у 39 из 40 пациенток (97,5%).
Интенсивность МПР уменьшилась (по субъективным оценкам) через 3 месяца приема димии у 38 из 40 пациенток (95%), а через 6 месяцев – у всех 40 пациенток (100%).
Выявленное уменьшение продолжительности и интенсивности МПР пациентки отметили как положительный эффект приема димии, благоприятно влияющий на общее самочувствие.
У всех женщин, принимавших 3 мг ДРСП/20 мкг этинилэстрадиола в режиме 24/4, наблюдалось значительное уменьшение симптомов предменструального синдрома и улучшение состояния кожи по сравнению с началом приема. Межменструальные кровотечения проявлялись только в первые два месяца приема препарата (период адаптации) у 1 (2,5%) пациентки.
Среди участниц всей анализируемой группы 90% (n=36) женщин были полностью удовлетворены приемом препарата. 92,5% (n=37) испытуемых сообщили, что их физическое и/или эмоциональное состояние улучшилось, либо осталось таким, каким было до начала приема препарата. Кроме этого, 92,5% (n=37) женщин сообщили, что будут продолжать прием исследуемого препарата.
Обсуждение
Результаты данного исследования продемонстрировали, что КОК, содержащий 20 мкг этинилэстрадиола и 3 мг ДРСП, принимаемый ежедневно один раз в день в течение 24 дней с последующим четырехдневным безгормональным интервалом (димиа), представляет собой высокоэффективный метод контрацепции с благоприятным контролем цикла и хорошей переносимостью. В течение 123 циклов лечения не было зарегистрировано ни одной беременности.
Продленная схема приема и сокращенный безгормональный интервал контрацептива, содержащего 20 мкг этинилэстрадиола и 3 мг ДРСП, обеспечивает хорошую переносимость и благоприятный контроль цикла. Ни одна пациентка не прекратила прием исследуемого препарата. Только у одной пациентки отмечались нерегулярные кровянистые выделения в период адаптации. Приемлемость препарата значительно выше, чем у КОК, содержащих 20 мкг этинилэстрадиола/1 мг норэтиндрона ацетата – 13% прекративших прием; 20 мкг этинилэстрадиола/150 мкг дезогестрела – 6% прекративших прием [17, 19].
Вышеописанные результаты подтверждают, что использование комбинации 20 мкг этинилэстрадиола и 3 мг ДРСП в режиме 24+4 (димиа) отличается отличной переносимостью, высокими показателями безопасности и приемлемости.
Заключение
Комбинация 20 мкг этинилэстрадиола и 3 мг ДРСП (димиа), принимаемая ежедневно в течение 24 дней с последующим четырехдневным безгормональным интервалом (режим 24+4), обеспечивает эффективную контрацепцию и благоприятный контроль цикла.



