«Проблемный» эндометрий – термин, нечасто употребляемый в современной литературе. Чаще используются другие определения – «тонкий», «несостоятельный», «гипопластичный» или «атрофичный» эндометрий. Зачастую фигурирует просто диагноз «хронический эндометрит» отдельно, или в сочетании с синдромом Ашермана [1, 2].
Так или иначе, все упомянутые определения характеризуются как анатомическими изменениями полости матки в виде истонченного или неравномерно утолщенного эндометрия, пристеночного субтотального, тотального фиброза или отдельных синехий, так и морфофункциональными нарушениями эндометрия [3].
Все перечисленные изменения характеризуются полным или частичным отсутствием условий для имплантации плодного яйца. Полное отсутствие условий для имплантации клинически означает бесплодие в циклах естественного зачатия и при применении вспомогательных репродуктивных технологий (ВРТ), а частичное заканчивается, как правило, неразвивающейся беременностью на ранних сроках гестации [4]. Совокупность упомянутых морфофункциональных изменений и диагнозов с точки зрения специалистов, ищущих причину ненаступления беременности, особенно в программах ВРТ, формирует понятие «проблемный» эндометрий, поскольку предполагается, что все возможные посторонние препятствия для имплантации при переносе эмбриона исключены [5].
Классические методы исследования эндометрия для женщин с бесплодием или привычным невынашиванием беременности хорошо известны: ультразвуковое исследование (УЗИ), допплерометрия, гистероскопия, биопсия эндометрия, морфологическое и иммуногистохимическое исследование. Традиционно они используются во всех клиниках репродуктивного здоровья и акушерско-гинекологических стационарах [1].
Известные неинвазивные методы диагностики состояния эндометрия –гистероскопия, УЗИ, допплерометрия – не всегда отражают прецизионные патоморфологические и патофизиологические механизмы, определяющие состояние слизистой оболочки матки: оксигенацию, пролиферативную активность на момент исследования, структурированность, микроциркуляцию и метаболизм. А морфологические исследования биоптата эндометрия производятся на «мертвом» биологическом материале, извлеченном из организма, и не могут в полной мере отразить прижизненные структурные и функциональные особенности эндометрия. Несмотря на это, по-прежнему главными критериями готовности эндометрия к имплантации (переносу эмбриона) являются величина М-эхо, состояние гемодинамики при допплерометрии [6].
Многолетние наши наблюдения позволили обнаружить все вышеописанные недостатки классических методов исследования и вынести альтернативное мнение по диагностике «проблемного» эндометрия с использованием «оптической биопсии» [7, 8].
В течение последних 11 лет для определения морфологического и функционального состояния эндометрия мы применяли мультимодальный подход и использовали комбинацию методов оптической спектроскопии, а именно спектроскопию отражения белого света, фотолюминесцентную спектроскопию и Рамановскую спектроскопию. В связи с быстрым развитием лазерных технологий, фототехники и программных алгоритмов обработки данных в последние годы методы оптической спектроскопии начали стремительно развиваться и использоваться в качестве медицинских приложений для диагностики онкологических заболеваний [9], идентификации микроорганизмов и вирусов [10, 11], определения функционального состояния тканей [12].
Предлагаемый мультимодальный подход позволил в режиме реального времени (за 10–15 секунд) без забора биоптата, не повреждая эпителиальных тканей, определить основные параметры жизнедеятельности эндометрия в строгом соответствии с днем менструального цикла – насыщенность тканей эндометрия кислородом (оксигенацию), пролиферативную активность эпителиальных и стромальных клеток эндометрия, уровень микроциркуляции в тканях, структурированность эндометрия в различных отделах полости матки и интенсивность метаболизма.
Целью нашего исследования явилось повышение эффективности диагностики и лечения бесплодия, обусловленного патологией эндометрия, как в циклах естественной фертильности, так и программах ВРТ.
Материалы и методы
За время исследования было обследовано свыше 5200 женщин разного возраста от 24 до 56 лет. Для оценки эффективности разработанной технологии диагностики морфологического и функционального состояния эндометрия с использованием программно-аппаратного оптического комплекса были отобраны 428 женщин методом случайной выборки. Все пациентки обращались в клинику репродуктивного здоровья «Арт-Эко» с жалобой на отсутствие беременности в течение последних 3–6 лет регулярной половой жизни с мотивацией на беременность и желанием вступить в программу ВРТ. Группу сравнения составили 21 условно здоровые женщины в возрасте от 25 до 40 лет, обратившиеся в клинику с целью консультации по альтернативным вопросам.
Все женщины были обследованы согласно приказу Минздрава РФ от 30 августа 2012 г. № 107н.
Методы исследования включали УЗИ, допплерометрию, микробиологическое исследование и полимеразную цепную реакцию, исследование гемостаза, гистероскопию, морфологическое и иммуногистохимическое исследование биоптата или соскоба эндометрия, генетическое и гормональное динамическое исследования, а также оптическую спектроскопию эндометрия.
Были обследованы 449 пациенток в возрасте от 28 до 52 лет. Средний возраст женщин составил 42 года. Все пациентки были условно разделены на 3 группы (таблица). Процентное соотношение результатов исследования производилось без учета пациенток группы сравнения. Первая – 66 женщин (15,4%) в возрасте до 38 лет с преждевременной недостаточностью яичников (ПНЯ), участвовавших ранее в программах ЭКО. Из этой группы 77,3% женщин (подгруппа IА – 51 женщина) ранее перенесли оперативные вмешательства на яичниках (резекция яичников по поводу доброкачественных новообразований). У остальных 15 женщин (подгруппа IB – 22,7%) были удалены маточные трубы по поводу трубной беременности, хронического сальпингоофорита и/или гидро- или сактосальпинкса. Характерно, что промежуток времени между удалением маточных труб и прогрессирующим падением овариальной функции (снижение антимюллерова гормона (АМГ) до 0,27±0,09) составил не более 1,5 года. Обнаружена закономерность: чем дольше период от момента удаления маточных труб, тем более выражена прогрессирующая гипофункция яичников. Ни у одной из обследованных 66 пациенток в программе ВРТ беременность не наступила. Количество переносов составило 2–11 (4,3±0,7). Максимальное количество неэффективных переносов эмбрионов составило 16 и 18 у двух пациенток.

Вторая группа состояла из 362 женщин (84,6%). Средний возраст женщин данной группы составил 44±1,4 года. Первичное бесплодие имело место у 127 (35%) – подгруппа IIA и вторичное у 235 (65%) – подгруппа IIВ. В анамнезе подгруппы IIA указаний на наличие факторов, способствующих гипофункции эндометрия вследствие воспалительных процессов, использования гормональных препаратов, не обнаружено, поскольку большинство из них не имели регулярной половой жизни. Единственными факторами, который можно было рассматривать в качестве способствующего снижению функциональной активности и нарушению циклической трансформации эндометрия, были возраст и овариальная гипофункция, которая приводит к эндометриальной дисфункции.
В подгруппе IIВ у 72 пациенток (30,6%) были аборты в анамнезе в возрасте 18–20 лет, у 12 (5,1%) из них проводились повторные выскабливания в связи с остатками плодного яйца, у 6 (2,6%) были поздние прерывания беременности на сроке 17–20 недель с последующими выскабливаниями на фоне острого эндометрита, у 12 (5,1%) в послеродовом периоде имели место кровотечения, связанные с задержками частей плаценты и выскабливания в раннем послеродовом периоде на фоне острого эндометрита. Таким образом, наблюдается неоспоримая связь между воспалением – хроническим эндометритом и последующим нарушением структурной и функциональной деятельности эндометрия [13].
Другим фактором, который, на наш взгляд, повлиял на структурное и функциональное состояние эндометрия, явилось длительное, порой с трудом поддающееся объяснению и осмыслению назначение гормональных препаратов, таких как комбинированные оральные контрацептивы либо прогестины в больших дозах во II фазу менструального цикла, либо «безумные» дозы эстрогенов – до 10 мг препарата «Прогинова» и 10,0 г препарата «Дивигель» одновременно. Таких женщин в подгруппе было 18 из 72 (25%). При этом при зрелых функционирующих яичниках обсуждается вопрос: почему же не «растет» эндометрий!? [14].
Оптическая спектральная диагностика состояния эндометрия
Изначально оптическая спектрометрия in vivo производилась на световодном люминесцентном спектрометре ЛЭСА-01-«Биоспек» (производитель ЗАО «БИОСПЕК», Россия), а в последние годы наших исследований – на более современном и информативном световодном раман-люминесцентном спектрометре «ФОТОН-БИО» с дополнительным блоком излучения белого света (производитель ООО «ФОТОН-БИО», Россия). Длина волны возбуждающего зеленого лазерного излучения составляла 532 нм (выходная мощность 20 мВт), красного лазерного излучения – 637 нм (выходная мощность 20 мВт). Кроме того, спектрометр был оснащен оптическим модулем белого света. Спектральный диапазон данного оптического спектрометра составлял 160–4000 см-1 (относительно длины волны 532 нм), а спектральное разрешение в коротковолновой спектральной области составляло 4 см-1. При диагностике использовались одноразовые стерильные оптически-прозрачные световодные насадки, которые обеспечивали асептический контакт спектрометра и пациента и защищали оптический световодный инструмент от загрязнений, тем самым обеспечивая воспроизводимые результаты измерений.
Для работы и управления прибором использовалась программа PHOTON-BIO (рис. 1), основными функциями которой являются: поверка всех оптических модулей и световодных частей прибора; проведение диагностики (спектроскопии отражения белого света, фотолюминесцентной спектроскопии и рамановской спектроскопии) состояния эндометрия; создание и хранение базы данных пациентов; хранение амплитудно-спектральных характеристик тканей эндометрия; вычисление индексов насыщенности тканей эндометрия кислородом, микроциркуляции, пролиферативной активности, структурированности, антиоксидантной защиты и метаболизма.
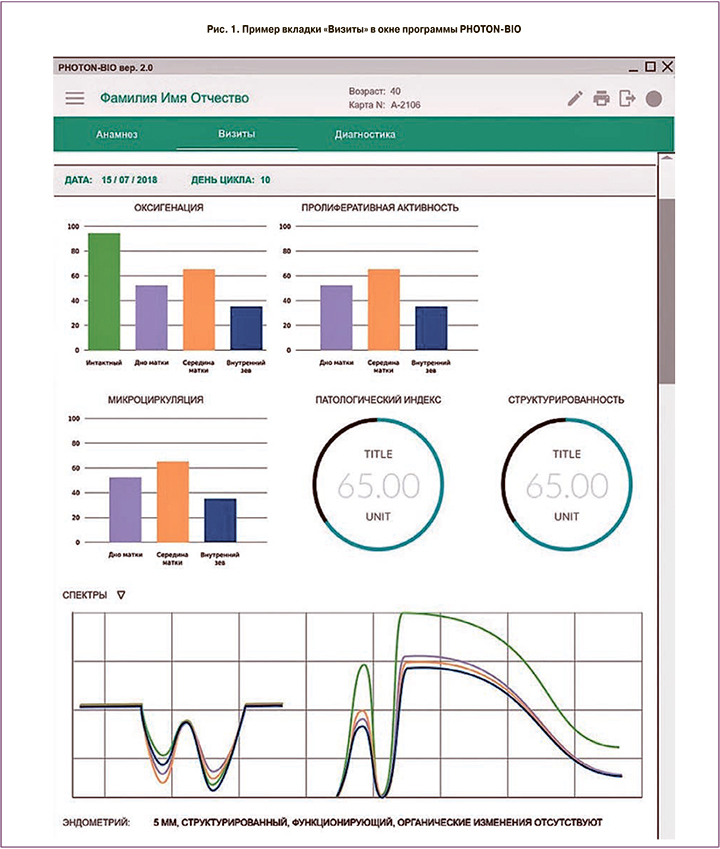
Методы
Специальным методом лечения являлась технология лазерной внутриматочной фототерапии, основанная на использовании природных фотосенсибилизаторов, содержащих производные хлорофилла b (хлорофиллины), и последующее внутриматочное лазерное облучение эндометрия излучением с длиной волны 637 нм, соответствующей пику поглощения хлорофилла b в красной области спектра [15].
Статистическая обработка результатов исследования проводилась с использованием программ SPSS Statistics v.21, Statistics v. 10, электронных таблиц MS Exсel (США) с соблюдением рекомендаций для медицинских и биологических исследований. Сравнение групп осуществляли критерием Краскела–Уоллиса, корреляционный анализ проводили с помощью метода ранговой корреляции Спирмена (r), за уровень достоверности или статистической значимости принимали p≤0,05.
Результаты
С целью диагностики функционального и структурного состояния эндометрия световодный оптический инструмент с надетой на него стерильной световодной насадкой вводился трансцервикально в полость матки и фиксировался в ее дне. В процессе тракции световода в сторону внутреннего зева производилась запись спектров оптического отклика тканей эндометрия в трех точках – дне полости матки, средней части и в области внутреннего зева. Также производилась запись спектров в интактной точке сравнения – на коже внутренней поверхности бедра пациентки. В ходе проведения диагностики в каждой из четырех точек последовательно производились измерения спектров оптических откликов тканей эндометрия при их возбуждении сначала зеленым лазерным излучением с длиной волны 532 нм, затем красным лазерным излучением с длиной волны 637 нм, в конце – белым светом. В результате взаимодействия лазерного излучения с биологической тканью возникают фотолюминесценция и рамановское рассеяние света, которые регистрировались блоком спектрометра, а в результате взаимодействия белого света и тканей эндометрия регистрировался сигнал отражения белого света. По полученным амплитудно-спектральным особенностям каждого типа оптического отклика тканей программный продукт рассчитывал индексы насыщенности тканей эндометрия кислородом, пролиферативной активности, микроциркуляции, структурированности, антиоксидантной защиты и метаболизма. Они вычислялись следующим образом.
Индекс пролиферативной активности вычислялся в процентах и определялся как интегральная интенсивность спектра фотолюминесценции ткани во всем рабочем спектральном диапазоне при возбуждении лазерным излучением с длиной волны 637 нм, нормированная на интегральную интенсивность спектра фотолюминесценции интактной кожи на внутренней поверхности бедра.
Индекс структурированности отображает степень отличия трех внутриматочных фотолюминесцентных спектров (при возбуждении 637 нм) и вычислялся как интегральная интенсивность максимального спектра, нормированная на сумму модулей разностей интегральных интенсивностей трех пар внутриматочных спектров (вычислялся в относительных единицах).
Сосудисто-кислородный индекс вычисляется в процентах, показывает степень насыщенности тканей эндометрия кислородом и рассчитывается как:
(I514+ I614)/2 - I578,
где I578 – значение интенсивности в спектре отражения белого света в точке 578 нм; I514 и I614 –значения интенсивностей в спектре отражения белого света в точках 514 и 614 нм соответственно. Длина волны 578 нм соответствует пику поглощения окисленного гемоглобина, а длины волн 514 и 614 нм находятся на периферии его поглощения [16].
Индекс микроциркуляции вычислялся в относительных единицах как отношение индекса оксигенации к индексу пролиферативной активности.
Индекс антиоксидантной защиты вычислялся в относительных единицах и определялся как нормированная (на индекс в интактной точке сравнения) интенсивность рамановского рассеяния ткани в точке 1520 см-1 при возбуждении лазерным излучением с длиной волны 532 нм. Рамановский сдвиг 1520 см-1 (рис. 2Б) соответствует суммарному вкладу различных каротиноидов, выполняющих функции антиоксидантов в организме человека.
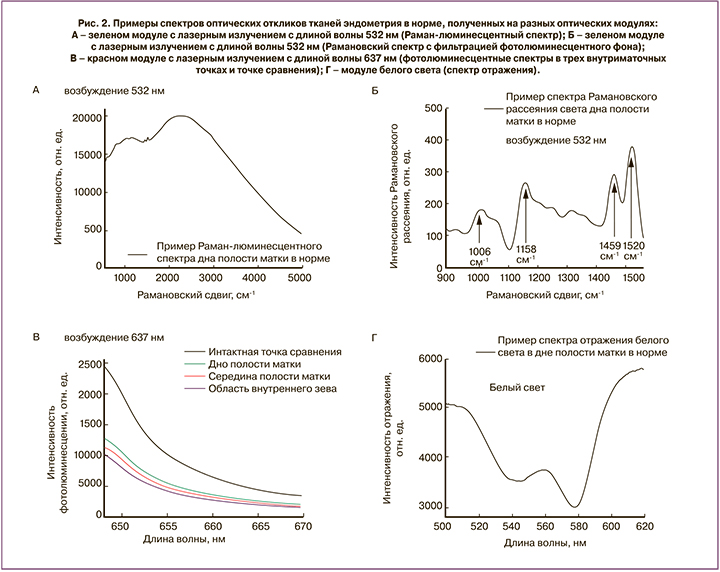
Индекс метаболизма определяет содержание белков, липидов, воды, FADH и порфиринов в тканях эндометрия при регистрации спектров их рамановского рассеяния света и фотолюминесценции при возбуждении лазерным излучением с длиной волны 532 нм. Данный индекс является произведением интенсивностей (рис. 2Б) рамановского рассеяния [17] воды (в точке 3230 см-1), белков (в точке 2937 см-1), липидов (в точке 1459 см-1), интенсивностей фотолюминесценции FADH и порфиринов (в точках 560 нм, соответственно 630 нм) и нормируется на индекс в интактной точке сравнения и вычисляется в процентах.
На рис. 2 приведены примеры оптических спектров тканей эндометрия в норме, полученных в результате работы каждого оптического блока (зеленое лазерное излучение, красное лазерное излучение и белый свет).
Первым важнейшим результатом исследования явилось определение диапазона параметров физиологического функционирующего эндометрия в пределах двухфазного овуляторного менструального цикла у 21 условно здоровой пациентки, подтвержденного динамическим УЗИ и гормональным контролем. Оказалось, что индекс насыщенности тканей кислородом в I фазу менструального цикла (5–7 день) составил 36,5%, во II фазу менструального цикла уровень оксигенации составил 55,1%. Уровень суммарной эпителиальной и стромальной пролиферативной активности эндометрия в I фазу менструального цикла на 6–8 день составил 33,4%, во II фазу на 21–25 день цикла – 53,6%. Таким образом, определяется закономерность в повышении уровня оксигенации и пролиферативной активности клеток эндометрия с максимальной выраженностью к середине фазы секреции, что, по-видимому, связано с обеспечением максимально благоприятных условий для возможной имплантации плодного яйца и возникновения беременности.
Оценка функционального состояния эндометрия в I группе обследованных пациенток с ПНЯ у 51 (77,3%) показала пропорциональную зависимость от степени недостаточности (снижение АМГ ниже 1,5) и в большей степени продолжительности влияния на эндометрий эстрогенной недостаточности (ниже 79 пмоль/л). Мы выявили определенную закономерность: снижение функции яичников при АМГ ниже 1,0 в течение 1 года приводит к снижению оксигенации эндометрия до уровня 8,7 %, независимо от фазы цикла. Пролиферативная активность клеток эндометрия также снижалась до уровня 38,3%. Клинически это проявлялось в виде олигоменореи до 1–1,5 дней скудной менструальной кровопотери и атрофичного или «гипопластичного» эндометрия по данным гистероскопии и УЗИ (М-эхо 5–7 мм), независимо от фазы менструального цикла.
Заслуживает внимание оценка морфологического и функционального состояния эндометрия у женщин, у которых были удалены маточные трубы – 15 женщин. Объективных данных за хронический эндометрит у них не было. Однако по данным лазерной спектроскопии у всех женщин имела место выраженная гипоксия тканей – индекс оксигенации был ниже 10,8% – и снижение пролиферативной активности в различных отделах эндометрия.
Анализ структурно-функциональных изменений пациенток II группы c «тонким» или «не растущим» эндометрием, несмотря на многочисленные лечебные мероприятия (физиотерапия - лазерная и магнитотерапия, оксигенотерапия, гирудотерапия, гормональная терапия, гинекологический массаж и др.), показал, что у всех женщин имела место гипоксия эндометрия разной степени – от резко выраженной, составившей 5–8% в I фазу цикла и 12–15% во II фазу цикла, до 16% и 18%. Ухудшение пролиферативной активности клеток эндометрия в разных отделах полости матки на первых этапах исследования объяснялось, прежде всего, хроническим воспалением. Однако, впоследствии была выявлена определенная закономерность: снижение оксигенации в разных отделах эндометрия на 15–20% вызывало повышение пролиферативной активности (опережение созревания эндометрия на 5–14 дней по отношению ко дню исследования), а повышение уровня гипоксии со снижением уровня содержания кислорода свыше 35–50% приводило к резкому снижению пролиферации, что соответствовало задержке созревания эндометрия во всех фазах до 2 недель и более. Возможно, это может объяснить не наступление беременности при переносе эмбриона.
Отдельное внимание целесообразно уделить женщинам II подгруппы (18 из 72), которые получали массивную гормональную терапию в качестве подготовки к беременности и попытке «усилить» рост эндометрия в погоне за увеличением М-эхо. Результаты исследования показали, что у всех обследуемых (100%) была выявлена резко выраженная гипоксия (уровень насыщения тканей кислородом составил 3,1%) при резко сниженной пролиферативной активности эндометрия, что соответствовало 9,8%. При этом допплерометрическое исследование при УЗИ не определяло кровотоки в базальных, спиральных и аркуатных артериях. У многих наблюдались нарушения кровотока в маточных и яичниковых артериях.
Таким образом, I этап проведенного исследования был посвящен выявлению возможных причин «проблемного» эндометрия, которые препятствуют имплантации и наступлению беременности. Общая закономерность, обнаруженная в процессе обследования эндометрия – это гипоксия различной степени, нарушение пролиферативной активности эндометрия, нарушение структурированности – различные уровни гипоксии и пролиферативной активности клеток в разных отделах эндометрия. Очевидно, что восстановление кровотоков в сосудах, питающих эндометрий в результате различных мероприятий, не является окончательным критерием функциональной его полноценности и готовности к имплантации. Возможно, оксигенация эндометрия играет важную роль в регуляции его структуры и функции.
II этап исследования был посвящен лечению женщин и реабилитации так называемого «проблемного» эндометрия.
Женщинам I и II групп, у которых по данным офисной гистероскопии были обнаружены внутриматочные синехии, была выполнена лазерная абляция сращений и восстановлена анатомия полости матки. Использовались излучения Ho-YAG- и Nd-YAG-лазеров с длиной волны 2,09 мкм и 1,064 мкм.
Примечательно, что послеоперационное спектроскопическое обследование эндометрия не выявило положительной динамики в отношении оксигенации, восстановления пролиферации и метаболизма. Уровень гипоксии и нарушения пролиферативной активности сохранялся. Более того, у женщин с выраженным спаечным процессом, где потребовалась обширное лазерное воздействие, было отмечено повышение уровня гипоксии и более выраженное нарушение пролиферативной активности эндометрия.
Всем женщинам I и II групп с выявленными морфофункциональными нарушениями проводилась фототерапия. Продолжительность перорального приема хлорофиллсодержащих препаратов составила 4–6 недель. Внутриматочное лазерное облучение начиналось спустя 14–20 дней от начала приема препарата в зависимости от степени его накопления в эндометрии, что контролировалось лазерной спектроскопией. Количество сеансов внутриматочного облучения, разовая и суммарная доза определялись индивидуально и зависели от исходного состояния эндометрия – степени гипоксии и ишемии, уровня нарушения пролиферативной активности, структурированности и метаболизма, степени накопления хлорофиллина. В большинстве случаев потребовалось 2–5 сеансов внутриматочного лазерного облучения эндометрия. Оценка морфофункционального состояния эндометрия на фоне реабилитации проводилась не ранее 2–3 недель после окончания внутриматочной лазерной терапии. Этот период времени был определен ранее экспериментальными и клиническими исследованиями [18].
В результате реабилитации и финального исследования установлено, что у женщин I группы уровень насыщения эндометрия кислородом составил 34,8% в I фазу менструального цикла и 38,5% во II фазу цикла, что соответствует референсному значению физиологической нормы. У женщин подгруппы IIА, у которых была «чистая» история или не осложненный гинекологический анамнез, восстановление функционального состояния эндометрия происходило заметно быстрее и активнее. Так, оксигенация значимо увеличилась и составила 43,2 % в I фазу менструального цикла и 46,5% во II фазу цикла. При этом соответствие оксигенации и пролиферации разных отделов эндометрия ко дню менструального цикла было выявлено у 83% женщин. У других 17% пациенток была отмечена не резко выраженная гипоксия и повышенная пролиферативная активность (опережение менструального цикла на 3–5 дней).
Анализ результатов исследования пациенток подгруппы IIB (с вторичным бесплодием, как правило с хроническим эндометритом, синдромом Ашермана и др.), показал, что положительная динамика восстановления структуры и функции эндометрия с точки зрения повышения уровня оксигенации, восстановления пролиферативной активности и структурированности была отмечена у всех наблюдаемых женщин. И это было подтверждено УЗИ, допплерометрией, морфологическим и иммуногистохимическим исследованиями. Однако также было установлено, что динамика и время реабилитационного периода зависят от исходного уровня повреждения и состояния эндометрия – степени последствий воспалительного процесса, состояния сосудистого русла и гемодинамики, нарушения анатомии полости матки и степени дистрофии/атрофии эндометрия. Вместе с тем, у 86,5% пациенток после лечения были отмечены выраженные положительные результаты: уровень оксигенации эндометрия составил 29,4% в I фазу менструального цикла и 32,3% во II фазу цикла, пролиферация и структурированность эндометрия совпадала с днем менструального цикла у 63,3% пациенток.
Заслуживает внимания оценка реабилитации эндометрия у женщин, получавших массивную гормональную терапию. Первоначально у этих пациенток были выявлены резко выраженные функциональные нарушения в виде гипоксии (индексы оксигенации были снижены до 3,6%), пролиферативная активность была резко снижена (10–13%) при норме в I фазу цикла 35–38%. Динамический спектроскопический мониторинг фототерапии показал возможность восстановления структуры и функции эндометрия – восстановление оксигенации (до 35,2%), пролиферативной активности и структурированности у 93% женщин, что было подтверждено УЗИ и допплерометрией.
Заключение
Приведенные данные о лазерной спектральной диагностике патологических состояний эндометрия, препятствующих наступлению и развитию беременности, свидетельствуют о том, что традиционно использующиеся методы диагностики не всегда в полной мере отражают функциональное состояние эндометрия. Видимо, отсутствие информации о функциональном «качестве» и жизнеспособности эндометрия – оксигенации, микроциркуляции, пролиферативной активности, метаболизме ограничивает возможности получения высоких результатов при ВРТ или при традиционном лечении бесплодия. Очевидно, что подобная информация поможет существенно расширить представления о характере патологических процессов в эндометрии и улучшить результаты лечения. Результаты исследования показали высокую эффективность фототерапии в восстановлении структуры и функции эндометрия. Клинические, инструментальные и спектральные методы наблюдения зафиксировали абсолютную результативность и эффективность комплексного подхода к диагностике, лечению, реабилитации и оптической спектральной аналитике лечебного процесса. Финальным результатом оценки обсуждаемой технологии является наступление беременности у 68,4% женщин, ранее прошедших от 2 до 8 неудачных процедур ЭКО и переноса эмбриона.



