На протяжении последних десятилетий среди осложнений беременности, приводящих к перинатальной заболеваемости и смертности, важное место занимает задержка роста плода (ЗРП). Однако, несмотря на большое число проведенных исследований, в настоящее время отсутствуют достаточные знания о биохимических и особенно о молекулярных механизмах его развития, что ограничивает возможности проведения обоснованных терапевтических мероприятий и реальную профилактику данного заболевания [1, 2].
Нормальное течение внутриутробного периода зависит от сбалансированного функционирования системы мать-плацента-плод, важную роль в которой играют околоплодные воды [3]. Способность околоплодных вод быстро реагировать модификацией своего состава, в том числе и холестерина, на все изменения, возникающие в указанной системе, позволяет использовать изучение различных биоактивных компонентов в этой биологической жидкости для получения объективной информации о характере течения гестации и состоянии плода [1]. Известно, что к причинам ЗРП относятся воздействия неблагоприятных факторов в периоды критического развития органов и систем плода [3, 4].
Процесс выживания плода в неблагоприятных условиях зависит от поступления кислорода и других необходимых для его развития элементов. В случае несбалансированного питания матери (клеточный стресс) плод включает один из «оптимальных» вариантов реализации «стратегии выживания» – замедление роста [5]. Одним из главных адаптационных механизмов при действии неблагоприятных факторов является ограничение клеточного деления [5, 6].
Согласно теории «стратегии выживания» основным механизмом адаптации и развития ЗРП является изменение метаболизма холестерина [7]. Известно, что холестерин – основа клеточных мембран. Именно на «холестериновом каркасе» держатся все остальные их компоненты. Он совершенно необходим для деления клеток в качестве строительного материала. Особенно важен холестерин для растущего организма, когда идет интенсивное деление клеток. Синтез холестерина обусловлен генетически, без него организм не мог бы существовать, расти и развиваться [4].
В то же время изменение содержания холестерина липопротеинов высокой (хЛПВП) и низкой плотности (хЛПНП) может также способствовать гипотрофии плода – необходимому условию сохранения его жизнеспособности, согласно теории «внутриутробного программирования» [8]. Большое значение для нормального развития плода имеет баланс структурных компонентов, к числу которых относится холестерин. Поддержанию оптимального уровня последнего при физиологической беременности способствует существование различных путей пополнения его фонда. Прежде всего это кровь матери, а также транспорт из плаценты, который осуществляет α-фетопротеин (АФП) [9].
Основная функция данного белка у эмбриона транспортная, поскольку он обладает высоким сродством к полиненасыщенным жирным кислотам, веществам, необходимым для построения клеточных мембран. АФП избирательно связывает полиненасыщенные жирные кислоты, как в плаценте, так и в крови матери, с последующей транспортировкой их в кровь и клетки эмбриона [1].
В настоящее время установлено, что регуляция холестеринового обмена осуществляется центральной нервной системой. При этом также доказано, что как однократные сильные, так и систематически слабые отрицательные воздействия на нервную систему способны изменить состояние холестеринового обмена [1, 10].
С учетом изложенного, изучение содержания в околоплодных водах, входящих в состав клеточных мембран соединений холестерина, при ЗРП представляется, несомненно, важным.
Цель исследования – определение в околоплодных водах содержания свободного холестерина, хЛПНП и хЛПВП при ЗРП с учетом транспортной функции АФП.
Материал и методы исследования
В исследование были включены 53 роженицы в возрасте 22–32 лет, в сроки беременности 37–40 недель, давшие информированное согласие на расширенный алгоритм обследования. Данные женщины были разделены на 2 группы. Основную группу составили 34 родильницы, у которых беременность осложнилась ЗРП в сроки 28–35 недель. Анализ возрастного состава пациенток этой группы показал, что полученные данные свидетельствуют о паритете возраста между женщинами с гипотрофией плода и контрольной группой. В анамнезе женщин данной группы у 18 имели место инфекционные заболевания (гепатит В – у 2, хламидиоз – у 8, трихомониаз – у 5, хронический тонзиллит – у 5). Наряду с выявленными заболеваниями в процессе гестации имели место вагиниты у 5 (1,7%) женщин, дисбиоз влагалища – у 7 (2,38%). У 7 пациенток наблюдалось длительное бесплодие. При этом первородящие женщины составили основную часть обследованных (n=29; 85,3%). Наряду с этим у 14 данных пациенток предыдущие беременности завершились самопроизвольным абортом в 16–18 недель. При субклинической плацентарной недостаточности у 22 родильниц этой группы имели место осложнения второй половины беременности – преэклампсия у 13 (59,09%), угроза прерывания у 9 (41%). У остальных 12 (35,3%) пациенток ЗРП без фетоплацентарной недостаточности диагностирована при наличии преэклампсии. В процессе гестации ЗРП у 4 женщин наблюдалась с 28 недель, у 14 – с 30 недель, у остальных – с 32 недель. Самопроизвольные роды были у 19 (55,9%), а у 15 (44,1%) – оперативные. Масса тела детей у данных пациенток была в пределах 2050–2610 г (по шкале Апгар 8–9 баллов – у 3; у 27 – 6–7 баллов; у 4 – 5 баллов).
Контрольную группу составили 19 практически здоровых женщин с физиологически протекающей беременностью, завершившейся своевременными родами. Возраст 12 (63,2%) данных женщин соответствовал 24 годам, 5 (26,3%) – 29 годам, 2 (10,5%) – 32 годам. Анамнестические сведения указывают, что из перенесенных заболеваний только у 3 (15,8 %) родильниц отмечены хронические заболевания: тонзиллит, гайморит. В данной группе женщин первородящих было 16 (84,2 %). Масса тела ребенка при рождении достигала 2970–3590 г (по шкале Апгар у 11 – 8–10 баллов; у 8 – 8–9 баллов).
У женщин, находящихся под наблюдением, в околоплодных водах, полученных в первом периоде после их отхождения, определяли холестерин, хЛПНП, хЛПВП с помощью наборов фирмы Randox (Германия) на биохимическом анализаторе Sapphire 400 (Япония).
Статистическая обработка данных осуществлялась с помощью лицензионного пакета программ Statistica 5.1 фирмы Stat Soft. Достоверность различий между сравниваемыми показателями определяли по критерию Стьюдента. Результаты оценивали как статистически значимые при р<0,05.
 Результаты исследования и обсуждение
Результаты исследования и обсуждение
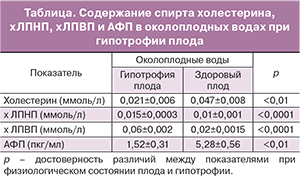
Полученные результаты представлены в таблице, из которой видно, что имеет место резкое снижение в околоплодных водах содержания спирта холестерина (в 2,24 раза) и повышение хЛПНП в 1,5 раза, хЛПВП – в 3 раза, относительно контрольных данных. Концентрация АФП в околоплодных водах в этих условиях также была снижена (в 2 раза).
При беременности АФП играет существенную роль, выполняя транспортную функцию. Его сродство к транспортируемым соединениям в 105 раз выше, чем у альбумина [1]. На первых неделях беременности он вырабатывается в желточном мешке, а с 5 недель плод вырабатывает его сам [5, 11] и с мочой выделяет в амниотическую жидкость, откуда последний попадает в кровь матери для экскреции. Такая взаимосвязь системы плод – околоплодные воды – кровь матери свидетельствует о важной роли АФП в эмбриональном развитии, прежде всего в регуляции роста и дифференцировки тканей плода.
В настоящее время установлено, что регуляция холестеринового обмена, как указывалось выше, осуществляется центральной нервной и эндокринной системами [10]. При этом доказано, что как однократные сильные, так и систематически слабые отрицательные воздействия на нервную систему способны изменить состояние холестеринового обмена [2]. Известны вопросы регуляции центральной нервной системой метаболизма холестерина у плода, которые заключаются в ингибировании нейротрансмиттером γ-аминомасляной кислотой экспрессии мРНК АФП. Последнее обусловливает снижение синтеза АФП, в результате чего резко падает транспорт холестерина к плоду. Другим фактором, участвующим в регуляции метаболизма холестерина, является трийодтиронин, функция которого в данной ситуации заключается в транскрипции мРНК АФП, переключении при осложнениях беременности синтеза АФП на альбумин в процессе развития плода. Увеличение в амниотической жидкости белка транстиретина при ЗРП, осуществляющего транспорт трийодтиронина от матери к плоду, можно предполагать, обусловлено необходимостью обеспечения организма плода трийодтиронином [1]. Последнее свидетельствует о том, что происходит повышение поступления трийодтиронина к плоду, а следовательно, реализуется процесс усиления продукции альбумина. Существование таких процессов при внутриутробном развитии однозначно направлено на снижение поступления холестерина к плоду в этих условиях.
Выявленные изменения содержания в околоплодных водах спирта холестерина, хЛПНП и хЛПВП (выше физиологических величин) позволяют считать адаптивными уровни липидпереносящих молекул и молекул белка, которые участвуют в пассивном поглощении клетками насыщенных и ненасыщенных жирных кислот, и в то же время формируют активное рецепторное поглощение клетками жирных кислот. При этом доказано, что повышение хЛПНП уменьшает жидкостность анулярных фосфолипидов в плазматической мембране клеток, изменяя в ней функцию интегральных белков [8, 11]. Указанные изменения, наряду с особенностями транспорта холестерина АФП, являются фактором, снижающим деление эмбриональных клеток, обусловливающих гипотрофию плода [12–14]. Если ЛПНП выполняют исключительно транспортную функцию для холестерина, доставляя его в периферические клетки для образования мембраны, то ЛПВП (повышенный уровень у наблюдаемых женщин) переносят больше различных компонентов оболочек, что, очевидно, позволяет поддерживать определенный уровень формирования тканей развивающегося плода.
Заключение
Изменение содержания спирта холестерина и хЛПВП и хЛПНП в околоплодных водах, а также метаболизма АФП, обеспечивающего модификацию транспорта спирта холестерина к плоду, является своеобразным механизмом регуляции плодом холестеринового обмена как фактора «стратегии выживания».
Таким образом, выявленные, независимо от характера осложнений процесса гестации, особенности изменения липидных компонентов, играющих ключевую роль во всех клеточных процессах при развитии плода, позволяют контролировать и влиять на определенные этапы эмбриогенеза с целью предупреждения гипотрофии плода.



