В настоящее время программы вспомогательных репродуктивных технологий (ВРТ) широко используются для лечения бесплодия – актуальной проблемы, с которой, по данным ВОЗ, сталкиваются 15–20% женщин репродуктивного возраста. Количество проводимых циклов ВРТ неуклонно растет, однако эффективность реализации программ не достигает желаемого успеха. По данным российской ассоциации репродукции человека (РАРЧ) частота наступления беременности после начатого цикла немногим превышает 30 и 27% в программах ЭКО и ИКСИ соответственно; родами заканчиваются около 20% начатых циклов [1].
Имплантация – процесс, в результате которого происходит прикрепление бластоцисты к эндометрию, внедрение клеток, формирующих в дальнейшем экстраэмбриональные структуры, в эпителий и сосуды матки, и последующее формирование плаценты [2]. Успех имплантации зависит от двух составляющих: качества эмбриона и состояния эндометрия [3]. Данный обзор сфокусирован на цикличности изменения гликома эндометрия, влиянии этих изменений на рецептивность, а также характеристике гликоконъюгатов как позитивных и негативных регуляторов имплантации.
Циклические изменения эндометрия: характеристика эндометриального паттерна и паттерна гликозилирования
В 1950 году Нойсом, Хертингом и Роком впервые были описаны морфологические, гистохимические и функциональные ежедневные изменения эндометрия на протяжении нормального 28-дневного цикла [4]. Также было показано, что циклическая трансформация эндометрия контролируется изменением активности гипоталамо-гипофизарной-яичниковой системы. В менструальном цикле женщины выделяется две фазы: пролиферативная – основным регулятором является эстроген, и следующая за овуляцией секреторная, детерминирующим регулятором которой служит прогестерон [4, 5]. Пролиферативная фаза включает раннюю, среднюю и позднюю стадии. В секреторной фазе выделяют стадии: ранняя постовуляторная фаза (ранняя стадия секреции) — (1–4 или 1–5 дней по данным разных авторов), характеризующаяся инициацией синтеза секреторных продуктов и наличием субнуклеарных вакуолей; средняя стадия секреции – период максимальной рецептивности эндометрия или окно имплантации (ОИ) (5–9-й или 6–10-й дни после овуляции), которую отличает псевдодециадуализация стромальных клеток и развитие эпителиальными клетками специализированных структур – пиноподий, экспрессия молекул клеточной адгезии; поздняя лютеиновая (секреторная) фаза – (10–14-й или 11–14-й дни) – диссоциация клеток эндометриальной стромы, активация апоптоза и отторжение слизистой оболочки матки (рис. 1) [6]. В случае наступления беременности строма эндометрия трансформируется в специализированную децидуальную ткань [7].
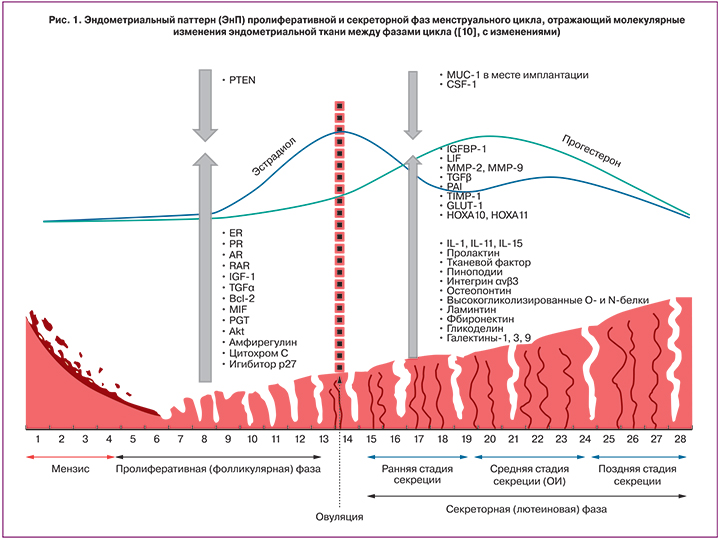
Для описания изменений функционального слоя эндометрия в нормальном цикле, а также при развитии нарушений в англоязычной литературе встречается термин «эндометриальный паттерн» (ЭнП, endometrial pattern), который отражает шаблон или образец визуализации эндометрия, соответствующий определенной фазе (стадии) менструального цикла, описанный с помощью ультразвукового исследования – единственного на сегодняшний день неинвазивного метода оценки эндометрия [8]. Термин «ЭнП», на наш взгляд, позволяет также описывать морфологические, гистохимические изменения эндометриальных клеток и изменения в экспрессии генов и молекулярных маркеров, что позволяет использовать его и в этом контексте. На рис. 1 представлены ЭнП, характеризующие пролиферативную и секреторную фазы менструального цикла и демонстрирующие участие гормональных, генетических и иммунологических факторов в дифференциации эндометрия [9, 10]. Рис. 1 также демонстрирует постовуляторные изменения гликозилирования эндометриальных и секреторных белков, которые мало изучены в репродуктивной медицине, но могут быть важной составляющей ЭнП, поскольку гликаны (углеводы) являются функциональной частью рецепторов, опосредующих межклеточные контакты, адгезию и процессы инвазии [11, 12].
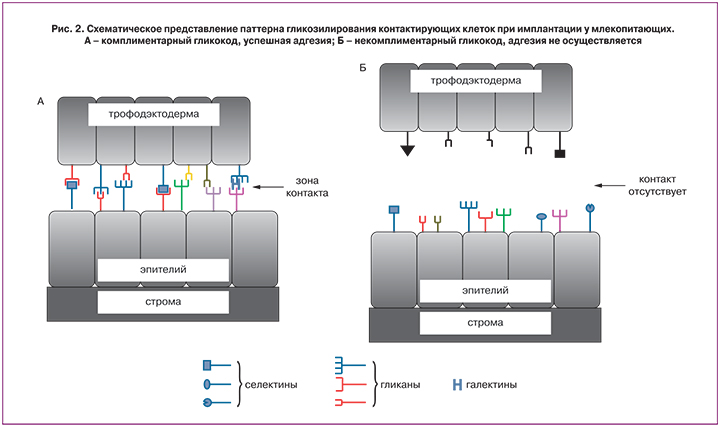
Кроме ЭнП, в литературе используется также термин «паттерн гликозилирования», или гликом, характеризующий совокупность гликанов органа, клетки и растворимых белков биологических жидкостей организма [13, 14]. Особый интерес в настоящее время вызывают данные, основанные на изучении межвидового скрещивания, свидетельствующие, что клетки репродуктивных органов, гаметы и эмбрионы близкородственных видов млекопитающих имеют определенный паттерн (гликотип) гликозилирования [15]. Возможность контакта (оплодотворения, имплантации и плацентации) определяется комплементарностью гликозилированных поверхностей контактирующих клеток, что позволяет предположить наличие углеводного кода (гликокода) [16], значение которого может быть решающим для имплантации и развития беременности (рис. 2). Согласно теории гликокода, молекулярные основы имплантации основаны на углевод-белковом и углевод-углеводном взаимодействиях между клетками эндометрия и бластоцисты [11, 17].
Молекулярные основы углевод-опосредованных взаимодействий при имплантации
Установлено, что молекулярные основы ранних взаимодействий при имплантации аналогичны таковым при воспалении между лейкоцитами и эндотелием и базируются на углевод-опосредованной адгезии [18]. Селективные взаимодействия осуществляются как между гликанами, так и между гликанами и эндогенными лектинами: лектинами С-типа и галектинами, которые широко представлены на иммунных клетках и клетках репродуктивной системы [19, 20]. Доказано, что на поверхности трофэктодермы экспрессируются углевод-связывающие белки: галектины, специфически взаимодействующие с гликанами, которые имеют в составе остатки N-ацетиллактозамина, и селектины, основным лигандом которых является олигосахарид sialyl LeX [18].
Галектин-1 и -3 выявляются на трофэктодерме бластоцисты мыши после хэтчинга, но отсутствуют во внутренней клеточной массе. Известно, что галектины-1 и -3 способны специфически связываться с олигосахаридом Н типа 1, экспрессия которого выявлена на люминальном эпителии эндометрия. Также показано связывание галектинов с адгезивным гликопротеином ламинином, углеводная часть которого представлена сложными N-цепями с терминальными остатками галактозы и лактозамина [21]. У человека показано повышение экспрессии лиганда галектинов, дисахарида Galβ1-3GalNAc (антигена Томсена–Фриденрайха, TF) в раннюю секреторную фазу цикла, с максимумом экспрессии в ОИ; экспрессия галектина-1 выявлена на трофэктодерме бластоцисты свиньи и неоплодотворенных ооцитах человека [22]. Установлено, что в предимплантационный период в трофэктодерме эмбриона человека выявляется L-селектин, а в трофэктодерме мыши – L- и Е-селектины. Экспрессия основного лиганда селектинов – олигосахарида sialyl LeX выявлена как в трофэктодерме мыши, так и в люминальном эпителии человека и мыши, причем максимум экспрессии выявлен в ОИ. Олигосахарид LeY представлен на поверхностях бластоцисты и эндометриального эпителия мыши; у человека – только на люминальном эпителии. Кроме вышеописанных углевод-белковых взаимодействий продемонстрированы углевод-углеводные взаимодействия между олигосахаридом LeY, который входит в состав углеводных цепей гликолипидов бластоцисты и Н типа 1 и Н типа 2 терминированными гликолипидами люминального эпителия [18]. Молекулярные углевод-опосредованные взаимодействия инициируют активацию клеточных сигнальных систем, результатом которой являются межклеточные контакты трофобласт-эндометрий/строма при имплантации и инвазия трофобласта.
Изменения паттерна гликозилирования в менструальном цикле
Многочисленные исследования паттерна гликозилирования эндометрия позволили выявить общую тенденцию, свидетельствующую, что экспрессия высокогликозилированных продуктов повышается в секреторную фазу цикла под воздействием прогестерона. При этом структуры гликанов с терминальными остатками маннозы и лактозамина детектируемые иммуногистохимическими методами с помощью панели моноклональных антител и растительных лектинов с тонкой углеводной специфичностью, конститутивно присутствуют в эндометриальной ткани во всех фазах цикла и повышаются в секретах эндометриальных желез в постовуляторный период [23]. Одновременно отмечается сокращение толщины апикальной части покровного эпителия (гликокаликса) и уменьшение общего отрицательного заряда клеточной поверхности, обусловленного анионными полимерами в структурах эндометрия [24].
Экспрессия терминальных и субтерминальных остатков фукозы и сиаловой кислоты в составе сложных гликанов также подвержена циклической регуляции. Изучение распределения терминальных остатков сиаловой кислоты в тканях матки мышей лектиновой гистохимией показало, что α2,3-связанная сиаловая кислота не выявляется в эпителии в пролиферативную фазу, но высокий уровень обнаруживается в строме. В люминальном эпителии количество α2,3-связанной сиаловой кислоты увеличивается с преимплантационного периода до фазы поздней секреции и зависит от прогестерона. Напротив, уровень α2,6-связанной сиаловой кислоты, максимален в 1-й день после имплантации. Экспрессия в люминальном эпителии мыши гликана Н тип 1, несущего терминальный остаток фукозы, регулируется эстрогеном: максимальный уровень детектируется в овуляцию, но падает до минимума после имплантации. Ингибирование Н тип 1-содержащими гликанами межклеточного взаимодействия в мышиной имплантационной модели in vitro свидетельствует об участии Н тип 1 в прикреплении бластоцисты [25]. У крысы экспрессия двух терминально фукозилированных гликанов – Н тип 1 и Н тип 2 регулируется прогестероном: максимальный уровень гликана Н тип 1 детектируется на 4-5 дни беременности, а гликана Н тип 2 – в рецептивный период и не выявляется после имплантации [26].
Изменение экспрессии α-N-ацетилгалактозамин (α-GalNAc)-содержащих гликанов в составе гликокаликса эндометрия в динамике менструального цикла исследовалось у человека с помощью панели биотинилированных растительных лектинов, специфически связывающих различные вариации терминальных остатков α-GalNAc. Установлено, что у человека экспрессия гликанов, несущих терминальные остатки α-GalNAc и имеющих простую, неразветвленную структуру существенно не меняется во всех исследованных структурах: цитоплазме, железах, люминальном эпителии и гликокаликсе во все фазы цикла. Напротив, экспрессия разветвленного фукозилированного сахарида, который является фрагментом антигена группы крови А (II), и имеет два терминальных заместителя (GalNAcα1,3 и Fucα1,2), отсутствует в пролиферативную и раннюю секреторную фазы цикла, но возрастает в ОИ в гликокаликсе и железах и сохраняется до менструации [27].
Отмечается линейное возрастание экспрессии олигосахарида LeY в эндометриальном эпителии у макак-резус (Macaca mulatta) в пролиферативную, периовуляторную, постовуляторную стадии цикла. Максимум экспрессии гликана выявлен в ОИ, но экспрессия снижается к менструации. При этом в области эндометриальных желез повышение уровня экспрессии отмечено только в ОИ. Экспрессия гликана позитивно регулируется прогестероном и негативно – мефипрестоном [28]. Блокирование экспрессии фермента FUT1 (участвующего в биосинтезе LeY) эпителиальными клетками эндометрия мыши сокращает, а обработка клеток лейкемия-ингибирующим фактором (LIF), напротив, усиливает адгезию мышиной бластоцисты в in vitro модели имплантации [29]. Имеются данные о том, что кроме опосредования межклеточной адгезии при имплантации, гликан LeY может выступать в качестве сигнальной молекулы, модулирующей DAG/PKC сигнальный путь, регулирующий рост, деление и дифференцировку клеток, что также влияет на имплантацию [30].
Изменение паттерна гликозилирования в динамике менструального цикла у человека отражается не только в изменении представленности отдельных функциональных групп гликанов, которые являются составной частью сложных, разветвленных, комплексных структур, но и в изменении экспрессии конкретных высокогликозилированных белков, например, синдеканов. Так, изучение распределения синдеканов – мембранных гепарансульфатпротеогликанов (семейство состоит из четырех членов: синдекан-1, синдекан-2, синдекан-3, синдекан-4) в эндометрии показало, что экспрессия синдеканов-1, 3 и 4 не меняется в зависимости от фазы менструального цикла, а экспрессия синдекана-2 возрастает в периовуляторную фазу цикла и позитивно коррелирует с морфологическими и функциональными изменениями в эндометрии, что предполагает его участие в имплантации бластоцисты [31]. По данным других авторов, экспрессия синдекана-1 значимо возрастает на люминальной поверхности эпителия в ОИ и, напротив, снижается в строме в секреторную фазу, достигая минимума в ОИ [32]. Поскольку синдеканы: опосредуют межклеточные взаимодействия и организацию внеклеточного матрикса; являются лигандами для множества биологически активных молекул (сосудисто-эндотелиальный фактор роста (VEGF), фактор роста фибробластов (bFGF)); способны взаимодействовать с астин-ассоциированными белками, участвуя, таким образом, в проведении внутриклеточных сигналов [31, 32], то их участие в циклическом ремоделировании эндометрия и имплантации может быть недооценено.
Также частью ЭнП окна имплантации являются гиалуроновая кислота (ГК) (высокомолекулярный гликозаминогликан, структурной единицей которого является повторяющийся дисахарид, состоящий из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина) и ее рецептор CD44. Изучение экспрессии ГК и CD44 в динамике менструального цикла у человека показало, что экспрессия ГК выявляется в строме во всех фазах цикла, но имеет пик экспрессии в ОИ; также более интенсивное иммуногистохимическое окрашивание на ГК выявляется в периваскулярной зоне спиральных артерий в секреторной фазе. При выявлении рецептора CD44 было установлено, что в секреторной фазе в эндометриальных железах экспрессируется только CD44v6 – вариабельная форма, а в строме – только CD44s –стандартная. Причем в пролиферативную фазу обе формы рецептора отсутствуют в структурах эндометрия [33].
Значение углевод-опосредованного взаимодействия L-селектин/sialyl LeX при имплантации
Одно из ключевых исследований, посвященных молекулярным основам имплантации, основывающееся на углевод-белковом взаимодействии, было проведено иммуногистохимическим методом с использованием моноклональных антител к углеводным детерминантам, которые являются лигандами L-селектина. Была использована панель антител: МЕСА-79 (эпитоп: SO3→6N-ацетилглюкозамин); НЕСА-452 (углеводный эпитопs sialyl Lex и родственные структуры: 6-sulfo sialyl Lex, 6’-sulfo sialyl Lex и 6’,6-disulfo sialyl Lex); PEN4 (эпитоп кератан сульфат-подобный лактозамин). Установлено, что максимальная экспрессия гликанов, детектируемых указанными антителами, выявлена в период ОИ. Одновременно было показано, что на поверхности бластоцисты после стадии хэтчинга детектируется интенсивное окрашивание антителами против L-селектина; примечательно, что до хэтчинга окрашивание практически не наблюдалось, что свидетельствует об экспрессии L-селектина клетками трофобласта исключительно в предимплантационный период [34].
Изучение дифференциальной экспрессии сульфатированных олигосахаридов – лигандов L-селектина в эндометрии в течение менструального цикла показало, что минимальная экспрессия лигандов выявлена в пролиферативную фазу цикла. В люминальном эпителии эндометрия пик экспрессии сульфоолигосахаридов выявлен в овуляцию и продолжается до поздней стадии секреции. В железистом эпителии максимальная экспрессия лигандов выявлена в ОИ [35].
Установлено, что экспрессия сульфотрансферазы GlcNAc6ST-2 и лигандов L-селектина, детектируемых антителами МЕСА-79 и НЕСА-452, которые являются продуктами активности этого фермента, различна у фертильных и бесплодных женщин в секреторной фазе естественного цикла. Так, уровень экспрессии МЕСА-79 – эпитопа в люминальном эпителии у фертильных женщин был значимо выше, чем у бесплодных. Повышенная экспрессия эпитопов НЕСА-452 в эндометриальных железах выявлялась у пациенток с эндометриозом и синдромом поликистозных яичников. Экспрессия GlcNAc6ST-2 была снижена у пациенток с бесплодием и коррелировала с экспрессией эпитопа МЕСА-79 [36].
В пилотном исследовании установлено, что у пациенток программы ВРТ с использованием длинного протокола с агонистами гонадотропин-рилизинг гормона частота наступления беременности и частота имплантации были выше при высоком уровне экспрессии гликанов – лигандов L-селектина в железах и люминальном эпителии, чем при низком (53,6% против 25,0% и 27,1% против 12,1%, соответственно; р<0,05) [37]. Аналогично, частота наступления беременности у пациенток программы ВРТ с донацией яйцеклетки была выше в случае высокого уровня экспресссии лигандов L-селектина [38]. Изучение прогностической значимости эпитопа МЕСА-79, выявляемого в эндометрии в период ОИ у пациенток с повторными неудачами имплантации, показало, что у пациенток с низким уровнем экспрессии эпитопа МЕСА-79 предсказательная ценность отрицательного результата составляла 100% с чувствительностью 50% и специфичностью 100%, а предсказательная ценность положительного результата у пациенток с высокой экспрессией – 87%. Результаты свидетельствуют о перспективах использования эпитопа МЕСА-79 в качестве маркера рецептивности эндометрия, и указывают на возможности исключения неудачи имплантации в данной группе пациенток [39].
Циклическая регуляция экспрессии муцина MUC1 в эндометрии и его роль в имплантации
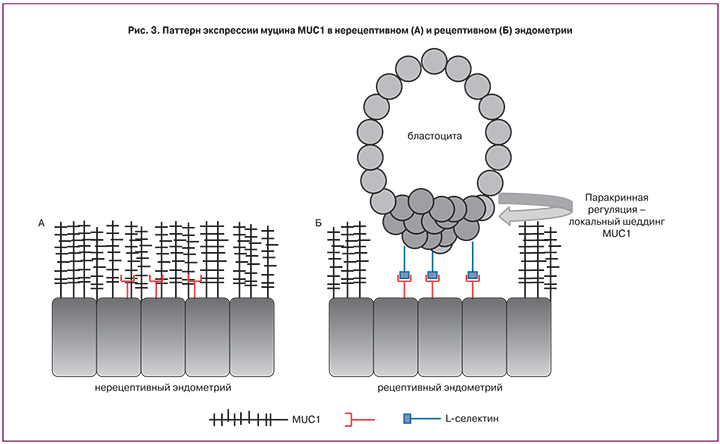
Муцин MUC1 – высокомолекулярный, высокогликозилированный протеин, синтезируемый эпителиальными клетками репродуктивного тракта, является основным компонентом слизи, локализованной в апикальной поверхности клеток и в секретах эндометриальных желез [40]. В настоящее время роль MUC1 в имплантации рассматривается в двух аспектах. Первый, MUC1, возможно, участвует в молекулярном узнавании и контакте бластоцисты с эндометрием, опосредуя стадии аппозиции и адгезии. В пользу этого предположения выступают: факты, свидетельствующие, что экспрессия MUC1 регулируется гормонами [41]; а также данные об идентифицикации в составе углеводной части MUC1 гликанов, участвующих в углевод-белковом взаимодействии. Так, изучение углеводных цепей MUC1 продемонстрировало, что в составе О- и N-связанных гликанов муцина присутствуют гликаны sialyl-Tn, sialyl-LewisX, sialyl-LewisA, кератан-сульфат и антиген Томсена-Фриденрайха (TF-антиген) [22, 40–43], которые являются лигандами для эндогенных лектинов – селектинов и галектинов, и способны опосредовать межклеточные взаимодействия и участвовать в иммунорегуляции [19, 44]. В исследованиях in vitro при сокультивировании первичной культуры эпителиальных клеток эндометрия человека с аутологичной бластоцистой было установлено, что экспрессия MUC1 и mRNA MUC1 увеличивается в рецептивном эндометрии по сравнению с нерецептивным. Также было показано, что на стадии аппозиции MUC1 выявляется, как в эндометриальных клетках, так и в трофэктодерме бластоцисты. Однако на стадии адгезии MUC1 локально удаляется с эндометрия в месте имплантации [41, 45], вероятно, вследствие паракринной регуляции факторами бластоцисты (рис. 3). Этот факт определяет второй аспект роли MUC1 в имплантации – MUC1 может выполнять функцию антиадгезивной молекулы в эндометриальном эпителии. На основании описанных данных, однозначное заключение о роли MUC1 в имплантации пока дать не удается. Обнаруженные различные гликоформы MUC1 у фертильных и бесплодных женщин [22], вероятно, обусловливают также различные функциональные свойства MUC1 [46] и объясняют его двойственную роль в имплантации. Эти разноречивые факты указывают на необходимость дальнейшего изучения роли MUC1 в имплантации.
Заключение
Представленные обобщенные данные свидетельствуют, что гликом эндометриальной ткани, во-первых, значительно модифицируется в зависимости от фазы менструального цикла и его изменения регулируются гормонами; во-вторых, максимальные изменения отмечаются в ОИ; в-третьих, ингибирование углевод-опосредованных взаимодействий, а также экспрессия гликанов с антиадгезивными свойствами негативно регулирует имплантацию, что доказывает одну из ведущих ролей гликанов в рецептивности эндометрия и имплантации.
Рецептивность эндометрия – это период, в течение которого эпителий эндометрия приобретает временный, функциональный, гормонально-зависимый статус, обеспечивающий узнавание бластоцисты и имплантацию. Многочисленные исследования рецептивности эндометрия сфокусированы в основном на белковых маркерах и белок-белковых взаимодействиях при имплантации, оставляя область гликанов малоизученной в этом аспекте, особенно у человека. Однако именно гликокаликс эндометриального эпителия является зоной первичного контакта с трофэктодермой и «молекулярной границей», которую необходимо преодолеть внедряющемуся эмбриону. Вследствие этого изучение гликотипа эндометрия в период ОИ является темой перспективных исследований в области иммунологии репродукции, патоморфологии и эпигенетики. Развитие этого направления в репродуктивной иммунологии и морфологии позволит идентифицировать маркеры углеводной природы в качестве маркеров фертильности, что позволит более осознанно подходить к подготовке эндометрия к циклам ВРТ.



