Эндометриоз характеризуется наличием элементов эндометрия (желез и/или стромы) за пределами слизистой оболочки матки. Наиболее часто очаги эндометриоза локализуются в органах малого таза: в матке, маточных трубах, яичниках, брюшине, маточно-крестцовых связах [1]. Наряду с этим имеется большое количество описаний и экстраперитонеального эндометриоза.
В структуре гинекологической патологии эндометриоз занимает третье место после воспалительных заболеваний женских гениталий и миомы матки. По данным Всемирного исследовательского фонда эндометриоза (WERF), каждая 10-я женщина репродуктивного возраста (176 млн женщин от 17 до 49 лет) болеет эндометриозом [2, 3]. В целом эндометриоз встречается примерно у 10% женщин детородного возраста, у 30–47% пациенток, страдающих бесплодием, и у 45% – с хронической тазовой болью [4, 5].
Эндометриоз расценивается в качестве доброкачественного заболевания, однако между ним и нормальной слизистой оболочкой матки имеется ряд различий, в том числе по уровню экспрессии рецепторов эстрогенов, секреции цитокинов, простагландинов, металлопротеиназ [6, 7]. Именно эти отличия и определяют изменения процессов ангиогенеза и иммунных реакций в участках эндометриоза, а также нарушения пролиферации и апоптоза их клеток [8, 9]. Более того, некоторые особенности его роста характерны для злокачественных опухолей, в частности отсутствие окружающей соединительно-тканной капсулы, способность к инфильтративному росту, ускорение роста после нерадикального удаления.
Цель данной работы: анализ данных литературы о роли эндометриоза в развитии и прогрессии опухолей.
Считается, что первым автором, указавшим в 1925 году на возможность злокачественной трансформации эндометриоза, был J. Sampson [10]. Приведенные им положения о том, что рак может развиться в участке эндометриоза и что элементы опухоли напоминают структуры эндометриоза, используются и в настоящее время. Еще один довод был озвучен R.B. Scott в 1953 году [11]: это наличие структур эндометриоза в окружности злокачественных новообразований.
В доказательство возможности малигнизации участков эндометриоза говорят многочисленные исследования. Однако имеющиеся данные о частоте озлокачествления очагов эндометриоза существенно варьируют. Так, на основании данных англоязычной литературы и 10 собственных наблюдений J.M. Heaps с соавт. [12] пришли к заключению, что частота малигнизации эндометриоза составляет порядка 1%. При этом в результате анализа 205 клинических наблюдений злокачественных новообразований, возникших в очагах эндометриоза, авторы установили, что в 78,7% опухоль локализовалась в яичниках. При этом в 69% наблюдений имелась картина эндометриоидной аденокарциномы, в 13,5% – светлоклеточного рака, в 11,6% – саркомы. При локализации процесса вне яичников эндометриоидная аденокарцинома была диагностирована в 66%, а саркомы – в 11,6% наблюдений.
Существенные результаты были получены в объемном исследовании, основанном на анализе 20 686 шведских пациенток с эндометриозом, у которых после выписки (в среднем через 11,4 г) из медицинского учреждения было выявлено 738 злокачественных новообразований [13]. Средние значения риска развития рака составили 1,18 (95% ДИ 1,1–1,3). При этом риск развития рака яичников был почти в 2 раза выше, чем в общей популяции (стандартизированное отношение заболеваемости – СОЗ 1,92, 95% ДИ 1,3–2,8) (табл. 1). Риск развития неходжкинской лимфомы был повышен в 1,79 раза, опухолей соединительной ткани – в 1,69 раза, рака щитовидной железы – в 1,50 раза, рака молочной железы – в 1,3 раза. В то же время стандартизированные отношения заболеваемости раком эндометрия и шейки матки составили соответственно 1,09 и 0,72.
В 2006 году А. Melin с соавт. [14] провели аналогичное, но более представительное исследование по определению риска развития злокачественных опухолей у 64 492 шведских женщин, страдающих эндометриозом (табл. 1). Средние значения рисков развития опухолей не имели значимых различий. Однако значения риска развития рака яичников составили 1,43, нейроэндокринных новообразований – 1,36 и опухолей соединительной ткани – 1,26. При этом выявленный риск развития неходжкинской лимфомы (1,24) авторы связывают с нарушениями иммунной системы и считают необходимым проведение специальных исследований.
Было показано, что порядка трети больных, страдающих эндометриозом и раком внематочной локализации, имели патологию эндометрия, включая его гиперплазию и рак [15]. Большинство же наблюдений внеяичникового рака, ассоциированного с эндометриозом, относится к периоду постменопаузы или случаям применения эстрогенов [16].
Примечательно, что более 20% из всех связанных с эндометриозом раковых образований локализуются вне яичников [12]. Так, достаточно существенная положительная связь была показана между эндометриозом и раком молочной железы (отношение разногласий 6,9) [17]. Хотя в исследовании не анализировались особенности взаимосвязей в зависимости от гистологического типа рака молочной железы, тем не менее, наиболее вероятными являются случаи с нарушениями рецепторов эстрогена и прогестерона. В этой связи, мы солидарны с мнением [18] о необходимости тщательного обследования всех пациенток с эндометриозом в отношении рака молочной железы.
Немаловажно, что у пациенток с эндометриозом по сравнению с женщинами без эндометриоза отмечается повышение риска развития семейных форм рака. По данным [19] среднее значение отношения шансов (odds ratio, OR) составило 7,7 (95% ДИ 3,8–15,7). Наиболее высокие значения OR наблюдались для рака яичника (10,5; 95% ДИ 2,5–44,2), толстой кишки (7,5; 95% ДИ 2,7–21,2) и простаты (4,5; 95% ДИ 1,4–15,3). По мнению авторов, в основе подобного явления лежат сходные мутации генов и молекулярные нарушения.
Резюмируя данные литературы, следует постулировать, что наличие очагов эндометриоза увеличивает риск развития злокачественных новообразований различных локализаций. В первую очередь, это касается поражений яичников [20, 21].

Действительно, почти все исследователи сообщают о повышенном риске развития рака яичников, который в большинстве случаев составляет от 1,3 до 1,6 [22] (табл. 2). Наиболее высокие показатели (2,88) приводят Brinton с соавт. [23]. Однако следует учитывать, что в данное исследование были включены пациентки, страдающие не только эндометриозом, но и первичным или вторичным бесплодием. При этом более высокий онкологический риск при эндометриозе установлен в отношении пациенток с первичным бесплодием по сравнению с аналогичными женщинами без эндометриоза (RR 2,77; 95% ДИ 1,1–6,7) [23].
С другой стороны, имеется достаточно большое количество публикаций, указывающих на сочетанное поражение эндометриозом и раком яичника, что также доказывает возможность злокачественной трансформации очагов эндометриоза. Наиболее четким доказательством подобной трансформации является морфологическое выявление структур рака в очагах эндометриоза. Однако подобные исследования не позволяют сделать однозначные выводы о гистогенезе новообразования.
Тем не менее, частота выявления эндометриоза у больных, страдающих раком яичника, варьирует от 3 до 53% (табл. 3). Важным моментом является факт повышения риска по мере увеличения длительности заболевания [13].
В этой связи следует указать на так называемый ассоцированный с эндометриозом рак яичника (АЭРЯ). Это понятие включает в себя все виды злокачественных новообразований, сочетающихся с эндометриозом [15]. В пользу такого определения служат имеющиеся различия между типичным раком яичника и АЭРЯ.
Прежде всего, АЭРЯ выявляется у пациенток более молодого возраста (среднее значение 48,3 г, стандартное отклонение 10,8 г) по сравнению с обычным раком яичников (53,8±11,4, p=0,003) [24]. В странах Запада эндометриоидные и светлоклеточные карциномы яичника составляют соответственно 10–20% и 5–10% всех форм рака яичника, в то время как частота карциномы высокой степени злокачественности или карциномы типа II достигает 70% [25]. В группе АЭРЯ эндометриоидная и светлоклеточная карциномы составляют 19 и 35,9% соответственно [26].
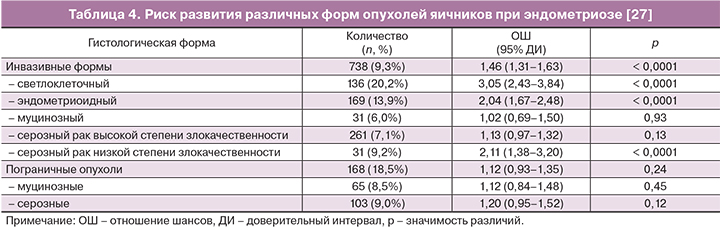
Учитывая возможность развития множества гистологических форм рака в структурах яичника, C.L. Pearce с соавт. [27] провели международное исследование, объединившее 13 отдельных случай-контроль исследований. На основании анализа 7911 пациенток с инвазивными формами рака яичника (из них 738 страдали эндометриозом), 1907 больных с пограничными опухолями (из них 168 с эндометриозом) и 13 226 женщин из групп контроля (эндометриоз имелся у 818) были рассчитаны риски развития рака яичника в зависимости от его гистологической формы. Авторы установили, что при эндометриозе отмечается значимое повышение риска развития светлоклеточной, эндометриоидной и серозной карциномы низкой степени злокачественности (табл. 4). В отношении же муцинозной, серозной карциномы высокой степени злокачественности и обеих форм пограничных опухолей повышение рисков было статистически не достоверным.
Вместе с тем риск развития эндометриоидной и светлоклеточной карциномы яичников понижался у пациенток, перенесших резекцию яичников по поводу эндометриоза [28].

Весьма интересные результаты получены при анализе так называемых пограничных опухолей яичников, которые рассматриваются как этап развития АЭРЯ. По данным ретроспективного исследования в 13% наблюдений имелось их сочетание с эндометриозом, что также подтверждается целым рядом публикаций отдельных клинических наблюдений. Установлено также повышение риска развития пограничных опухолей при эндометриозе (отношение опасности – hazard ratio (HR) 5,5; 95% доверительный интервал 1,5–20,2). Вследствие этого существует мнение, что одним из предшественников развития муцинозных и серозных пограничных опухолей яичников являются очаги эндометриоза.
То есть эндометриоз рассматривается в качестве начального этапа канцерогенеза с трансформацией в эндометриоидный рак. Источником развития светлоклеточного и эндометриоидного рака яичников могут быть клетки эндометрия после их попадания и имплантации в яичнике с последующим превращением в очаг эндометриоза [29]. Однако развитие эндометриоидной дифференцировки, по-видимому, возможно и в процессе малигнизации эпителия инклюзионных мюллеровых кист, поскольку большинство случаев эндометриоидного рака не ассоциированы с эндометриозом.
Примечательно, что K.A. Bell с соавт [30] предложили модель опухолевой прогрессии очагов эндометриоза в злокачественную опухоль путем нарастания атипии и появления микроинвазии. По мнению Czernobilsky и Morris [31], наличие в участках эндометриоза кубических или уплощенных эпителиальных клеток с гиперхромными или полиморфными ядрами свидетельствует об умеренной атипии. Критериями выраженной эндометриозной атипии считаются стратификация клеточной выстилки, появление аномальных крупных полиморфных гиперхромных или гипохромных ядер и соответственно уменьшение цитоплазматически-ядерного соотношения [32].
Признаки атипичного эндометриоза наблюдаются у 61–100% пациенток с АЭРЯ и могут встречаться в 1–3% препаратов эндометриоидных кист [33]. Злокачественный потенциал атипичных эндометриоидных образований до конца не выяснен, однако такие пациенты подлежат более частому и тщательному обследованию.
Согласно данным литературы, в настоящее время признается несколько возможных путей злокачественной трансформации очагов эндометриоза, в том числе нарушения генома, мутации генов, изменения экспрессии факторов роста.
Так, характерной чертой опухолевых клеток считается нестабильность генома [34], при этом большинство опухолей являются моноклональными в своем происхождении. В этой связи привлекают внимание данные ряда исследований [35], показавших, что ткань эндометриоза была моноклональной в 60–100% исследованных образцов. Вместе с тем, D. Mayr с соавт. [36] наблюдали моноклональность только в 2 (6%) из 32 образцов эндометриоза. По мнению же M. Mandai с соавт. [37], моноклональность в основном характерна для клеток эндометриоидных кист, в то время как мелкие очаги эндометриоза являются поликлональными.
Потеря гетерозиготности обычно указывает на области инактивации опухолевых генов-супрессоров и рассматривается в качестве ведущего звена в развитии злокачественных опухолей из их предшественников. Оказалось, что потери гетерозиготности выявляются и в участках эндометриоза.
X. Jiang с соавт. [38] выявили потерю гетерозиготности у кандидатов генов-супрессоров для опухолей яичника в 11 (27,5%) из 40 образцов эндометриоза. В другом исследовании те же самые авторы установили аналогичные нарушения в 9 из 11 очагов эндометриоза, окружающих или контактирующих со структурами рака яичника.
Более того, потеря гетерозиготности в локусе 10q23.3 и мутация опухолевого гена-супрессора PTEN, локализующегося на хромосоме 10q23.3, характерны, как для рака эндометрия, так и для рака яичника. Действительно, Sato и др. [39] выявили потерю гетерозиготности в 10q23.3 в 13 (56,5%) из 23 эндометриоидных кист яичника, в 8 (42,1%) из 19 эндометриоидных карцином яичника и в 6 (27,3%) из 22 светлоклеточных карцином яичника. В свою очередь, соматические мутации в гене PTEN были установлены в 20,6% наблюдений эндометриоидных кист яичника, в 20% эндометриоидных карцином и в 8,3% светлоклеточных карцином яичника. При этом M. Martini с соавт. [40] наблюдали снижение уровня экспрессии белка PTEN в 7 (15%) из 46 образацов эндометриоза.
Изолированные мутации KRAS были найдены в 1 (8,3%) из 12 наблюдений эндометриоидной и в 3 (12,5%) из 24 случаев светлоклеточной карциномы яичника [41] при сочетании их с эндометриозом. В экспериментах на мышах было показано, что делеция PTEN или усиление экспрессии онкогена KRAS в поверхностном эпителии яичников приводила к формированию предопухолевых поражений яичников с наличием структур железистого эндометрия, а комбинация вышеуказанных событий сопровождалась развитием инвазивной эндометриоидной карциномы яичника с метастазами. По мнению Sato с соавт. [39], инактивацию PTEN следует рассматривать в качестве раннего этапа злокачественной трансформации очагов эндометриоза.
Мутации KRAS и BRAF характерны для серозных карцином низкой степени злокачественности, а для карцином высокой степени злокачественности – высокий уровень неустойчивости генома и мутации TP53. Именно данные отличия легли в основу дуалистической гипотезы развития рака яичников. Предполагается, что предшественником серозной карциномы является пограничная (атипичная пролиферативная серозная) опухоль, которая в своем развитии трансформируется в агрессивную карциному высокой степени злокачественности. Неинвазивные серозные опухоли с микропапиллярной структурой в большей степени ассоциированы с синхронными или метахронными опухолями брюшины.
Другими звеньями онкогенеза очагов эндометриоза, видимо, являются мутации опухолевых генов-супрессоров. Мутации или потеря функции опухолевого гена-супрессора TP53 (на хромосоме 17p13.1), кодирующего ядерный белок p53, считаются одним из наиболее важных и частых генетических нарушений в развитии рака яичника. Мутации гена TP53 зависят от повышенной экспрессии нефункционирующего белка p53, который накапливается в ядрах клеток. В этой связи ряд исследователей провели анализ мутаций данного гена в образцах эндометриоза. F.Z. Bischoff c соавт. [42] установили, что хромосомная потеря TP53 является достаточно частым явлением при тяжелом эндометриозе и при эндометриозе на поздней стадии.
F. Nezhat с соавт. [43] иммуногистохимическими методами продемонстрировали повышение уровня экспрессии р53 соответственно в 9% и 25% наблюдений эндометриоза, сочетающихся с участками светлоклеточной и эндометриоидной карциномы, в то время как при эндометриозе в отсутствии рака реакция на p53 была отрицательной. R. Sainz de la Cuesta и соавт. [44] отметили статистически значимое повышение экспрессии p53 при переходе от типичного эндометриоза к атипичному, а также к карциноме яичника, ассоциированной с эндометриозом. Наконец, T. Akahane с соавт. [45] выявили мутации TP53 в 4 (на 30,8%) из 13 наблюдений сочетания эндометриоза со светлоклеточной карциномой яичника, в то время как такие мутации отсутствовали во всех 7 наблюдениях солитарного эндометриоза яичника и в 9 случаях эндометриоза, сочетающегося с эндометриоидным раком яичника. Наряду с этим, имеются описания мутаций TP53 в единичных наблюдениях светлоклеточной карциномы.
В работе K.C. Wiegand с соавт. [46] были изучены мутации ARID1A в наблюдениях эндометриоз-ассоциированной (светлоклеточной и эндометриоидной) карциномы яичника. ARID1A является геном-супрессором опухолей, участвующим также в регуляции репарации ДНК, пролиферации и дифференцировке клеток. Мутации ARID1A были установлены в 55 (46%) из 119 наблюдений светлоклеточной и в 10 (30%) из 33 эндометриоидной карциномы яичника, при этом во всех 76 изученных наблюдениях высокодифференцированной серозной карциномы яичника мутации ARID1A. Одновременно при иммуногистохимическом исследовании отмечалась потеря экспрессии белка BAF250a, коррелирующая с наличием мутации AIRD1A. При этом мутации AIRD1A и отрицательная реакция с BAF250a наблюдались в участках атипичного эндометриоза, граничащих с карциномой, и отсутствовали в отдаленных участках эндометриоза. На основании полученных данных авторы приходят к заключению, что мутации ARID1A характерны для ранних этапов трансформации эндометриоза в светлоклеточную и эндометриоидную карциному яичника.
Развитие рака яичника в участках эндометриоза может быть обусловлено воспалительными и гормональными изменениями. Действительно, клетки воспаления и секретируемые ими цитокины активируют процессы пролиферации, ангиогенеза, инвазивного роста, тормозя при этом апоптоз клеток, то есть способствуют росту и прогрессии опухоли. С другой стороны, в очагах эндометриоза практически всегда отмечается наличие местной воспалительной реакции и экспрессии цитокинов, а в перитонеальной жидкости – повышенный уровень медиаторов и факторов роста. Так, в эндометриоидных очагах наблюдалась повышенная продукцию интерлейкина-2 и 6, фактора роста эндотелия сосудов [47], в перитонеальной жидкости женщин, страдающих эндометриозом, – высокие уровни интерлейкина-1 [35], а в сыворотке крови – фактора некроза опухоли-α [48].
Заслуживает также внимания мнение M. Mandai с соавт. [37] об онкогенной роли содержимого эндометриоидных кист. Участки эндометриоза, как и функционирующий эндометрий, регулярно подвергаются кровоизлияниям, приводящим к избыточному накоплению гема и свободного железа. Последнее же, как известно, способствует канцерогенезу, в частности, в печени и почке, путем индукции окислительного стресса [49].
В этой связи следует добавить, что в участках рецидива эндометриоидных кист яичника наблюдается аккумуляция гепаринсвязывающих факторов роста, индуцирующих локальную гипокоагуляцию и соответственно развитие кровоизлияний, также новообразование сосудов капиллярного типа [50]. Существенно, что ангиогенез, равно как и факторы его развития, играют существенную роль в развитии очагов эндометриоза [51–53].
Возможность опухолевой трансформации очагов эндометриоза подтверждается и результатами морфологических исследований биопсийного и операционного материала. При изучении гистологических препаратов в участках эндометриоза нередко встречаются признаки метаплазии, в том числе реснитчатой, муцинозной, плоскоклеточной, частота которой варьирует в различных наблюдениях [33].
В этой связи следует уточнить, что в англоязычной литературе существует термин атипический (атипичный) эндометриоз, который используется в двух случаях: для обозначения признаков клеточной атипии и гиперплазии желез [33]. Так, при анализе 194 наблюдений эндометриоза яичников признаки выраженной клеточной атипии были обнаружены в 3,6%, а умеренной атипии – в 22% препаратов, железистая гиперплазия отмечалась лишь в 2,0% случаев [31]. В то же время такие фокусы клеточной атипии определялись в 61% наблюдений эндометриоза, сочетающегося с карциномой яичника, и только в 1,7% случаев изолированного эндометриоза [54].
Второй вид атипического эндометриоза обозначается также термином гиперплазия (с наличием или отсутствием признаков клеточной атипии) по аналогии с таковым в эндометрии. Гиперплазия при эндометриозе наблюдается намного реже по сравнению с признаками клеточной атипии, встречаясь, как правило, при эстрогенной стимуляции или лечении тамоксифеном [33].
По мнению J.D. Seidman [55] клеточная атипия может отражать как реактивные процессы, так и признаки дегенерации, не имея при этом существенного клинического значения. Однако большинство исследователей считает, что атипичные изменения эпителия подтверждают заключение о возможности малигнизации эндометриоза. Основным доводом служит факт более частого выявления признаков атипического эндометриоза в случаях сочетанного поражения эндометриозом и злокачественными новообразованиями по сравнению с наблюдениями эндометриоидных кист [56].
Таким образом, согласно данным литературы, большинство исследователей поддерживают концепцию, что эндометриоз обладает проонкогенным эффектом. Очаги эндометриоза имеют сходные черты с неопластическими процессами, а в яичниках могут явиться причиной светлоклеточной и эндометриоидной карциномы. Соответственно, одним из направлений профилактики рака яичников должно быть формирование групп риска среди пациенток, страдающих эндометриозом, с последующим динамическим их наблюдением.



