Папилломавирусная инфекция является одной из самых распространенных инфекций, передающихся половым путем. Поражая эпителиальные клетки, инфекция может протекать как бессимптомно, так и вызывать различные поражения, включая рак [1].
Центральным этиологическим фактором интраэпителиального рака и предраковых неопластических поражений шейки матки признан вирус папилломы человека (ВПЧ) высокого канцерогенного риска (ВПЧ-ВР) [2].
После инфицирования ВПЧ-ВР уже через 3 года у 27% женщин развивается цервикальная интраэпителиальная неоплазия (ЦИН) высокой степени. Наиболее опасным фактором прогрессии является длительная (более 2 лет) персистенция ВПЧ [3].
В крупном ретроспективном перекрестном исследовании (108288/108290) с участием 17 европейских стран была изучена распространенность различных генотипов ВПЧ у женщин с диагностированным раком шейки матки (РШМ). Методом полимеразной цепной реакции (ПЦР) выявляли 14 генотипов ВПЧ-ВР (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68/73). В ходе исследования установлено, что у женщин с гистологическим диагнозом «аденокарцинома шейки матки» 16/18/45 генотипы ВПЧ выявлены в 98,3%; при раке in situ – в 97,3%; при железисто-плоскоклеточном раке – в 91,3% случаев [4].
 В Москве определяли клинико-экономическую эффективность выявления ЦИН; установлено, что наиболее оптимальным является комбинированное использование ВПЧ-теста и цитологии. Чувствительность ВПЧ-теста составила 89,7% [5].
В Москве определяли клинико-экономическую эффективность выявления ЦИН; установлено, что наиболее оптимальным является комбинированное использование ВПЧ-теста и цитологии. Чувствительность ВПЧ-теста составила 89,7% [5].
После установления роли ВПЧ в развитии РШМ во всем мире начались поиски новых эффективных методик для ранней диагностики предрака и РШМ. Многие страны предлагают включить выявление ВПЧ-ВР в программы скрининга РШМ.
В 2015 году в США проведено исследование, которое показало, что использование только ВПЧ-теста в качестве скринингового метода у женщин старше 25 лет имеет равнозначную эффективность по сравнению с гибридным скринингом, при котором в возрасте 25–29 лет проводят только цитологическое исследование, а у женщин старше 30 лет проводят как цитологию, так и ВПЧ-тест [6].
Во многих странах проведены исследования для определения чувствительности самозабора вагинального отделяемого в выявлении ЦИН II/III. Получены противоречивые данные: в большинстве работ показана высокая чувствительность данного метода: в Китае (86,2%) [7], в Великобритании (81%) [8], в Индии (83%) [9], в США (85%) [10], на Гаити (87,5%) [11]; однако исследование, проведенное в Южной Африке показало значимо меньшую чувствительность данного метода – 66% [12].
Помимо оценки эффективности в исследованиях изучалось удобство применения устройств для самотестирования по сравнению со взятием материала врачом. Количество женщин в Швеции, прошедших самотестирование, в три раза выше, чем женщин, пришедших для осмотра специалистом. Одним из основных объяснений в анкетах был ответ: «неприятные ощущения при гинекологическом осмотре» [13]. В Тайване женщины, не посетившие скрининг (n=282), основными причинами отметили: отсутствие времени, низкий риск развития РШМ, боязнь положительного результата и предчувствие боли от проведения осмотра. Среди опрошенных женщин 90,8% отметили простоту и удобство самотестирования, а 88,3% порекомендуют пройти данный тест своим знакомым [14].
За последние годы во многих регионах России заболеваемость и смертность от РШМ возросла; все чаще заболевание встречается в молодом возрасте (30–39 лет). Является серьезной проблемой как первичная профилактика РШМ (регуляция гендерного поведения, вакцинация), так и вопросы скрининга: отсутствует регулярное наблюдение, не проводится ежегодный профилактический осмотр. Так, по данным К.В. Марочко (2015), из 65 пациенток, поступивших в стационар с диагнозом РШМ, цитологический скрининг применялся только у 5%, а ВПЧ-тестирование не проведено ни в одном случае. Первичная диагностика РШМ проводится преимущественно гистологическим методом, а в половине случаев – по обращаемости с выраженными клиническими проявлениями [15].
В Швеции установлено, что около 65% женщин с диагнозом РШМ не участвовали в организованном скрининге, а у 25% пациенток, участвующих в скрининге, диагнозу РШМ предшествовала серия нормальных цитологических мазков [16]. Женщинам, не прошедшим скрининг, предлагается провести самостоятельное взятие образца влагалищного отделяемого на дому для дальнейшего исследования на ВПЧ при помощи Qvintip (Aprovix AB, Uppsala Sweden). При выявлении ВПЧ-ВР приглашают на гинекологический осмотр для дальнейшего обследования [17].
В Чехии все участники отметили в анкетах удобство применения системы для самозабора как «хорошо» и «отлично»; 88% респондентов отметили, что предпочли бы взятие материала самостоятельно, чем проведение данной процедуры врачом [18].
Таким образом, РШМ в настоящее время является важной социально-экономической проблемой и имеет доказанную ВПЧ-этиологию. Существуют проблемы скрининга РШМ, во многом обусловленные нежеланием пациенток посещать врача гинеколога и проводить соответствующие манипуляции для исследования на цитологию и ВПЧ. С этих позиций представляется перспективным исследование распространенности и типирования ВПЧ в различных популяциях женщин, а также оценка эффективности различных методик самозабора материала для диагностики ВПЧ.
Цель – выявить частоту инфицированности ВПЧ среди женщин, находящихся в местах лишения свободы, и определить прогностическую ценность диагностики ВПЧ-ВР с помощью прибора Qvintip.
Материал и методы исследования
Обследованы 150 женщин в возрасте 25–59 лет, находящиеся в местах лишения свободы (Кемеровская область, г. Мариинск, ФКУ ИК № 35).
Исследование утверждено Этическим комитетом ГБОУ ВПО Кемеровская государственная медицинская академия Минздрава России. Всем исследуемым проведено анкетирование для выявления социально-демографических показателей и наиболее распространенных факторов риска инфицирования ВПЧ-ВР (табл. 1).
50 женщин (33,3%) были ВИЧ-инфицированы (среди них 92% страдали наркотической зависимостью). В связи с пребыванием в местах лишения свободы социальный уровень и показатель уровня жизни у всех заключенных оценены как низкие. Из 150 женщин только 19 (12,7%) отметили, что использовали барьерные методы контрацепции; не использовали методы контрацепции 53,3% женщин. Ни одна из обследуемых не владела информацией о ВПЧ.
Всем обследуемым был проведен забор материала для исследования на ВПЧ-ВР с помощью двух методов: самостоятельно женщиной при помощи Qvintip (в соответствии с прилагаемой инструкцией) и взятие материала из цервикального канала врачом (при помощи универсального урогенитального зонда – тип А). Материал, полученный врачом, помещался в пробирку типа «Эппендорф» с транспортной средой; материал, взятый женщиной самостоятельно, помещался в сухую пробирку без транспортной среды (согласно инструкции Qvintip). Оба образца были отправлены в лабораторию в течение суток. Выявление и дифференциация 12 наиболее распространенных генотипов ВПЧ-ВР (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) проводили методом ПЦР в режиме реального времени. Оба образца исследовались в одинаковых условиях и одним методом. За стандарт диагностики ВПЧ-ВР принят забор материала врачом при помощи универсального урогенитального зонда – тип А.
Полученные результаты были обработаны с использованием пакета статистических программ Statistica for Windows 6.0. При анализе количественных признаков, представленных в виде средней арифметической и ее стандартной ошибки (М±m). Прогностическая ценность метода исследования определена по стандартным формулам:
- Чувствительность(Se)=а/(а+с);
- Специфичность(Sp)= d /(b+d);
Прогностичность положительного результата:
(PPV)=а/(а+b);
Прогностичность отрицательного результата:
(NPV) = d/(с+d), где
a. Больные, выявленные с помощью теста (истинно положительные);
b. Здоровые, имеющие положительный результат теста (ложноположительные);
c. Больные, не выявленные с помощью теста (ложноотрицательные);
d. Здоровые, имеющие отрицательный результат теста (подлинно отрицательные).
Результаты исследования
По результатам лабораторного исследования ВПЧ-ВР выявлены у 55 (36,7%) женщин. Средний возраст составил 36,3±8,6 года. Наибольшая частота ВПЧ-позитивных женщин выявлена в возрастной группе 30–39 лет. Распределение по возрастным группам было следующим: 25–29 лет – 27,3%; 30–39 лет – 41,8%; 40–49 лет – 21,8%; 50-59 лет – 9,1%.
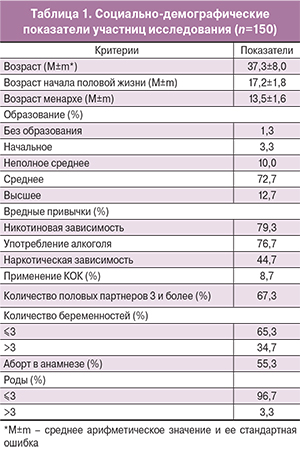
Среди ВПЧ-позитивных 32 (58,2%) женщины являлись ВИЧ-инфицированными. При оценке результатов в данной группе ВПЧ-ВР выявлен при заборе материала исследователем у 28 женщин (87,5%); при самозаборе с помощью устройства Qvintip – у 28 (87,5%). При помощи обоих методов ВПЧ выявлен в 24 случаях (75%). Частота встречаемости различных типов ВПЧ-ВР представлена на рис. 1.
При анализе частоты встречаемости всех выявленных типов ВПЧ-ВР среди инфицированных женщин (n=55) обнаружено, что наиболее часто встречаются: 16-й тип (43,6%); 52-й (34,5%); 33-й и 39-й типы ВПЧ (по 29,1%); 31-й и 58-й типы (по 25,4%).
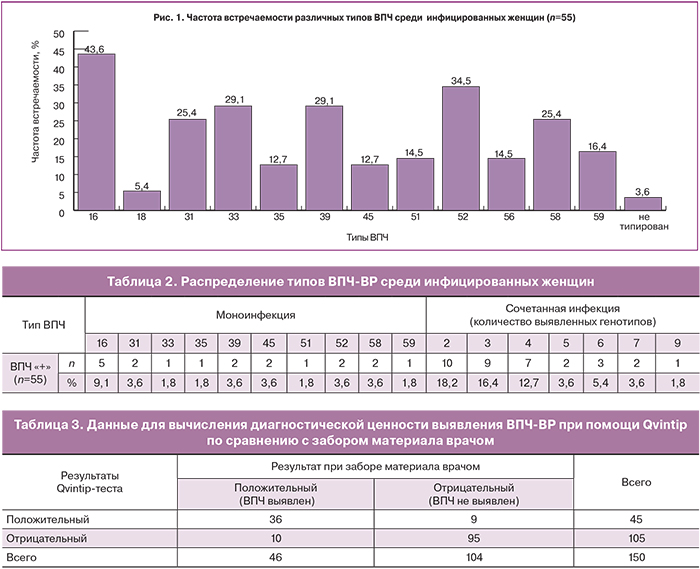
Распределение ВПЧ по филогенетическим группам: А7 (18, 39, 45 и 59-й типы); А9 (16, 31, 33, 35, 52 и 58-й типы); А5 (51-й тип) и А6 (56-й тип) представлено на рис. 2.
При анализе полученных данных выявлено, что 20% обследованных являются инфицированными ВПЧ из филогенетической группы А9. Чаще всего одновременно обнаруживают 16, 33, 52 и 58-й типы ВПЧ. В 21,8% случаев одновременно выявляются типы вируса из А7 и А9 групп, чаще выявляется сочетание 16-го с 39-м и 52-м типами. Только 5,4% инфицированных являются носителями ВПЧ из всех 4 филогенетических групп.
Полученные данные можно объяснить большим количеством ВИЧ-инфицированных заключенных – 32 человека (58,2%). В данной группе чаще встречалось сочетание нескольких типов (2 и более) ВПЧ-ВР (65,6%). В одном случае выявлено инфицирование 7 типами ВПЧ-ВР. Сочетание 16-го типа ВПЧ с другими генотипами наблюдалось в 16 случаях (50% среди ВПЧ-позитивных ВИЧ инфицированных). Установлено наиболее частое сочетание 16 типа ВПЧ с 31, 33, 39, 52, 58-м типами; сочетание с 18-м типом – только в 1 случае.
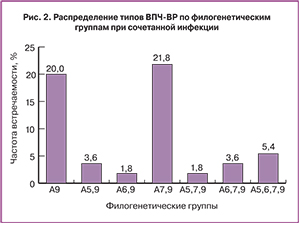 При исследовании количества генотипов в полученном материале моноинфекция ВПЧ-ВР была выявлена у 19 (34,6%) женщин; 2 и более генотипа – у 34 (61,8%) обследованных женщин. ВПЧ не типирован в 2 случаях (3,6%). Результаты генотипирования представлены в табл. 2
При исследовании количества генотипов в полученном материале моноинфекция ВПЧ-ВР была выявлена у 19 (34,6%) женщин; 2 и более генотипа – у 34 (61,8%) обследованных женщин. ВПЧ не типирован в 2 случаях (3,6%). Результаты генотипирования представлены в табл. 2
Среди 19 женщин с выявленным ВПЧ-ВР одного генотипа: 16-й генотип выявлен в 5 случаях (9,1%); 31, 39, 45, 52, 58-й генотипы – по 2 случая (3,6%); 33, 35, 51, 59-й генотипы – по 1 случаю (1,8%).
В 46 случаях (83,6%) ВПЧ-ВР выявлен при заборе материала исследователем, сопоставимый результат при заборе с помощью Qvintip – в 45 случаях (81,8%). ВПЧ-ВР выявлен обоими методами в 36 случаях (65,4%).
При заборе материала врачом выявлено 46 ВПЧ-позитивных обследуемых, что и взято за истинно положительные результаты.
Данные для определения чувствительности, специфичности, прогностической ценности положительного и отрицательного результатов теста, методом Qvintip, приведены в табл. 3.
Результаты проведенного исследования показали, что чувствительность метода Qvintip составила 78,3% (95% ДИ=67,1–86,2); специфичность – 91,3% (95% ДИ=86,4–94,9); прогностическая ценность положительного результата – 80% (95% ДИ=68,6–88,2); отрицательного результата – 90,5% (95% ДИ=85,6–94,0).
Обсуждение
В результате проведенного исследования получены данные о высокой частоте (36,7%) инфицирования ВПЧ-ВР женщин, находящихся в местах лишения свободы. Установлено, что инфицирование ВИЧ является кофактором ВПЧ-инфекции, поскольку более половины (58,2%) ВПЧ-инфицированных женщин страдали ВИЧ инфекцией. Ранее Т.Е. Белокриницкой и соавт. (2015) было установлено, что коинфекция ВПЧ 16, 18, 33-го типов, цитомегаловирусом и хламидиями является конфаундинг-фактором развития плоскоклеточных интраэпителиальных поражений высокой степени [19].
Распространенность ВПЧ-инфекции среди популяции Российской Федерации, как и частота встречаемости различных генотипов, изучена в единичных исследованиях [20–22]. Частота встречаемости ВПЧ-ВР в Российской Федерации и странах бывшего Советского Союза, также западных странах и странах Центральной Азии имеет очень большой диапазон колебания и составляет от 0 до 48,4% [21].
Например, среди жительниц Томской области общая инфицированность ВПЧ составляет 45,5%, коренного женского населения Республики Тыва – 50,6% [3]. А распространенность ВПЧ-ВР среди жительниц Санкт-Петербурга в возрасте 30–65 лет (n=823) существенно ниже – 13% [22].
В большинстве стран мира ВПЧ-16 превалирует и выявляется в 50–60% случаев РШМ; ВПЧ 18 – в 10–20%, ВПЧ 45 – в 4–8% и ВПЧ 31 – в 1–5% случаев [23].
В нашем исследовании у женщин-заключенных, также как и в других популяционных исследованиях, наиболее часто встречается 16-й тип ВПЧ (43,6%). В Томской области и Республике Тыва ВПЧ 16-го типа выявляется в 27,4 и 37,7% случаев соответственно. Менее распространены ВПЧ 56 (11,3%), ВПЧ 52 (9,1%), ВПЧ 31 (8,5%), ВПЧ 18 (8%), ВПЧ 33/51 (7,7%) [3]. В исследовании, проведенном в Санкт-Петербурге, чаще встречаются 16, 31, 52 и 33-й типы ВПЧ-ВР [22]. Наши данные свидетельствуют о доминировании у женщин-заключенных, кроме 16-го, также 52, 33, 39, 31 и 58-го типов ВПЧ, существенно реже встречается ВПЧ 18-го типа (5,4%).
При анализе распределения типов ВПЧ по филогенетическим группам сопоставимые данные получены в исследовании, проведенном в Ростовской области (в 30% случае выявлены типы ВПЧ из А7 и А9 филогенетических групп; наиболее часто встречались 16-й и 31-й типы ВПЧ) [24].
Известно, что выявление нескольких типов ВПЧ ассоциировано с более высоким риском длительной персистенции вируса в организме. В нашем исследовании показана высокая частота инфицирования несколькими типами ВПЧ-ВР (от 2-го до 9-го) в 61,8% случаев. Например, 16-й генотип в сочетании с другими генотипами встречался в 19 случаях (34,5%).
По данным предыдущих исследований, чувствительность самозабора вагинального отделяемого в выявлении ЦИН II/III в различных странах составляла от 66 до 87,5% [8–10, 15, 21, 24]. В нашем исследовании чувствительность диагностики ВПЧ-ВР с помощью Qvintip составила 78,3%, специфичность – 91,3% по сравнению с забором материала врачом, что позволяет считать обоснованным применение данного устройства в программах скрининга РШМ.
Заключение
Таким образом, полученные данные свидетельствуют о высокой частоте инфицированности ВПЧ-ВР женщин, находящихся в местах лишения свободы (36,7%), как правило (61,8%), несколькими генотипами ВПЧ-ВР, среди которых превалирует 16-й тип ВПЧ (43,6%). Кроме того, при анализе частоты встречаемости лидируют: 52-й (34,5%); 33-й и 39-й (29,1%); 31-й и 58-й типы ВПЧ (25,4%). Более 1/3 заключенных ВИЧ-инфицированы, частота ВПЧ-ВР у них составляет 58,2%. При анализе прогностической ценности диагностики ВПЧ-ВР с помощью Qvintip получены высокие показатели чувствительности (78,3%) и специфичности (91,3%) данного метода по сравнению с забором материала врачом. Данное устройство является простым в использовании и может быть рекомендовано в программах скрининга для выявления ВПЧ-ВР.



