В текущем десятилетии в России, как и в большинстве стран мира, наблюдается неуклонный и весьма интенсивный рост частоты доброкачественных новообразований тела матки, которые занимают 3-е место в структуре гинекологических заболеваний. В репродуктивном возрасте миома матки выявляется у 40% пациенток, оказывая влияние не только на качество жизни женщины, но и ограничивая ее репродуктивный потенциал [1]. Несмотря на достаточно большой клинический опыт терапии миомы матки, эффект от лечения часто оказывается неполным, заболевание прогрессирует, что требует проведения радикального хирургического вмешательства. В этой связи поиск наиболее доступных и высокоэффективных методов терапии имеет большое практическое значение.
В настоящее время большинство фармакологических препаратов, зарегистрированных для терапии миомы матки, оказывают лечебный эффект только на фоне их применения с быстрым прогрессированием заболевания после отмены. Кроме того, ряд развивающихся побочных эффектов ограничивает их широкое применение в репродуктивном возрасте [2].
Облегчение симптомов (аномальное маточное кровотечение, боль, давление) миомы матки является основной задачей терапии [3]. Характер лечения определяется выраженностью клинической симптоматики, вариантом миомы, размерами и расположением миоматозных узлов, возрастом пациентки и ее репродуктивными планами [4].
Медикаментозная терапия эффективна у 75% пациенток с метроррагией, однако неоднозначна в долгосрочной перспективе [5]. По данным систематического обзора было показано, что на фоне пероральной терапии симптомной миомы матки почти 60% женщин подвергаются операции в течение последующих 2 лет [6].
Доказано, что в основе развития миомы матки лежат дисгормональные нарушения, приводящие к моноклональной клеточной пролиферации с подавлением процессов апоптоза [7]. В опухолевой ткани количество рецепторов эстрогенов и прогестерона гораздо выше, чем в нормальной мышечной ткани, поэтому половые гормоны оказывают стимулирующий эффект на развитие миомы [8, 9]. В связи с этим применение препаратов с антипрогестероновым эффектом считается патогенетически обоснованным и приемлемым.
В 2012 г. в Европе был зарегистрирован новый препарат для терапии миомы матки – улипристала ацетат. Улипристала ацетат является селективным модулятором рецепторов прогестерона, оказывая проапоптотическое и антипролиферативное действие. Препарат также снижает продукцию сосудисто-эндотелиального фактора роста и модулирует распад экстрацеллюлярного матрикса только в лейомиомах, не оказывая влияния на миометрий [10]. Улипристал оказывает смешанное ткане-специфичное агонистическое-антагонистическое влияние на рецепторы прогестерона в лейомиоме, миометрии и эндометрии, не имея при этом гипоэстрогенного и других негативных побочных эффектов.
Молекулярно-биологические механизмы влияния улипристала на миомы изучены главным образом in vitro. В культуре ткани опухолевых лейомиоцитов доказаны подавление их пролиферативной активности и индукция апоптоза селективными модуляторами рецепторов прогестерона (улипристал), а также снижение продукции ими разных факторов роста, включая эпидермальный и сосудистый эндотелиальный, а также коллагена в сочетании с повышением синтеза матриксных металлопротеиназ.
Согласно данным официальной инструкции, улипристала ацетат зарегистрирован как лекарственное средство, используемое в качестве предоперационной терапии продолжительностью не более 3 месяцев умеренных и тяжелых симптомов миомы матки у женщин репродуктивного возраста старше 18 лет. Препарат тормозит овуляцию, но не оказывает существенного влияния на уровень эстрадиола в сыворотке крови. Использование улипристала ацетата перорально по 5 или 10 мг один раз в день в течение 12 недель в рандомизированном исследовании 242 женщин с меноррагией и размерами матки менее 16 недель привело к значительному улучшению [11]. Прекращение меноррагии при применении 5 мг препарата было достигнуто в 91%; при применении 10 мг – в 92% случаев. Сокращение объема миомы на 21% было отмечено у женщин, получавших 5 мг улипристала ацетата и на 12% – на фоне терапии в дозе 10 мг препарата.
После прекращения терапии физиологическая секреция гормонов восстанавливается, менструации возобновляются в среднем через 30 дней [10].
В литературе недостаточно данных об эффективности применения улипристала ацетата в зависимости от клинико-морфологического варианта миомы матки. В связи с этим целью исследования стала оценка эффективности и безопасности терапии миомы матки с помощью улипристала ацетата у пациенток репродуктивного возраста с простой и пролиферирующей миомой матки.
Материал и методы исследования
Проведено проспективное когортное исследование, охватившее 30 больных миомой матки. Критериями включения в исследование были наличие миомы матки, репродуктивный возраст, отсутствие сопутствующей патологии эндометрия и кровотечения неясного генеза, а также подписанное информированное согласие пациентки на участие в исследовании. В зависимости от клинического течения заболевания (симптомное и бессимптомное), данных ультразвукового исследования (УЗИ), цветового допплеровского картирования миоматозных узлов пациентки были рандомизированы на группы с различными клинико-морфологическими вариантами лейомиом (ЛМ) – с простой (I группа) и пролиферирующей (II группа) [12].
Пациентки I (n=10) и II (n=20) групп в качестве предоперационной подготовки получали улипристала ацетат по 5 мг перорально 1 раз в сутки с 1-го дня менструального цикла в течение 3 месяцев. После завершения курса терапии всем больным была произведена операция миомэктомии с гистологическим исследованием миомы. Образцы ткани (от 3 до 6) из разных участков каждой ЛМ фиксировали в 10% нейтральном формалине и по общепринятой методике заливали в парафин.
Гистологические срезы окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону и толуидиновым синим. Для иммуногистохимического исследования гистологические срезы помещали на предметные стекла, покрытые адгезивом (APES-ацетон). Эндогенную пероксидазу в депарафинированных срезах блокировали 3% перекисью водорода. Демаскировку антигенов производили в микроволновой печи в течение 20 мин в 0,1 М растворе цитратного буфера (рH 6,0). Использовали 11 первичных специфических антител: к маркеру эндотелия CD34 (mouse monoclonal antibody, «Novocastra», Великобритания), сосудисто-эндотелиальному фактору роста — VEGF (rabbit monoclonal antibody, «GeneTex», США); эпидермальному фактору роста — EGF (mouse monoclonal antibody, EGF-10, «Santa Cruz Biotechnology», США), основному фактору роста фибробластов — FGF-2 (rabbit polyclonal antibody, «Santa Cruz Biotechnology», США), трансформирующему фактору роста-β1 — TGF-β1 (rabbit polyclonal antibody, «GeneTex», США), матриксным металлопротеиназам — ММР-2, -10 (rabbit polyclonal antibody, «Spring Bioscience», США), MMP-12 (mouse monoclonal antibody, «Santa Cruz Biotechnology», США), их тканевым ингибиторам TIMP-1, 2, 3 (rabbit polyclonal antibody, «Spring Bioscience», США). Гистологические срезы инкубировали с первичными антителами в течение 30—60 мин при температуре 37°С (рабочее разведение антисывороток 1:100—1:400). Применяли систему детекции Novolink Polymer Detection System («Leica», Великобритания). Проводили общепринятые отрицательные (с исключением первичных специфических антител) и положительные (с использованием препаратов рака молочной железы) контрольные процедуры на используемые реагенты и ткани при обработке параллельных срезов.
Для оценки продукции факторов роста (VEGF, EGF, FGF-2, TGF-β1), матриксных металлопротеиназ (ММР-2,-10,-12) и их тканевых ингибиторов (TIMP-1,-2,-3) использовали полуколичественный морфометрический метод. Визуально оценивали интенсивность иммуногистохимической реакции в баллах от 0 до 3 (отрицательная, слабая, умеренная и выраженная) в 10 полях зрения при увеличении 400.
Эффективность лечения оценивалась по динамике клинико-лабораторных показателей, а также изменениям размеров миоматозных узлов. Состояние эндо- и миометрия оценивали при УЗИ с применением конвексного датчика частотой 3,5 МГц (трансабдоминальное исследование) и частотой 5–8 МГц (трансвагинальное исследование). Особенности васкуляризации оценивали с помощью цветового допплеровского картирования.
Статистическую обработку полученных данных производили по общепринятому методу вариационной статистики.
Результаты исследования
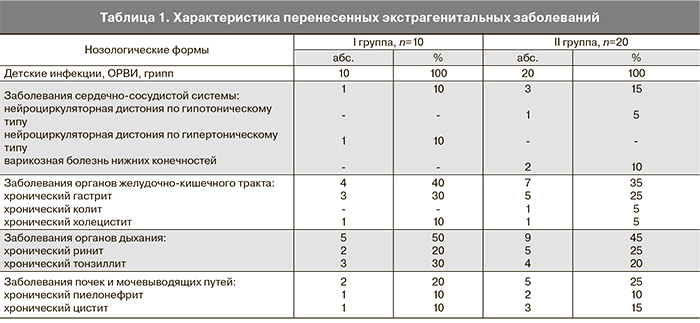
Возраст пациенток обеих групп находился в пределах от 30 до 37 лет (32±1,8 года). В табл. 1 представлены особенности соматического статуса пациенток.
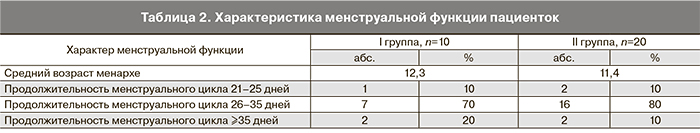
Обращает на себя внимание значительная частота воспалительных и простудных заболеваний в анамнезе у обследованных обеих групп. При сравнении между группами, статистически достоверных различий выявлено не было. Характеристика менструальной функции представлена в табл. 2.
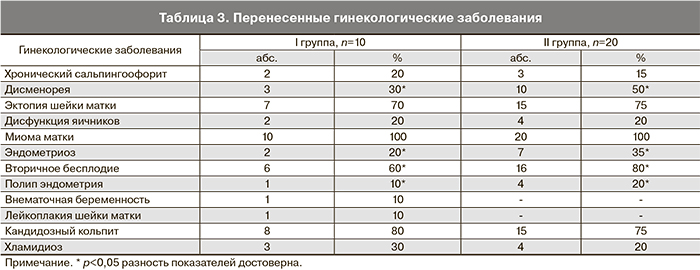
У большинства обследованных продолжительность менструального цикла была от 26 до 35 дней. 86% пациенток в анамнезе имели различные гинекологические заболевания (табл. 3).
Наиболее распространенными гинекологическими заболеваниями были эктопия шейки матки (70 и 75%) и кандидозный кольпит (80 и 85%). Достоверно чаще у пациенток с пролиферирующей миомой матки развивалась дисменорея и вторичное бесплодие. У 32% пациенток отмечено сочетание 2 и более гинекологических заболеваний. Вторичное бесплодие отмечено у 60% женщин с простой миомой матки и у 80% пациенток с пролиферирующей миомой матки.
Длительность заболевания миомой матки колебалась от 2 до 6 лет, в среднем около 3 лет. Подавляющее большинство пациенток с простой миомой матки (70%) имели 1–2 миоматозных узла размерами от 30 до 50 мм, в то время как у 80% больных с пролиферирующей миомой матки обнаружены множественные миоматозные узлы различных размеров, достигающих 80 мм. В группе пациенток с простой миомой матки локализация узлов была интерстициальная и субсерозная. В группе с пролиферирующей миомой матки имел место множественный характер роста узлов. У 20% пациенток узлы миомы располагались в области трубных углов, ребер матки и в области перешейка.
В группах пациенток с простой и пролиферирующей миомой матки основным клиническим проявлением заболевания были маточные кровотечения с развитием анемического синдрома легкой и средней тяжести.
После первых трех месяцев лечения аменорея наблюдалась у 70% пациенток I группы и у 90% больных II группы. Остановка маточных кровотечений произошла в среднем через 9 дней после назначения улипристала ацетата.
При анализе среднего диаметра миоматозных узлов по данным УЗИ через 3 месяца от начала терапии было выявлено уменьшение данного показателя на 27% в I группе пациенток и на 47% – во II исследуемой группе. Представляет интерес состояние эндометрия после цикла лечения улипристала ацитатом. У 80% больных в обеих группах было обнаружено уменьшение срединного М-эха до 4–5 мм, у 10% толщина эндометрия достигала 8 мм и у 10% было выявлено увеличение толщины эндометрия до 12–14 мм (преимущественно в группе с пролиферирующей миомой матки).
Оценивая побочные эффекты при использовании улипристала ацетата в качестве предоперационной подготовки, следует подчеркнуть, что ни одна женщина не прекратила участие в исследовании вследствие возникновения каких-либо серьезных нежелательных явлений.
Хирургический этап выполняли через месяц после трехмесячного применения улипристала ацетата. Существенных различий при проведении лапаротомии и миомэктомии в обеих исследуемых группах выявлено не было. При этом операцию без вскрытия полости матки удалось выполнить у 80% больных I группы и у 60% пациенток II группы, у остальных женщин миомэктомия сопровождалась вхождением в полость матки. Величина кровопотери составила в среднем 150–200,0 мл. Послеоперационных осложнений в изучаемых группах выявлено не было.
Во всех случаях было выполнено стандартное гистологическое исследование удаленной миомы, подтвердившее установленный до начала лечения диагноз. Принципиальных различий влияния улипристала ацетата на ЛМ при анализе результатов гистологического исследования между группами не выявлено.
Иммуногистохимическое исследование с маркером эндотелия сосудов CD34 выявило в наблюдениях II группы по сравнению с I группой выраженную редукцию микроциркуляторного русла ЛМ, причем просвет многих сосудов был неравномерно сужен или, наоборот, расширен. Продукция VEGF в ЛМ после лечения улипристалом снижалась в среднем в 2 раза, составляя 2,2±0,4 в I группе и только 1,1±0,5 – вo II группе. При этом экспрессия VEGF сохранялась только в периваскулярных участках опухолей, главным образом, в эндотелии сосудов. Продукция других трех изученных факторов роста (EGF, FGF-2 и TGF-β1) в ЛМ после лечения улипристалом также была значительно (в 2–2,7 раза) снижена при пролиферирующей миоме по сравнению с простой.
Изучение продукции трех различных ММР и их тканевых ингибиторов выявило, что в ЛМ под влиянием улипристала активируются процессы ферментного лизиса экстрацеллюлярного матрикса. Экспрессия ММР-2 (желатиназы A, коллагеназы типа IV) и ММР-10 (стромелизина-2) в опухолях пациенток с пролиферирующей ЛМ была в 2,5–3 раза выше, чем в простой ЛМ). Продукция трех изученных тканевых ингибиторов матриксных металлопротеиназ (TIMP-1, -2, -3), в пролиферирующих ЛМ была снижена в среднем в 2,3–2,8 раза.
Таким образом, улипристал оказывает на ЛМ комплексное действие, влияя одновременно на паренхиму, сосуды и строму опухоли, приводя не только к остановке ее роста, но и значительному и, как показано ранее, долговременному уменьшению объема. Проведенное исследование показало, что улипристал подавляет ангиогенез ЛМ, угнетая прежде всего продукцию VEGF и приводя к редукции сосудистого русла опухоли. Помимо этого, обнаружено подавление продукции и других важнейших для ангиогенеза и роста паренхимы и стромы опухоли факторов (EGF, FGF-2 и TGF-β1). Обнаруженное повышение продукции ММР в сочетании с подавлением экспрессии их тканевых ингибиторов указывает на то, что улипристал активирует в ЛМ процессы ферментного лизиса (гидролиза) экстрацеллюлярного матрикса и ремоделирования стромы, приводя в итоге к уменьшению ее объема. Гистологически это подтверждается появлением очагов лизиса стромы с сохранением нейтрального рН и коллапса ткани ЛМ с феноменом сближения сосудов. Изученные матриксные металлопротеиназы (ММР-2- желатиназа А, ММР-10-стромелизин-2 и ММР-12-макрофагальная металлоэластаза) относятся к семейству Zn2+- и Са2+-зависимых эндопептидаз, участвующих в ремоделировании соединительной ткани посредством разрушения ее органических компонентов при физиологических значениях рН. ММР относят к «индуцируемым» ферментам, транскрипция и активность которых подчиняются ряду факторов (стероидные и тиреоидные гормоны, цитокины, факторы роста, химические агенты и др.), в том числе половым гормонам. Показано, что присутствие прогестерона и эстрогенов в культуре клеток эндометрия снижает активность ММР, а при их отмене она резко повышается. Прогестерон в наибольшей степени снижает экспрессию ММР в эндометрии, а также увеличивает транскрипцию генов, кодирующих TIMP. Это может служить объяснением обнаруженной способности селективного модулятора рецепторов прогестерона улипристала повышать в ЛМ продукцию ММР и угнетать продукцию их тканевых ингибиторов в тесной связи с подавлением выработки факторов роста, процессов ангиогенеза, проапоптотическим и антипролиферативным действием.
Обсуждение
В настоящее время главным методом лечения миомы матки независимо от возраста пациентки является хирургический. На современном этапе развития медицины не существует другого способа терапии миомы, который мог бы быть альтернативой оперативному лечению, обладать высокой эффективностью при длительном применении и отсутствием выраженных побочных явлений. Однако по-прежнему продолжается активный поиск альтернативных подходов к лечению данного заболевания, учитывая инвазивный характер операции, возможные осложнения и, самое главное, отсутствие воздействия на патофизиологические причины возникновения доброкачественной опухоли матки при использовании хирургического метода лечения.
Возможности медикаментозного лечения миомы матки существенно ограничены тем, что наиболее эффективные для терапии данного заболевания препараты, к которым относятся в первую очередь агонисты гонадотропин-рилизинг гормона, не могут применяться достаточно длительно в связи с возникновением побочных эффектов. К тому же, отменяя данные препараты, врач ожидает рецидивирования опухолевых процессов матки через довольно небольшой промежуток времени.
Поэтому в представленном исследовании мы попытались провести комплексное лечение молодых женщин с миомой матки, страдающих бесплодием и имеющих один из основных симптомов миомы – выраженные менометроррагии.
Наибольший интерес вызывает сравнение эффективности терапии пациенток с простой и пролиферирующей миомой матки селективным модулятором прогестероновых рецепторов улипристала ацетатом. При применении предоперационной терапии улипристала ацетатом у больных с миомой и маточными кровотечениями выявлено, что вне зависимости от клинико-морфологического варианта миомы маточные кровотечения купировались уже на 6–9-й день терапии. Сравнительный анализ действия препаратов на размеры миоматозных узлов показал, что при пролиферирующей миоме матки препарат оказывает более выраженное воздействие на величину опухоли, чем при простой миоме. Улипристал вызывает уменьшение объема ЛМ не только вследствие индукции апоптоза клеток опухоли, снижения их пролиферативной и митотической активности, но и благодаря подавлению ангиогенеза, продукции факторов роста (VEGF, EGF, FGF-2, TGF-β1) в сочетании с повышением продукции матриксных металлопротеиназ (MMP-2, -10, -12) и снижением продукции их тканевых ингибиторов (TIMP-1, -2, -3). Это приводит к редукции сосудистого русла, ремоделированию и уменьшению объема экстрацеллюлярного матрикса ЛМ. Одновременное влияние на паренхиматозный компонент, ангиогенез и экстрацеллюлярный матрикс объясняет механизм быстрого, выраженного и пролонгированного уменьшения объема ЛМ под влиянием улипристала.
Особое внимание в современной научной литературе уделено влиянию на эндометрий препаратов, действующих на рецепторы прогестерона. Известно, что селективные модуляторы рецепторов прогестерона обладают смешанными агонистическими-антагонистическими свойствами в отношении прогестероновых рецепторов и в ряде случаев могут вызывать развитие класс-специфических обратимых доброкачественных изменений эндометрия. Такие изменения получили название PAEC – Progesterone receptor modulators Associated Endometrial Changes (изменения эндометрия, ассоциированные с модулятором рецепторов прогестерона), причем подчеркивается их принципиальное отличие от гиперплазии эндометрия, с которой их необходимо дифференцировать [11, 13–15]. В нашем исследовании у 10% больных на фоне использования улипристала ацетата при УЗИ определялось увеличение толщины эндометрия, обусловленное РАЕС.
Заключение
Таким образом, проведенное исследование показало высокую эффективность и безопасность применения улипристала ацетата в качестве предоперационной подготовки у пациенток с различными клинико-морфологическими вариантами ЛМ – простой и пролиферирующей миомами. Основным преимуществом нового метода терапии является быстрый контроль кровотечения, сопровождающийся стабилизацией уровня гемоглобина перед операцией и уменьшением объема миоматозных узлов.



