Миома матки является одним из наиболее часто встречающихся гинекологических заболеваний, приводящих к нарушению репродуктивной функции у женщин [1–5]. По данным различных исследований, частота миомы матки среди женщин репродуктивного возраста варьирует от 30 до 35% [6, 7]. Миома матки во время беременности и в родах приводит к различным акушерским осложнениям [1, 8, 9].
Наиболее неблагоприятной локализацией миомы с позиции репродуктологии являются узлы, расположенные в области перешейка и устьев маточных труб [9], а также субмукозная локализация опухоли. Одной из возможных причин бесплодия у больных с миомой матки может быть изменение васкуляризации миометрия и эндометрия [10], нарушение имплантации за счет изменения содержания в эндометрии вазоактивных веществ, а также нарушение экспрессии в узлах миомы генов, участвующих в этих процессах [11–13]. В ряде работ показано, что на частоту наступления беременности оказывает влияние не только локализация опухоли, но также ее размеры. Прогностически наиболее неблагоприятными считаются миоматозные узлы, достигающие диаметра 4 см и более [9].
Лапароскопическая миомэктомия является основным методом лечения миомы матки. Основными задачами после выполнения миомэктомии у пациенток, планирующих беременность, являются: обеспечение надежной контрацепции на период реабилитации и формирования полноценного рубца (3–6 месяцев), профилактика рецидива миомы матки [14].
В настоящее время с целью профилактики рецидива миомы матки используются следующие группы препаратов: прогестагены, агонисты гонадотропин-рилизинг гормона, комбинированные контрацептивы (КК). Последние, с нашей точки зрения, являются терапией выбора в рамках реабилитации после выполнения миомэктомии у пациенток, планирующих беременность, так как снижают риск рецидива заболевания и обеспечивает надежный контрацептивный эффект.
Сообщения в литературе о влиянии КК на рост миомы матки чрезвычайно противоречивы [15–19].
В исследовании Ross и соавт. [17] показано, что риск развития фибромиомы прогрессивно уменьшается в зависимости от продолжительности приема КК, что объясняется снижением свободных фракций эстрогенов, обусловленных влиянием прогестагенов. Противоречивые данные по поводу влияния КК могут объясняться различными видами эстрогенов и прогестагенов, входящих в состав препаратов. Ross и соавт. [17] проанализировали состав и дозы гормональных компонентов в различных КК. Несмотря на то что по поводу эстрогенного компонента достоверных заключений сделать не удалось, авторы отметили, что чем выше доза прогестагена норэтистерона ацетата в препаратах, содержащих одинаковую дозу этинилэстрадиола, тем ниже заболеваемость миомой матки. Напротив, все препараты, содержащие прогестаген этинодиола диацетат, приводили к увеличению заболеваемости миомой матки, независимо от количества или вида эстрогена, входящего в состав КК. Авторы не смогли объяснить этот факт и заявили, что необходимы дополнительные исследования.
Тем не менее, в настоящее время большинство фундаментальных исследований, посвященных гормональной зависимости роста миомы матки, указывают на ведущую роль эстрогенов в патогенезе данного заболевания. В ряде исследований было показано различное содержание стероидных гормонов и их рецепторов в тканях лейомиомы и нормальном миометрии [20].
Учитывая вышесказанное, особое значение приобретает проблема правильного выбора КК в качестве эффективной и безопасной терапии у пациенток после выполнения миомэктомии.
Цель исследования: оценить эффективность и безопасность применения различных КК после выполнения лапароскопической миомэктомии у пациенток с бесплодием, планирующих беременность.
Материал и методы исследования
Группу наблюдения составили 163 пациентки с бесплодием и миомой матки, планирующие беременность. Средний возраст больных составил 31,4±4,2 года (26–44 года). Всем пациенткам до операции проведено гормональное обследование с целью исключения гормональных факторов бесплодия. У всех больных во время лапароскопии проводилась хромогидротубация для исключения трубного фактора бесплодия. Также был исключен мужской фактор бесплодия. У всех пациенток уточняли семейный анамнез о заболеваемости миомой матки.
 Лапароскопическая миомэктомия выполнялась согласно разработанной нами стандартизированной хирургической технике, основными задачами которой были: минимизация хирургической травмы интактного миометрия, сохранение капсулы узлов и прилежащего к ней интактного миометрия, прецизионный исключительно биполярный гемостаз ложа удаленного узла и обязательное послойное ушивание раны миометрия ареактивными синтетическими нитями, а следовательно, формирование в дальнейшем полноценного послеоперационного рубца на матке, что особенно важно у категории пациенток, планирующих беременность [21]. В связи с этим для выполнения разреза на матке мы использовали гармонический скальпель Ultracision (ETHICON), действие которого обусловлено ультразвуковой энергией, которая не приводит к термическому воздействию на интактный миометрий, так как основана на эффекте вибрации (рис. 1 см. на вклейке).
Лапароскопическая миомэктомия выполнялась согласно разработанной нами стандартизированной хирургической технике, основными задачами которой были: минимизация хирургической травмы интактного миометрия, сохранение капсулы узлов и прилежащего к ней интактного миометрия, прецизионный исключительно биполярный гемостаз ложа удаленного узла и обязательное послойное ушивание раны миометрия ареактивными синтетическими нитями, а следовательно, формирование в дальнейшем полноценного послеоперационного рубца на матке, что особенно важно у категории пациенток, планирующих беременность [21]. В связи с этим для выполнения разреза на матке мы использовали гармонический скальпель Ultracision (ETHICON), действие которого обусловлено ультразвуковой энергией, которая не приводит к термическому воздействию на интактный миометрий, так как основана на эффекте вибрации (рис. 1 см. на вклейке).
Для ушивания ложа узлов применяли отдельные мышечно-мышечные эндошвы (Vikril+ 1/0, 2/0, Monokril 1/0, 2/0) с использованием техники экстракорпорального завязывания хирургических узлов при помощи толкателя нитей (так называемый пушер). Это обеспечивает формирование максимально полноценных швов на матке и сопоставление краев миометрия (рис. 2 см. на вклейке). В данной серии мы минимизировали использование биполярной электрокоагуляции ложа удаленного узла и использовали только прецизионный электрохирургический биполярный гемостаз.
Всем больным в послеоперационном периоде назначали препарат пентоксифиллина (трентал), ангиопротектор, улучшающий микроциркуляцию в области послеоперационного рубца, по следующей схеме: на 3-и сутки послеоперационного периода – 100 мг, внутривенно капельно, однократно. Затем пациентки получали данный препарат в течение одного месяца в таблетированной форме.
В течение 6 месяцев послеоперационного периода все пациентки, вошедшие в исследование, получали КК, основными целями назначения данной терапии были надежная контрацепция и снижение риска рецидива миомы матки.
Все пациентки были разделены на 3 основные группы:
- 1-ю группу составили 47 пациенток, получавших КК, содержащий суточную дозу 15 мкг этинилэстрадиола и 0,12 мг этоногестрела (вагинальное кольцо новаринг). Средний возраст больных в этой группе составил 27,4±6,8 года. Из сопутствующей патологии артериальная гипертензия не была выявлена ни в одном случае, избыток массы тела у 2 пациенток.
- 2-ю группу составили 79 пациенток, получавших КК, содержащий 20 мкг этинилэстрадиола и 0,15 мг дезогестрела (новинет). Средний возраст больных в этой группе составил 29,8±4,3 года. Из сопутствующей патологии артериальная гипертензия не была выявлена ни в одном случае, избыток массы тела отмечен у 3 пациенток.
- 3-ю группу составили 37 пациенток, получавших КК, содержащий 30 мкг этинилэстрадиола и 3 мг дроспиренона (мидиана). Средний возраст больных в этой группе составил 34,8±2,9 года. Артериальная гипертензия была выявлена у 16 (9,8%) больных, избыток массы тела у 23 (14,1%) пациенток, ожирение I степени у 12 (7,3%) пациенток. В данную группу мы преднамеренно включили абсолютное большинство пациенток с ожирением и артериальной гипертензий, так как прогестагеновый компонент дроспиренон, входящий в состав мидиана, в отличие от других синтетических гестагенов, обладает антиандрогенным и антиминералкортикоидным действиями, на фоне которых можно ожидать снижение артериального давления при «мягкой гипертензии» и уменьшение массы тела, что представляло особое значение у пациентов данной группы.
Через 6 месяцев после хирургического лечения всем пациенткам с целью исключения или подтверждения рецидива заболевания выполняли ультразвуковое исследование и магнитно-резонансную томографию органов малого таза с внутривенным контрастированием на томографе Signa Infinity EchoSpeed, 1,5 Тл (General Electric). Для контрастирования использовалось контрастное средство для внутривенного болюсного введения гадодиамид (омниксан).
Результаты исследования
В большинстве случаев основной жалобой было бесплодие (41%) и различные нарушения менструального цикла (38%). Жалобы на боли в нижних отделах живота предъявляли 17% больных, нарушение функций тазовых органов (запоры, учащенное мочеиспускание) отмечали 8% пациенток (рис. 3 см. на вклейке). У большинства пациенток (62%) наблюдался регулярный менструальный цикл. Гиперполименорея имела место в 19%, менометроррагия – в 14%, олигоменорея – в 5% случаев (при сочетании с поликистозом яичников) (рис. 4 см. на вклейке).
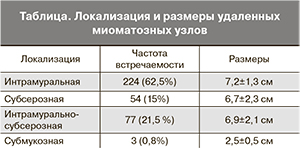
Во всех исследуемых группах среднее количество удаленных миоматозных узлов составило 2,1±1,9 (1–15), средний размер – 6,3±1,9 см (1–15 см). Всего было удалено 358 миоматозных узлов. В 27% случаев была диагностирована единичная миома матки, тогда как в большинстве случаев (73%) миома матки была множественной. Локализация и размеры удаленных миоматозных узлов представлены в таблице.
Через 6 мес после миомэктомии по данным магнитно-резонансной томографии рецидив миомы матки был выявлен у 9 больных (5,5%). При этом только у 4 больных (2,5%) выполнялась повторная операция по поводу рецидива миомы матки, показанием для которой в одном случае стал размер миоматозного узла 5,0 см в диаметре (рис. 5 см. на вклейке), а в трех случаях – наличие деформации полости матки. У 5 больных (3,7%) были диагностированы клинически не значимые миоматозные узлы менее 2,5 см в диаметре без деформации полости матки.
Заслуживает внимания тот факт, что у пациенток с рецидивом миомы матки через 6 месяцев после хирургического лечения количество удаленных миоматозных узлов было примерно в два раза больше и составило 4,5±1,3 (3–15) в сравнении с группой больных с безрецидивным течением послеоперационного периода – 2,1±1,9 (1–11). Также размеры удаленных миоматозных узлов у пациенток с рецидивом были несколько больше и составили 6,3±2,4 см, в группе сравнения – 5,4±2,3 см, однако различия были статистически недостоверны (р>0,05). Возможно, это наблюдение можно объяснить тем, что тяжесть течения заболевания обусловлена генетической предрасположенностью. С этих позиций у больных с крупными размерами узлов и/или множественной миомой матки можно предполагать большую вероятность рецидива заболевания.
При анализе генетических аспектов заболевания было выявлено, что у всех обследованных больных с миомой матки в 38% случаев отмечено наличие данного заболевания у родственников 1-й линии. А у 8 (88,9%) из 9 пациенток с рецидивом после лапароскопической миомэктомии в семейном анамнезе отмечено наличие фибромиомы матки у родственников 1-й линии (в 71,4% у матерей пациенток была выполнена гистерэктомия по поводу миомы матки; в 28,6% – миомэктомия).
Рецидив миомы матки в группе пациенток, получавших КК, содержащий 15 мкг этинилэстрадиола и 0,12 мг этоногестрела (вагинальное кольцо новаринг) был диагностирован в одном случае (2,1%). В группе больных, получавших КК, содержащий 20 мкг этинилэстрадиола и 0,15 мг дезогестрела (новинет), рецидив миомы наблюдался в 3 случаях (3,8%), а в группе женщин, получавших КК, содержащий 30 мкг этинилэстрадиола и 3 мг дроспиренона (мидиана), рецидив был отмечен в 5 случаях (13,5%). Таким образом, обращает на себя внимание корреляция частоты рецидива миомы матки с дозой эстрогенного компонента, входящего в состав КК. Однако этот факт не является основополагающим для возникновения рецидива миомы матки. Группу пациенток, получавших КК, содержащий 30 мкг этинилэстрадиола и дроспиренон (мидиана), составили преимущественно больные с избытком массы тела и ожирением, являющимися важнейшими факторами риска заболевания миомой матки. Однако наиболее целесообразным с нашей точки зрения для такой категории пациенток является назначение 3 мг дроспиренона в сочетании с 20 мкг этинилэстрадиола (КК димиа).
Значимых побочных эффектов, а также случаев возникновения беременности при приеме изучаемых препаратов во всех группах не выявлено.
Заключение
Изучаемые КК могут быть рекомендованы для реабилитации пациенток, перенесших лапароскопическую миомэктомию. Однако подход к выбору гормональной терапии должен быть дифференцирован в зависимости от наличия сопутствующих метаболических нарушений и семейного анамнеза заболевания миомой матки. Так, пациенткам, не имеющим таких сопутствующих заболеваний, как артериальная гипертензия, избыток массы тела и ожирение, а также больным с отягощенным семейным анамнезом, в качестве послеоперационной гормональной терапии должны быть рекомендованы КК с минимальным содержанием эстрогенового компонента. КК, содержащий 30 мкг этинилэстрадиола и дроспиренон, обладающий антиминералкортикоидным действием, может быть рекомендован пациенткам с метаболическим синдромом, а также с целью «стабилизации» эндометрия у данной группы больных. Однако наиболее целесообразным у больных с метаболическим синдромом, на наш взгляд, является назначение дроспиренон-содержащего КК, в состав которого входит 20 мкг этинилэстрадиола (димиа). Несомненно, таким больным в обязательном порядке рекомендуются меры для снижения веса, являющегося значимым патогенетическим фактором развития миомы, и при необходимости – подбор адекватной гипотензивной терапии.



