По данным Федеральной службы государственной статистики, на 1 сентября 2019 г. численность россиян составила 146,7 млн человек. За 9 месяцев 2019 г. естественная убыль населения достигла 259 600 человек, а показатели рождаемости снизились в 80 регионах России. На этом фоне сохранение каждой беременности является приоритетной задачей. Согласно демографической концепции Российской Федерации, к 2025 г. необходимо снизить показатели материнской смертности не менее чем в 2 раза, а рождаемость повысить не менее чем на 2%. С целью достижения поставленных задач ведутся разнонаправленные мероприятия, включающие просветительскую деятельность, научные и профилактические работы.
Залогом успешного течения и исхода беременности, безусловно, является здоровье женщины. Этот фактор относится к модифицируемым, то есть при своевременном выявлении и коррекции болезни возможно минимизировать ее негативное влияние на гестационный процесс. Одной из болезней, повышающих вероятность прерывания беременности и преждевременных родов, является бактериальный вагиноз (БВ) [1].
БВ относится к невоспалительному полимикробному патологическому процессу, в основе которого лежит чрезмерное разрастание условно-патогенной микрофлоры со снижением количества индигенных бактерий. Распространенность БВ у беременных достигает 37%, рецидивирующее течение отмечено в 30–60% случаев [2]. Доказано, что проведение лечения до 17 недель беременности позволяет нивелировать риск развития позднего выкидыша и преждевременных родов, а терапия после 20 недель не приводит к снижению частоты данных осложнений [3]. БВ может рецидивировать через 2–4 месяца, что требует проведения повторного курса лечения. В группах высокого риска с рецидивирующим течением БВ рекомендовано проведение профилактической терапии в 16 и 22–24 недели [4–6]. Для женщин не из группы риска и при бессимптомном течении БВ в любом сроке лечение проводится однократно. Даже при постановке диагноза после 36 недель терапия позволяет снизить риск развития послеродовых осложнений. Контроль излеченности осуществляется через 4–6 недель [6, 7].
Эффективность лечения не превышает 85%, а в 20–60% случаев развивается рецидив болезни [4, 6, 7]. Это связано с отсутствием формирования специфической резистентности организма и утратой контроля над избыточным размножением собственной флоры.
Первым и универсальным барьером для предотвращения бактериальной агрессии являются факторы врожденного иммунитета (непрерывность эпителиального слоя, ферменты, антимикробные пептиды, клеточные рецепторы и фагоциты) [8, 9].
Антимикробные пептиды (AMП) представляют собой группу секретируемых рецепторов распознавания образов, которые необходимы для защиты кожи и слизистых оболочек, а также для уничтожения уже фагоцитированных организмов. AMП создают микробицидный щит, способствующий уничтожению бактерий до момента их прикрепления к поверхности клеток. Они обладают бактерицидным действием против широкого спектра бактерий, грибков, хламидий, паразитов и вирусов [9–11]. Благодаря многообразию АМП бактерии не приобретают к ним устойчивости. Вторая важная функция АМП заключается в контроле над составом комменсальных микроорганизмов, которые колонизируют тело человека [12–14]. То есть можно предположить, что в условиях измененной продукции АМП утрачивается контроль над качественным и количественным составом индигенной флоры.
Универсальной антибактериальной молекулой является дефензин. Он напрямую убивает микроорганизмы и образует микроскопические наносети, которые захватывают клетки в ловушку [12, 14]. Во влагалище и цервикальном канале синтезируются бета-дефензины [10, 14].
Целью нашего исследования явилось изучение продукции АМП дефензина у беременных с БВ.
Материалы и методы
Для решения поставленной цели было проведено комплексное обследование 70 беременных с БВ. Критериями включения стали: срок гестации 12 недель, диагностированный БВ (по критериям Амселя), первая спонтанная одноплодная беременность, отсутствие эндокринных, инфекционных и анатомических причин невынашивания беременности, инфекций, передающихся половым путем, аэробного вагинита и кандидозного кольпита. Все пациентки дали информированное согласие на участие в исследовании, работа была одобрена этическим комитетом РНИМУ им. Н.И. Пирогова.
Возраст пациенток составил от 22 до 34 лет, с медианой 29,3 года. Беременные были рандомизированы на 2 группы: в основной группе (n=40) терапия проведена препаратом «Тержинан» (тернидазол 200 мг, неомицина сульфат 100 мг, нистатин 100 000 ЕД и преднизолон 3 мг) в течение 10 дней, в контрольной группе (n=30) терапия проводилась препаратом хлоргексидина биглюконат в течение 10 дней. После окончания лечения, спустя 10 и 30 дней, а также в 34–36 недель оценивалось состояние микробиоценоза влагалища и изучалась экспрессия дефензина.
Пациентки были обследованы с применением общеклинических и специальных методов (микробиологическое и иммунологическое исследование). При проведении микробиологического исследования забор материала производился из заднего свода влагалища стерильным ватным шпателем. Микробиологическое исследование проводилось четырехкратно: до лечения, через 10 и 30 дней после окончания терапии и в 34–36 недель.
Полученный материал помещался в пробирки с транспортной средой и поглотителем кислорода Эймса (Medical Wire Англия). Пробирки в течение 1,5–2 ч доставляли в лабораторию ГУ МНИИЭМ им. Г.Н. Габричевского, где проводился посев на селективные и дифференциально-диагностические среды (Эндо, агар Сабуро, 5% кровяной агар, агар МРС-4). Посевы инкубировались в течение 24–48 ч, видовую идентификацию выделенных бактерий проводили масс-спектрометрическим методом. С помощью стереоскопического микроскопа подсчитывали число различных видов колоний в каждом секторе и рассчитывали количество lg КОЕ/мл.
Иммунологическое исследование проводилось на кафедре иммунологии МБФ ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». Была определена экспрессия дефензина в эпителиальных клетках многослойного плоского эпителия влагалища. Использовались наборы для выделения РНК, реакции обратной транскрипции и полимеразной цепной реакции (ПЦР) в режиме реального времени. Забор материала проводился при помощи цитощеток из заднего свода влагалища (до лечения, через 10 и 30 дней после окончания терапии и в 34–36 недель), переносился в пробирки и замораживался при температуре -25°С. Реакцию обратной транскрипции проводили в объеме 25 мкл. Реакционная смесь содержала 3 мкл РНК-матрицы, 1 мкл random («Синтол», РФ) и 9 мкл ddH2O. Смесь инкубировали при температуре +75°С в течение 5 минут, далее пробирки охлаждали до +4°С. Полученную кДНК хранили при -70°С. Реакцию ПЦР в режиме реального времени проводили в объеме 25 мкл с использованием праймеров фирмы «Синтол» (РФ). Подсчет уровня экспрессии целевых генов оценивался относительно гена домашнего хозяйства – β-актина.
Статистическая обработка результатов проводилась с использованием программного обеспечения Microsoft Excel 2016 и Statistica 6.1. Для описания количественных данных, имеющих нормальное распределение, использовались среднее арифметическое (М) и стандартное отклонение (SD).
Результаты
Беременные обеих групп были сопоставимы по возрасту, социальному статусу и заболеваемости. В структуре экстрагенитальных заболеваний у женщин преобладали патология органов желудочно-кишечного тракта (47,5% и 53,3% соответственно), хронические инфекционные заболевания дыхательной (12,5% и 13,3%) и мочевыделительной систем (7,5% и 10%). Среди гинекологических заболеваний наиболее часто выявлялись кандидозный кольпит (75% и 70%), эктопия шейки матки (70% и 73,3%), ретенционные кисты яичников (20% и 16,6%).
Особенности течения беременности отражены в таблицах 1 и 2.

Течение I и II триместров беременности не имело значимых различий между группами. Однако у пациенток контрольной группы в III триместре чаще развивались угроза преждевременных родов и инфекции мочевыводящих путей (р=0,05).
БВ был диагностирован у всех беременных в I триместре (как критерий формирования выборки), после проведенного лечения в основной группе рецидив развился в 10% (у 3 во II триместре и у 1 женщины в III триместре). В контрольной группе суммарная частота рецидивов БВ составила 43,3% (у 5 во II триместре и у 8 женщин в III триместре), что значимо превышало показатели основной группы.
Роды в срок произошли у 97,5% беременных основной группы, одна пациентка была родоразрешена в 36 недель в связи с тяжелой преэклампсией. В контрольной группе срочными родами закончились 90% беременностей, 10% пациенток родили преждевременно (2 родов в 34–35 недель, 1 – в 36 недель).
Результаты микробиологического исследования
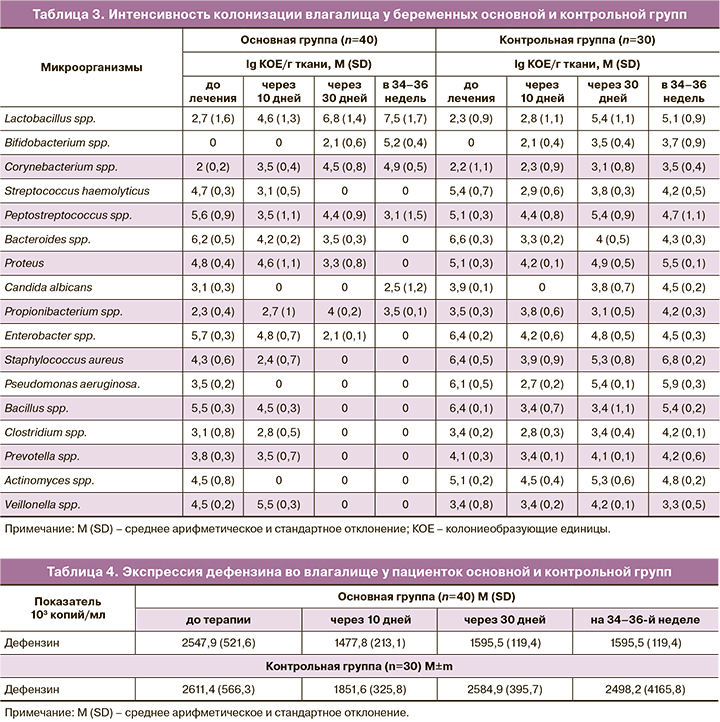
При оценке микробиоценоза половых путей за показатели эубиоза принимались содержание лактобацилл не менее 105 КОЕ/мл и наличие условно-патогенной микрофлоры не более 103 КОЕ/мл. В таблице 3 приведены количественные показатели микрофлоры у пациенток обеих групп.
У пациенток как основной, так и контрольной групп до начала терапии интенсивность колонизации лактобактериями была крайне низкой на фоне многообразного по составу и значительного по титру роста условно-патогенных микроорганизмов. После курса терапии отмечено постепенное восстановление роста протективных бактерий, достигшее максимальных значений через 30 дней после окончания лечения. В контрольной группе число лакто- и бифидобактерий не достигло показателей, характерных для нормоценоза. В 34–36 недель беременности у пациенток контрольной группы все еще сохранялся избыточный рост условно-патогенных микроорганизмов на фоне относительного снижения титра лакто- и бифидобактерий. При сравнении групп обнаружено, что у беременных контрольной группы количество (КОЕ/мл) аэробных (стрептококков, стафилококков, бацилл) и анаэробных условно-патогенных микроорганизмов (пептострептококков, актиномицет, бактероидов) превышало аналогичные в основной группе (р=0,05).
У пациенток основной группы наилучшие показатели микробиоценоза были отмечены на 30-й день после окончания лечения, в сроке 34–36 недель также сохранялся нормоценоз.
Результаты иммунологического исследования
Из показателей факторов врожденного иммунитета мы изучали экспрессию генов дефензина в эпителии влагалища. Дефензин является универсальной антибактериальной молекулой, способной ограничивать размножение бактерий и репликацию вирусов, а также контролирующей состав микробиоценоза.
В таблице 4 представлены показатели экспрессии дефензина у пациенток обеих групп.
На фоне БВ экспрессия дефензина значительно повышена, что отражает напряженность факторов мукозального иммунитета в условиях чрезмерного размножения условно-патогенных микроорганизмов. В группе беременных, которым проведена терапия препаратом «Тержинан», через 10 дней уровень дефензина снизился в 1,7 раза и сохранялся примерно в тех же значениях к 30-му дню. Исследование, проведенное на сроке 34–36 недель, подтвердило неизменно стабильную продукцию дефензина, что сочеталось с сохраняющимся нормоценозом влагалища.
В контрольной группе снижение уровня дефензина отмечено через 10 дней терапии в 1,4 раза, но к 30-му дню экспрессия фактора практически вернулась к исходным до терапии показателям и сохранялась таковой до окончания беременности. С учетом выявленного высокого процента рецидивов БВ у пациенток контрольной группы можно предположить, что повышенная продукция дефензина отражает реакцию организма на чрезмерное размножение бактерий и может служить дополнительным критерием оценки нормоценоза.
Обсуждение
БВ является невоспалительным полимикробным процессом. В его основе лежит чрезмерное размножение условно-патогенных бактерий, формирование ими биопленок, позволяющих уклоняться от антибактериальных веществ и лежащих в основе развития серьезных акушерских осложнений. Высокая частота рецидивов БВ связана как с резистентностью индигенной флоры, так и с неполноценной реакцией мукозального иммунитета. Вся система врожденного иммунитета предназначена для быстрого реагирования на генетически чужеродные агенты. В случае развития БВ возбудителем является собственная флора, поэтому макроорганизм не способен эффективно ей противостоять.
В проведенном исследовании мы изучили состояние микробиоценоза влагалища с точки зрения общей бактериальной обсемененности, количества и видового состава бактерий, показателей врожденного иммунитета и эффективности проводимого лечения.
Сопоставление клинических, микробиологических и иммунологических данных позволяет предположить, что в основе всего лежит изначальный неполноценный иммунный ответ макроорганизма, в связи с чем происходит чрезмерное и бесконтрольное размножение индигенной флоры с вытеснением протекторных лакто- и бифидобактерий. В случае своевременного и полноценного лечения можно добиться низкой частоты рецидивирования БВ и снижения риска развития преждевременных родов. В группе пациенток, пролеченных неспецифическим антисептическим средством, эффект сохранялся недолго, и уже к 30-му дню биоценоз влагалища был представлен преимущественно условно-патогенными бактериями. Частота рецидива БВ после антисептической терапии в нашем исследовании достигала 43,3%, а частота преждевременных родов у этих пациенток – 10%. Данная ситуация свидетельствует о том, что терапия с применением антисептиков не позволяет добиться стойкого эффекта по контролю над колонизацией микроорганизмами. Предпочтение в выборе метода лечения БВ должно отдаваться средствам с антибактериальным действием [4, 5, 6, 15].
Уровень дефензина был сопоставим с бактериальной обсемененностью эпителия влагалища. Его экспрессия была высокой у всех беременных с БВ, значительно снижалась после 10 дней терапии вне зависимости от типа лечения, то есть напрямую зависела от степени бактериальной обсемененности. Стойкий эффект был отмечен только в основной группе, где уровень дефензина сохранялся в пределах нормы и через 30 дней после окончания лечения, и в 34–36 недель беременности.
В контрольной группе экспрессия дефензина постепенно повышалась к 30-му дню после окончания терапии и отражала меняющуюся картину влагалищного биоценоза. Именно в этой группе был отмечен высокий процент преждевременных родов, что объяснимо с точки зрения взаимосвязи БВ и риска развития акушерских осложнений [4].
По уровню экспрессии дефензина можно косвенно судить о степени бактериальной обсемененности изучаемого биотопа: чем выше уровень колонизации условно-патогенных бактерий, тем выше продукция антибактериальных пептидов [15].
Заключение
На фоне БВ экспрессия дефензина значительно повышена. В основной группе через 10 дней уровень дефензина снизился в 1,7 раза и сохранялся к 30-му дню и в 34–36 недель. В контрольной группе через 10 дней терапии снижение уровня дефензина произошло в 1,4 раза, к 30-му дню экспрессия фактора вернулась к исходным показателям и сохранялась до окончания беременности.



