Аденомиоз рассматривается, как заболевание матки, характеризующееся наличием гетеротопических желез и/или стромы эндометрия в миометрии. Миграция клеток эндометрия в миометрий сопровождается мышечной гипертрофией различной степени выраженности. Аденомиоз следует определять, как двухкомпонентное заболевание, включающее эктопию желез и стромы эндометрия, а также второй элемент в виде мышечных изменений (гипертрофии, гиперплазии и фиброза).
Диагноз аденомиоза верифицируется на основании гистологического исследования. Повышенное разрешение трансвагинального ультразвукового исследования (TVS), 3D-ультрасонографии (3D-TVS) и магнитно-резонансной томографии (МРТ) позволяет диагностировать аденомиоз по характерной визуальной картине и четко дифференцировать соединительную зону эндомиометрия. Внутренний миометрий, прилегающий к эндометрию, или соединительная зона (JZ), обычно отображается как тонкая гипоэхогенная полоска с помощью TVS и полосы слабого сигнала, прилегающей к эндометрию, с помощью МРТ.
Аденомиоз чаще всего клинически диагностируется у женщин в возрастной группе от 40 до 50 лет. Диагностика базируется на наличии классических симптомов аденомиоза – дисменореи и меноррагии. Классическая форма аденомиоза описана без учета возможного сопутствующего наружного эндометриоза. Однако недавние исследования показали, что аденомиоз может сосуществовать с эндометриозом у молодых женщин, что указывает на их общий патогенез [1]. Есть предположение, что аденомиоз может обусловливать неудачную имплантацию у молодых женщин с эндометриозом [2]. Бесплодие является менее частой жалобой при классической форме аденомиоза, однако поскольку все больше женщин откладывают беременность до 30–40 лет, проблема бесплодия при аденомиозе становится все более актуальной.
Мы провели поиск в PubMed по ключевым словам: аденомиоз или аденомиома; соединительная зона и бесплодие или вспомогательные репродуктивные технологии (ВРТ), ЭКО, беременность или репродуктивный исход, аденомиоз и лечение (хирургия, лечение, гонадолиберин, гонадотропин-рилизинг-гормон). Всего было просмотрено 726 рефератов и статей по этой теме. Были найдены, прочитаны и оценены дополнительные ссылки, в результате чего было зафиксировано еще 277 статей. Проведен системный анализ данных по аденомиозу и его хирургическому лечению. Данные о репродуктивных исходах и аденомиозе были отображены в виде графиков и простого объединенного анализа (фиксированная модель). Никакого анализа чувствительности, регрессии или анализа качества исследований не проводилось, поскольку метаанализ, включающий большинство исследований, уже был проведен [3].
Визуализационная диагностика аденомиоза
Исследования аденомиоза и фертильности основаны на диагностике с помощью изображений без гистологической проверки. Большие различия в интерпретации и использовании критериев изображения являются большим препятствием в этих исследованиях. Выявлено, что один диагностический ультразвуковой критерий присутствовал у 21% женщин, три критерия – у 14% женщин [4]. У женщин, по крайней мере, с четырьмя сонографическими критериями аденомиоза (8,4% женщин) наблюдалась связь между количеством сонографических критериев и выраженностью меноррагии [5]. Эти данные указывают на наличие большого количества неспецифических изменений эхокартины миометрия, которые не являются аденомиозом, что подчеркивает важность разработки строгих критериев для диагностики изображений.
Особенности изображения аденомиза обусловлены наличием гетеротопической ткани эндометрия и сопутствующую гипертрофию миометрия. Характеристики TVS, 3D-TVS и МРТ аденомиоза [6] приведены в таблице. Признаки эктопического эндометрия очень специфичны, тогда как признаки мышечных изменений менее специфичны как при TVS, так и по МРТ [7]. Изменения в JZ можно визуализировать с помощью МРТ или 3D-TVS, при этом толщина и неравномерность JZ являются признаками аденомиоза. В одном из исследований было показано, что эффективность 3D-TVS в диагностике аденомиоза несколько выше, чем 2D-TVS [8].
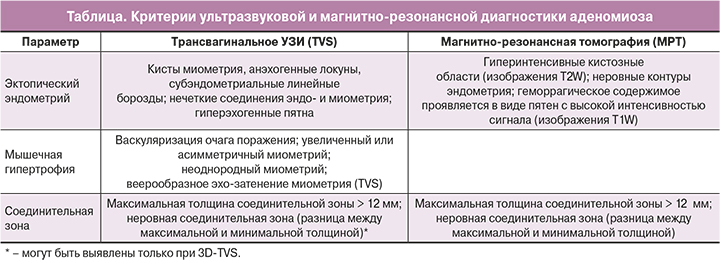
Значение различных признаков при установлении диагноза остается до конца неясным, но для визуальной диагностики аденомиза требуется наличие более одного критерия, а часто и три критерия, при этом в матке всегда следует искать четкие признаки гетеротопического эндометрия [9].
Исследования с последующим гистологическим исследованием препаратов удаленной матки показали, что наличие аденомиоза особенно вероятно, когда толщина JZ составляет не менее 12 мм на МР-изображениях, но другие исследования определяют максимальную толщину 10 мм (JZ макс.) в качестве порогового значения. [10].
В обзоре Champaneria et al., которые включали только исследования высокого качества с гистологическим подтверждением, общие чувствительность и специфичность методов визуализационной диагностики (УЗИ и МРТ) составили: для УЗИ – 72% (65–79%) и 81% (77–85%), для МРТ – 77% (67–85%) и 89% (84–92%), соответственно [11]. Таким образом, наибольшая чувствительность и специфичность отмечались у женщин с выраженной симптоматикой, которым была выполнена гистерэктомия, что логично.
Однако использование только УЗИ и МРТ для диагностики аденомиоза у женщин с бесплодием имеет явные ограничения, поскольку в популяции женщин с бесплодием более выражена доля женщин с минимальными клиническими проявлениями аденомиоза.
Соединительная зона (JZ)
Изменение гладких мышц в JZ может предшествовать аденомиозу. Эти изменения можно рассматривать как стадию 0 аденомиоза с микротравмами на границе эндометрия, которые могут в дальнейшем перерасти в аденомиоз. Изменение гладкой мускулатуры в JZ уже может рассматриваться как заболевание, а именно разрушение единицы эндометрия-субэндометрия и миометрия [12]. Gordts предположил, что изменения в соединении с максимальной толщиной JZ ≥8 и <12 мм классифицируются, как гиперплазия или то, что можно назвать «стадией 0» заболевания [13].
Мышечные изменения и морфология при аденомиозе широко варьируется от небольшого локализованного расширения JZ до массивной гиперплазии и фиброза миометрия, которые, вероятнее всего, изменяют нормальные пластичность и тонус матки, а также деформируют контур полости эндометрия. Влияние на перистальтику маточных труб, сокращение матки и фертильность может различаться в соответствии с вариациями морфологических изменений, но нет единого мнения о системе классификации в отношении степени заболевания на основе визуальной картины при УЗИ и МРТ. Так, при трехмерном исследовании толщины соединительной зоны у 82 женщин фертильного возраста через 6–12 месяцев после первых родов признаков аденомиоза не было, но у 12% из них была зафиксирована толщины JZ 8,0–12,0 мм [14].
Прицельно следует выявлять признаки аденомиоза и особенно его минимальные проявления в виде изменений соединительной зоны у женщин с первичным и вторичным бесплодием неясного генеза, невынашиванием беременности и отказом от повторного использования ВРТ. Толщина JZ (JZ макс) была больше в группе с повторными выкидышами по сравнению с контрольной группой (5,8±0,7 мм против 5,0±1,1 мм) [15].
Аденомиоз в ходе 3D-TVS был диагностирован у 38% женщин с невынашиванием беременности и у 35% женщин с повторной неудачей ВРТ. Морфологическая оценка полости эндометрия показала умеренную деформацию у 23% женщин с аденомиозом, у 10% – тяжелое поражение с псевдо Т-образной маткой [16]. У женщин с наружным эндометриозом часто наблюдается утолщенная и неравномерно утолщенная JZ. Так, в одном из исследований сообщается, что утолщение JZ (JZ макс> 10 мм) на МРТ было зарегистрировано у 79% женщин с лапароскопически подтвержденным наружным генитальным эндометриозом [12]. В трех других исследованиях сообщалось о более низкой распространенности – 27, 35 и 38% соответственно, но с использованием строгих критериев изменений JZ для диагностики аденомиоза, что отражено в таблице. Таким образом, аденомиоз в среднем имеет место у одной трети женщин, которым была выполнена операция по поводу эндометриоза. Более того, наличие и глубина инфильтрации аденомиоза были связаны со степенью эндометриоза [17].
Мышечная перистальтика в соединительной зоне важна для транспорта ооцитов и сперматозоидов. Сокращения матки зависят от уровня гормонов и могут быть визуализированы и оценены при помощи ультразвука; сокращения, по-видимому, влияют на имплантацию, способствуя транспорту сперматозоидов. Мышечные изменения в соединительной зоне могут свидетельствовать о нарушении нормальной перистальтики, что может быть одной из причин бесплодия и невынашивания беременности при минимальных формах аденомиоза [18].
Таким образом, инструментальная визуализация позволяет диагностировать минимальные изменения соединительной зоны. Увеличение толщины миометрия без визуальных признаков аденомиоза, по данным Youm et al., было ассоциировано со снижением репродуктивной способности женщина, а именно отражалось на количестве живорождений. Причем, в этих случаях фиксировалось утолщение миометрия именно за счет соединительной зоны, что подтверждает данные других авторов о влиянии этого факта на фертильность [19].
В одном из проспективных исследований 152 женщинам было выполнено МРТ до запланированного ЭКО [20]. Увеличение толщины JZ от 7 мм до 10 мм достоверно коррелировало с повышением частоты неудачной имплантации при ЭКО (63 и 26% соответственно). При JZ макс менее 10 мм частота наступления беременности составила 63% против 14% при JZ макс более 10 мм. Частота неудач имплантации составила 96% у пациентов со средней толщиной JZ > 7 мм и максимальной JZ > 10 мм по сравнению с 38% в других группах пациентов. Эти исследования указывают на увеличение неблагоприятных исходов имплантации в зависимости от степени выраженности изменений JZ при аденомиозе, однако необходимы дополнительные уточняющие исследования.
Взаимосвязь аденомиоза и частоты наступления беременности, а также ее исходы
Влияние аденомиоза на исход ЭКО/ИКСИ было описано в общей сложности в 6 исследованиях. Два исследования были исследованиями случай–контроль [21, 22] и 4 когортных исследований [23–26]. Влияние аденомиоза на частоту наступления беременности (как спонтанной, так и после ВРТ) после операции по поводу ректовагинального и колоректального эндометриоза описано в двух исследованиях [27, 28]. Провести различие между изолированным аденомиозом и аденомиозом в сочетании с наружным генитальным эндометриозом в исследованиях ЭКО/ИКСИ не удалось, а также было невозможно извлечь дополнительные данные относительно взаимосвязи степени аденомиоза и исходов беременностей.
Одно исследование случай–контроль было проведено в популяции женщин, в цикле ВРТ которых использовали донорские ооциты [22]. В этом исследовании сообщалось только о частоте беременностей за цикл: она не снижалась, однако частота выкидышей была значительно выше в группе с аденомиозом.
В когортных и случай–контроль исследованиях, посвященных анализу наступления и исходов беременностей у женщин с аденомиозом, а также перенесших операции по поводу глубокого эндометриоза (ректовагинального и колоректального) и у женщин с бесплодием после ЭКО/ИКСИ получены следующие данные. В абсолютном большинстве исследований пациентки были рандомизированы по возрасту [21–26]. В когортных исследованиях частота наступления беременности была достоверно ниже у женщин с аденомиозом. Общий показатель наступления беременности у женщин с аденомиозом составил 0,73. После оперативного лечения по поводу глубокого эндометриоза данный показатель был достоверно ниже – 0,37.
В мета-анализе 2014 г. изучалось влияние аденомиоза на исход ЭКО/ИКСИ [3]. Этот анализ включал девять различных исследований и основывался на результатах обследования 1865 женщин, у 306 из которых был диагностирован аденомиоз. Авторы пришли к выводу, что аденомиоз снижает вероятность факта наступления беременности в цикле ВРТ с одной стороны, и увеличивает риск потери беременности на ранних сроках с другой стороны. Неблагоприятное влияние аденомиоза на исходы ВРТ при сочетании с глубоким эндометриозом также описано и в другом обзоре [2].
В двух когортных исследованиях с участием женщин с эндометриозом связи с показателем частоты наступления беременности не было обнаружено [23, 24]. Однако показатель частоты наступления беременности у женщин с аденомиозом был достоверно снижен до 0,53, что подтверждалось и в других независимых исследованиях [27].
Сравнительные данные различных исследований аденомиоза и фертильности представлены на рисунке 1.

Лечение аденомиоза у пациентов с бесплодием
Возможные варианты медикаментозной терапии лечения описаны в недавнем обзоре [29]. Доказано, что постоянное использование комбинированных оральных контрацептивов, высоких доз прогестинов и селективных модуляторов рецепторов прогестерона может временно контролировать симптомы. Более того, использование внутриматочной спирали, высвобождающей левоноргестрел, даназола, ингибиторов ароматазы и агонистов гонадотропин-рилизинг гормона (аГнРГ) может временно вызвать регресс аденомиоза.
Применение аГнРГ
Лечение аГнРГ с добавлением к терапии эстрогенов широко используется для лечения аденомиоза, после проведения которой возможно наступления беременности [29]. Лечение с использованием аГнРГ уменьшает размер и демаркацию аденомиотических поражений, что подтверждают данные МРТ [30], а лечение положительно влияет на маркеры вероятности имплантации эндометрия [31].
По данным двух групп авторов, аденомиоз не был связан с более низким показателем частоты наступления беременностей в длинном протоколе применения аГнРГ [22, 24]. Однако оба исследования были ретроспективными и нельзя было учесть влияния других факторов.
На данный момент вопрос эффективных схем подготовки эндометрия, схем ВРТ у женщин с аденомиозом не может считаться до конца изученным. В одном из недавних исследований были сравнены исходы у пациентов с аденомиозом, перенесших перенос размороженных эмбрионов после длительной подготовки эндометрия с помощью терапии гонадолиберином-альфа перед заместительной гормональной терапией [32]. В группе женщин, предварительно получавших аГнРГ, клиническая беременность, имплантация и текущие показатели частоты наступления беременности были достоверно выше, чем у женщин, не получавших предварительное лечение аГнРГ.
В другом исследовании с участием женщин с аденомиозом подобная схема лечения не оказала значимого влияния на частоту наступления беременности и ее исход, особенно после переноса разамороженных эмбрионов [33].
Циторедуктивная хирургия
Хирургические методы лечения аденомиоза включают лапароскопический или лапаротомный доступ с частичным или полным удалением тканей аденомиоза. К удалению аденомиотической ткани можно подойти с помощью классической техники миомэктомии, включающей те же шаги, что и при миомэктомии. Аденомиотическая ткань рассекается и иссекается либо диатермией, либо скальпелем, а стенки матки сшиваются в несколько слоев, часто с использованием различных методов закрытия тканей для восстановления толщины миометрия. Эти методы закрытия включают перекрытие оставшегося серозно-мышечного слоя (лоскутов) двойным или тройным слоем [34]. Ушивание выполняется U-образными швами, Z-образными или узловыми швами. Разрез может быть поперечным или продольным, клиновидным или поперечным [35]. В нескольких исследованиях применялось комбинированное медикаментозное (аГнРГ) и хирургическое лечение [34, 36–38].
Исход беременностей после циторедуктивной хирургии представлен на рисунке 3, на котором объединены опубликованные результаты исследований женщин, пытающихся зачать ребенка после циторедуктивной операции по поводу аденомиоза [39–43]. Часть женщин использовали ВРТ, в то время как другие забеременели самостоятельно без дополнительного лечения.
Всего у 338 женщин с аденомиозом было зарегистрировано 160 беременностей, 126 родов и 33 выкидыша. После перенесенной операции частота родов и индекс частоты беременностей были лишь немного выше, чем у женщин с аденомиозом, перенесших ЭКО/ИКСИ (рис. 2). Однако все крупные исследования результатов хирургического лечения включали женщин со средним возрастом более 38 лет, часто с неудачами ВРТ, повторными абортами и бесплодием в течение нескольких лет, в то время как женщины, получавшие ЭКО/ИКСИ, имели более молодой средний возраст – 33–35 лет [37, 42, 44].
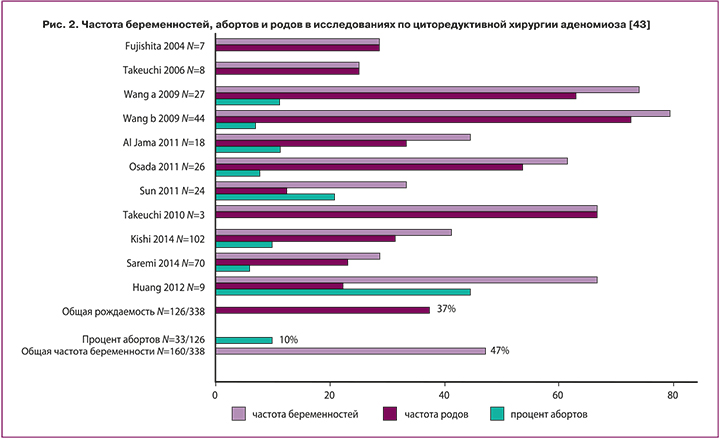
В подробном обзоре, проведенном в 2014 г., сообщалось, что хирургическое лечение аденомиоза были эффективными для облегчения симптомов заболевания, а частота родов была выше (50%), чем частота родов, отраженная на рисунке 2 [44]. В этот обзор были включены первые 147 бесплодных женщин с аденомиозом, которым было выполнено хирургическое лечение. Эти первые опубликованные исследования включали в основном полное удаление локализованного аденомиоза у более молодых женщин. Недавние же исследования включали женщин с обширным аденомиозом [45]. Kishi Y. et al. включили в свое исследование 27 женщин старше 40 лет и пришел к выводу, что циторедуктивная операция не повлияла на исход фертильности у женщин данной возрастной группы. Таким образом, на реализацию репродуктивной функции после перенесенной операции влияет в основном исходная степень поражения, а также исходный репродуктивный потенциал, который закономерно выше у более молодых женщин.
Wang P.H. et al. сравнили 28 женщин, которые перенесли операцию и 37 женщин, которые получали только медикаментозную терапию аГнРГ, и обнаружил более высокую частоту родов (33% против 8%) в группе пациенток после оперативного лечения [43]. Он также сравнил результаты терапии аГнРГ в сочетании с хирургическим лечением и только хирургического лечения (рис. 2), где не обнаружил разницы в исходе беременности и частоте живорождений. Однако следует отметить, что женщины в группе аГнРГ + хирургическое лечение были старше, чем женщины в группе получивших только хирургическое лечение.
Разрыв матки во время беременности является одним из основных осложнений после операции по поводу аденомиоза и был зарегистрирован в двух случаях после обширных операций [46]. В другом исследовании при двух из 23 беременностей после циторедуктивных операций произошел разрыв во втором триместре беременности. Из пяти женщин с толщиной миометрия после операции менее 7 мм только у двоих беременность протекала без осложнений. Авторы пришли к выводу, что оптимальная толщина стенки для зачатия и предотвращения разрыва после циторедуктивной хирургии должна составлять от 9 до 15 мм [42].
Таким образом, оперативное лечение аденомиоза с сохранением матки эффективно у женщин, как правило, моложе 40 лет. При этом риск разрыва матки после операции, отсутствие данных о его профилактике приводят нас к выводу, что подобные операции должны быть тщательно спланированы и выполняться в специализированных стационарах опытными хирургами.
Заключение
В клинических исследованиях с наличием аденомиоза связывают такие репродуктивные проблемы, как снижение вероятности успешной имплантаций плодного яйца, самопроизвольное прерывание беременности на ранних сроках и преждевременные роды.
В настоящее время не разработаны строгие критерии оценки степени распространения аденомиоза в ходе ультразвукового и магнитно-резонансного исследования. Соответственно, выбор наиболее оптимальных, основанных на фактических данных вариантов лечения аденомиоза часто затруднен из-за отсутствия данных о степени изменений. Это приводит к ухудшению результатов лечения аденомиоза, в первую очередь в плане восстановления репродуктивной функции.
Хирургические вмешательства по поводу аденомиоза могут значительно уменьшить клинические симптомы и повысить шансы на наступление беременности. Но при этом увеличивается риск разрыва матки.
Таким образом, можно прийти к неутешительному выводу, что на сегодняшний день не существует эффективных вариантов лечения, которые не препятствовали бы зачатию и успешному вынашиванию беременности. Поэтому крайне важно оценить роль хирургического и других методов лечения в каждом конкретном случае.
Следовательно, оправдано направлять женщин с аденомиозом и привычным невынашиванием беременности, либо с повторной неудачей ВРТ в те немногие центры и стационары, которые специализируются на лечении аденомиоза, что может значительно повысить шансы на благоприятный репродуктивный исход.



