Проблема профилактики и лечения массивного акушерского кровотечения всегда остается одной из наиболее актуальных. Одной из основных задач, стоящих перед акушером-гинекологом, анестезиологом и трансфузиологом при возникновении массивного акушерского кровотечения, является адекватное, качественное и своевременное возмещение кровопотери [1–3]. В последние годы существенно возросла актуальность проблемы безопасности трансфузий крови и ее компонентов [4–6]. Постоянно возрастающая угроза заражения пациентов возбудителями ВИЧ-инфекции, сифилиса, гепатитов и других, не менее опасных инфекций, передаваемых при переливании компонентов и препаратов крови, опасность посттрансфузионных осложнений, обусловленных аллоиммунизацией реципиента, требуют снижения числа донорских трансфузий [7, 8]. Поиск эффективных средств трансфузионной безопасности, оптимизация инфузионной терапии привели к разработке и внедрению альтернативных методов трансфузионной медицины − кровесберегающих технологий [9–13]. Одним из наиболее значимых методов кровесбережения для адекватного трансфузионного обеспечения эритроцитами при развитии кровотечения является аппаратная интраоперационная реинфузия аутоэритроцитов (ИРА). С появлением современных сепараторов крови (аппараты типа «Cell-saver», «CATS», «Xstra»и др.) появилась возможность отмывания собранной из полости крови аппаратным способом. Суть метода проста: кровь из операционной раны аспирируется с помощью стерильного насоса в специальную емкость, где смешивается с антикоагулянтом, затем поступает в сепаратор, где во время вращения промывается физиологическим раствором, происходит гемоконцентрация и конечным продуктом является эритровзвесь с гематокритом порядка 55–60%. Вместе с тем отношение к ИРА в акушерстве по-прежнему остается неоднозначным в связи с возможностью таких осложнений, как эмболия околоплодными водами, резус-сенсибилизация, контаминация [14, 15]. Цель настоящего исследования: оценка эффективности и безопасности аппаратной реинфузии аутоэритроцитов при операции кесарева сечения.
Материал и методы исследования
Были обследованы 140 беременных, которым выполнена ИРА, из них у 30 женщин данная процедура сочеталась с трансфузией аутоплазмы. Сроки родоразрешения составили 32–38 недель. При обследовании женщин использовались клинические и лабораторные методы: показатели гемоглобина, эритроцитов, гематокрита определяли при помощи гематологического анализатора ВТ-2100 (USA). Биохимические показатели крови определяли по стандартным методикам на автоанализаторе «Ultra» (фирмы «KOHE», Финляндия). Исследование системы гемостаза – определение концентрации фибриногена проводилось на автоматическом анализаторе «Behring Coagulation Timer» (Германия). Тромбоэластография цельной крови (ТЭГ) проводилась на тромбоэласторгафе фирмы «Hellige» (Германия). Оценивались параметры хронометрической (r+k) и структурной (ma, индекс тромбодинамического потенциала (ИТП)) коагуляции. Для определения объема кровопотери использовали методы: визуальный – оценивалась интенсивность пропитывания операционного материала и белья кровью; гравиметрический – проводилось взвешивание операционного материала и вычисление объема кровопотери по формуле Либова: объем кровопотери = В/2×30% (при кровопотере более 1000 мл), где В – вес салфеток, 30% – величина ошибки на околоплодные воды и дезинфицирующий раствор. Определение объема кровопотери на основании показателей аппарата типа «Cell-saver» при автоматическом режиме работы с получением аутоэритроцитов с гематокритом 55–60% проводился по следующей формуле: ВК= 2 × V эр. х К, где ВК – величина кровопотери (мл); 2 – константа, учитывающая гемоконцентрацию получаемой эритровзвеси (гематокрит 60–65%), при гематокрите 30–40% коэффициент концентрации 1.1–1.5; К-коэффициент потерь на гемолиз, потери вне раны и на операционном материале (в среднем 1,5).
 ИРА проводилась с использованием «Cell-Saver 5+», который обеспечивает сбор теряемой крови из операционной раны, отмывание эритроцитов в центрифуге и возврат эритровзвеси в сосудистое русло пациентки. Показаниями для проведения методов кровесбережения у беременных были: тяжелая преэклампсия; антифосфолипидный синдром, гиперкоагуляционный синдром и терапия антикоагулянтами во время беременности; экстрагенитальная патология (болезнь Марфана, токсический гепатит, пересаженная доля печени); множественная миома и планируемое расширение объема оперативного вмешательства; многоводие, многоплодие после программы вспомогательных репродуктивных технологий; предлежание, врастание плаценты; кровотечения в анамнезе и осложнения при предыдущих трансфузиях; сочетание показаний у больных с редкими группами крови; с варикозным расширение вен матки; гемангиомой органов малого таза; с отказом пациентки с анемией от переливания донорских компонентов крови.
ИРА проводилась с использованием «Cell-Saver 5+», который обеспечивает сбор теряемой крови из операционной раны, отмывание эритроцитов в центрифуге и возврат эритровзвеси в сосудистое русло пациентки. Показаниями для проведения методов кровесбережения у беременных были: тяжелая преэклампсия; антифосфолипидный синдром, гиперкоагуляционный синдром и терапия антикоагулянтами во время беременности; экстрагенитальная патология (болезнь Марфана, токсический гепатит, пересаженная доля печени); множественная миома и планируемое расширение объема оперативного вмешательства; многоводие, многоплодие после программы вспомогательных репродуктивных технологий; предлежание, врастание плаценты; кровотечения в анамнезе и осложнения при предыдущих трансфузиях; сочетание показаний у больных с редкими группами крови; с варикозным расширение вен матки; гемангиомой органов малого таза; с отказом пациентки с анемией от переливания донорских компонентов крови.
К числу абсолютных противопоказаний к аппаратной ИРА относили: наличие в брюшной полости гнойного и кишечного содержимого; наличие в излившейся крови веществ, противопоказанных к введению в сосудистое русло (перекись водорода, дистиллированная вода, спирт, гемостатические препараты на основе коллагена и др.) [16, 17].
Полученные результаты были статистически обработаны с помощью программ Excel v.8.0® фирмы Microsoft и Statistica for Windows v.5.1® фирмы Stat Soft Inc. (США) по стандартным методикам вычислений показателей описательной статистики, корреляционного, регрессионного и дисперсионного анализов.
Результаты исследования и их обсуждение
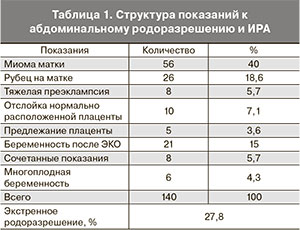
 Из клинической характеристики обследованных женщин следует, что большинство беременных находились в возрастной категории 30–34 года. При анализе экстрагенитальных заболеваний в анамнезе выявлено нарушение жирового обмена у 17,8%, болезнь Гоше – у 0,7%, Марфана – у 1,42%, пересаженные доли печени – у 1,42%, токсический гепатит – у 0,7% пациенток. Значительный удельный вес среди заболеваний составила миопия различной степени тяжести – 28,5%. Обращает на себя внимание высокий процент миомы матки – 47% женщин. Течение данной беременности осложнилось угрозой прерывания беременности у 70% обследованных пациенток, преэклампсией – 42,8%. Беременность протекала на фоне анемии у 36,6% женщин. Аутоиммунные нарушения имели место у 37,8%. Наиболее частыми показаниями для операции кесарева сечения в группе исследования (табл. 1) были: миома матки – 40%, рубец на матке после предыдущих операций кесарева сечения – 18,6%. Третьим по частоте показанием для абдоминального родоразрешения и ИРА была беременность, наступившая в результате ЭКО (15%).
Из клинической характеристики обследованных женщин следует, что большинство беременных находились в возрастной категории 30–34 года. При анализе экстрагенитальных заболеваний в анамнезе выявлено нарушение жирового обмена у 17,8%, болезнь Гоше – у 0,7%, Марфана – у 1,42%, пересаженные доли печени – у 1,42%, токсический гепатит – у 0,7% пациенток. Значительный удельный вес среди заболеваний составила миопия различной степени тяжести – 28,5%. Обращает на себя внимание высокий процент миомы матки – 47% женщин. Течение данной беременности осложнилось угрозой прерывания беременности у 70% обследованных пациенток, преэклампсией – 42,8%. Беременность протекала на фоне анемии у 36,6% женщин. Аутоиммунные нарушения имели место у 37,8%. Наиболее частыми показаниями для операции кесарева сечения в группе исследования (табл. 1) были: миома матки – 40%, рубец на матке после предыдущих операций кесарева сечения – 18,6%. Третьим по частоте показанием для абдоминального родоразрешения и ИРА была беременность, наступившая в результате ЭКО (15%).
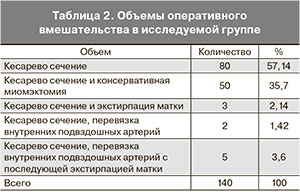
Продолжительность оперативного вмешательства в среднем составила 65,5± 5,12 мин. Объемы оперативного вмешательства представлены в табл. 2.
Из данных таблицы следует, что в группе исследования выполнены операции, способствующие по своим техническим особенностям увеличению кровопотери, что и потребовало проведения ИРА. Объем кровопотери при операции кесарева сечения колебался от 800 до 3100 мл и в среднем составил 1460,51±115,32 мл. Объем реинфузированных аутоэритроцитов колебался от 250 до 1560 мл и в среднем составил 644,79±64,42 мл. На основании объема кровопотери все родильницы разделены на 4 подгруппы.
В I подгруппу (умеренная кровопотеря) вошли 57 (40,7%) женщин, у которых отмечалась кровопотеря в пределах от 15 до 20% объема циркулирующей крови (ОЦК). Объем кровопотери в группе колебался от 800 до 1100 мл и в среднем составил 890,67±104,56 мл. Объем реинфузированных аутоэритроцитов колебался от 250 до 530 мл и в среднем составил 388,47± 43,74 мл. Во II подгруппу (большая кровопотеря) вошли 16 (11,5%) женщин, у которых отмечалась кровопотеря в пределах от 20 до 24% ОЦК. Объем кровопотери в группе колебался от 900 до 1300 мл и в среднем составил 1010±98,55 мл. Объем реинфузированных аутоэритроцитов колебался от 300 до 720 мл и в среднем составил 447,47±125,25 мл. В III подгруппу (массивная кровопотеря) вошли 47 (33,5%) женщин, у которых отмечалась кровопотеря от 25 до 49% ОЦК. Объем кровопотери в группе колебался от 1200 до 2300 мл и в среднем составил 1646,15±231,65 мл. Объем реинфузированных аутоэритроцитов колебался от 540 до 1000 мл и в среднем составил 736,08±101,89 мл. В IV подгруппу (сверхмассивная кровопотеря) вошли 20 (14,3%) женщин, у которых отмечалась кровопотеря более 50% ОЦК. Объем кровопотери в группе колебался от 2500 до 3100 мл и в среднем составил 2850±342,57 мл. Объем реинфузированных аутоэритроцитов колебался от 1002 до 1560 мл и в среднем составил 1227±122,20 мл.
Следует отметить, что наиболее частыми показаниями к кесаревому сечению в подгруппах II, III и IV была миома матки, так, в подгруппах с массивной и сверхмассивной кровопотерей данная патология явилась показанием к операции у 87,3 и 45% соответственно. Данный факт наглядно демонстрирует, что выполнение консервативной миомэктомии во время кесарева сечения всегда сопровождается значительной кровопотерей. На втором и третьем месте как причина возникновения большой, массивной и сверхмассивной кровопотери стоят такие показания к абдоминальному родоразрешению, как преждевременная отслойка нормально расположенной плаценты, предлежание плаценты и тяжелая преэклампсия. Таким образом, проведенный анализ показал, что операцию кесарева сечения, выполняемую по таким показаниям, как миома матки, требующая консервативной миомэктомии, преждевременная отслойка нормально расположенной плаценты, предлежание плаценты и тяжелая преэклампсия, необходимо проводить с использованием ИРА.
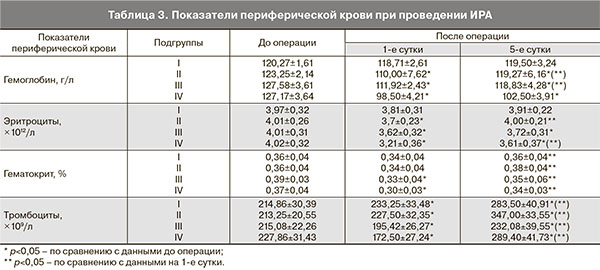
Динамика показателей периферической крови у всех родильниц, которым во время операции кесарева сечения произведена реинфузия аутоэритроцитов, представлена в табл. 3. Данные демонстрируют тот факт, что на первые послеоперационные сутки уровень гемоглобина был достаточно высок, даже у родильниц с массивной и сверхмассивной кровопотерей составлял 111,92±2,43 и 98,50±4,2 г/л, аналогичные результаты получены в отношении уровня эритроцитов и гематокрита. К 5-м суткам послеоперационного периода во всех подгруппах произошло увеличение исследуемых параметров.
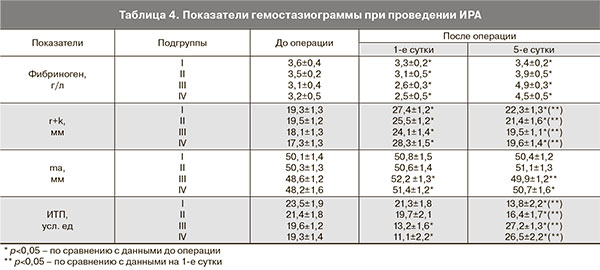
При анализе системы гемостаза выявлено, что реинфузируемая взвесь отмытых аутоэритроцитов не оказывает неблагоприятного влияния на баланс процессов свертывания и противосвертывания. Показатели гемостазиограммы представлены в табл. 4.
В 1-е послеоперационные сутки в группе родильниц, которым была выполнена ИРА, отмечено некоторое снижение фибриногена, увеличение показателя r+k, показатели ma и ИТП соответствовали состоянию гиперкоагуляции. На 5-е сутки послеоперационного периода отмечено повышение уровня фибриногена, укорочение r+k, показатели ma и ИТП также соответствовали состоянию гиперкоагуляции, особенно в III и IV группах (с массивной и сверхмассивной кровопотерей), что соответственно требовало профилактики тромботических осложнений в послеоперационном периоде. Аспирированная из операционной раны кровь в случае ее возврата без предварительной обработки может стать источником нарушения баланса систем свертывания и противосвертывания в организме, в то время как реинфузия отмытых эритроцитов, полученных с использованием аппаратов «Cell-saver», такой опасности не представляет. Аналогичные результаты были получены целым рядом исследователей, которые также показали быстрое восстановление уровня эритроцитов и гемоглобина, отсутствие антикоагулянтной активности отмытых эритроцитов при проведении ИРА при операции кесарева сечения при соблюдении технологии процедуры и использовании при трансфузии лейкоцитарных и микроагрегатных фильтров [18, 19].
При исследовании в крови уровня мочевины, креатинина, билирубина у родильниц после ИРА нами не выявлено их достоверного повышения. В то же время ранее проведенные исследования показали токсический эффект после переливания донорских эритроцитов, что подтверждалось увеличением концентрации мочевины и креатинина на 38 и 25% соответственно, а билирубина в 2 раза [20], что связано с микроциркуляторными нарушениями в почечной паренхиме после трансфузии донорских эритроцитов и гемолизом некоторой части перелитых донорских эритроцитов.
Огромный интерес представляет анализ инфузионно-трансфузионной терапии в подгруппах обследованных женщин в зависимости от объема кровопотери. У всех родильниц обследованных подгрупп инфузионно-трансфузионная терапия начиналась с введения сбалансированных кристаллоидных растворов, коллоидных растворов (6 и 10% растворов гидроксиэтилированного крахмала, гелофузина). Для повышения коагуляционного потенциала крови и купирования дефицита факторов свертывания во II, III и IV подгруппах применялась донорская свежезамороженная плазма в объеме 20–30 мл/кг массы пациентки.
У 30 (21,4% обследованных, которым проводилась реинфузия аутоэритроцитов) пациенток в третьем триместре беременности была также заготовлена аутоплазма. Показаниями для проведения процедуры аутоплазмодонорства у данных беременных было наличие миомы матки, требующей консервативной миомэктомии во время кесарева сечения.
Соотношение объемов сред, входящих в состав инфузионно-трансфузионной терапии, представлены следующим образом.
В I подгруппе кровопотеря (890,67±225,58) восполнялась кристаллоидами – 1000,23±136,63 мл (54%), коллоидами – 468,5±56,82 (25%), объем аутоэритроцитов – 388,47±112,98 (21%). Донорские компоненты крови не переливались. Во II подгруппе кровопотеря (1010,0±110,25) восполнялась кристаллоидами в объеме 700,0±61,22 (34%), коллоидами 560,3±43,68, (28%), аутоэритроцитами – 447,47±130,32 (22%), свежезамороженной плазмой (СЗП) – 326,6±48,34(16%).
Таким образом, для возмещения кровопотери у родильниц с кровопотерей до 20% ОЦК не потребовалось использования донорских компонентов крови. В II подгруппе женщин с кровопотерей от 20 до 25% ОЦК потребовалась только трансфузия СЗП, которая составила 16% общего объема инфузионно-трансфузионных сред.
Переходя к анализу структуры и объема инфузионно-трансфузионной терапии в III подгруппе (47 женщин с массивной кровопотерей), необходимо сказать, что именно в эту подгруппу вошли 30 женщин, у которых была заготовлена аутоплазма. Учитывая это обстоятельство, данная подгруппа была разделена на две подгруппы: III-А – 30 женщин с аутоплазмой и III-Б – 17 женщин без аутоплазмы. В III-А подгруппе кровопотеря (1662,5±154,56 мл) восполнялась кристаллоидами в объеме 650,4±78,23 мл (22%), коллоидами 750,3±53,58 мл, (25%), аутоплазмой – 435,56±120,45 мл (14%), СЗП донорской – 430,4±110,42 мл (14%), аутоэритроцитами – 738,63±140,52 мл (25%). В III-Б подгруппе кровопотеря (1620±178,42 мл) восполнялась кристаллоидами в объеме 720,2±81,17 мл (22%), коллоидами 920,2±45,34 мл (28%), СЗП донорской – 935,5±130,22 мл (28%), аутоэритроцитами – 732,63±140,52 мл (22%). Соотношение сред, входящих в состав подгрупп III-А и III-Б, наглядно демонстрирует рис. 1 (см. на вклейке).
При сочетании методик заготовки аутоплазмы и проведения реинфузии аутоэритроцитов при практически одинаковой кровопотере в подгруппе III-А для возмещения факторов свертывания потребовалось в два раза меньше донорской СЗП, так как этим пациенткам была произведена трансфузия аутоплазмы, которая позволила значительно сократить использование донорской СЗП. По остальному составу инфузионно-трансфузионных средств, использованных для восполнения кровопотери, достоверных различий выявлено не было.
В IV подгруппе женщин со сверхмассивной кровопотерей (2850±273,86 мл) инфузионно-трансфузионная терапия была представлена кристаллоидами в объеме 1100,0±101,39 мл (20%), коллоидами 1540,3±95,45 мл (28%), аутоэритроцитами 1227±230,05 мл (22%) и донорской СЗП – 1670,6±127,06 мл (30%) (рис. 2 см. на вклейке).
Основными инфузионно-трансфузионными средами для восполнения кровопотери в этой подгруппе были донорская СЗП, аутоэритроциты и коллоиды. Большое количество вводимой донорской СЗП объясняется необходимостью быстрого восстановления факторов свертывания и купирования синдрома диссеминированного внутрисосудистого свертывания (ДВС), в связи, с чем СЗП вводится быстро в объеме не менее 20–30 мл/кг массы тела пациентки. Кроме того, необходимо отметить, что всем пациенткам с большим объемом потери ОЦК (II, III и IV подгруппы) с целью эффективного купирования ДВС-синдрома на фоне трансфузии СЗП проводилось введение селективных ингибиторов фибринолиза (транексам) в дозах 500–1500 мг [21, 22].
Таким образом, проведение ИРА при операции кесарева сечения позволяет исключить использование донорских эритроцитов даже у пациенток со сверхмассивной кровопотерей, что позволяет избежать синдрома массивной гемотрансфузии. Анализ течения послеродового периода у пациенток исследуемых подгрупп показал, что наиболее частым осложнением послеродового периода была анемия различной степени выраженности. В I подгруппе анемия легкой степени выявлена только у 3,5% родильниц, во II – у 12,5% родильниц, в III – у 40,4% и в IV – у 30% женщин. Анемия средней степени осложнила течение послеоперационного периода у 6,25% пациенток II подгруппы, у 25,5% – III и у 45% – IV подгруппы. Анемии тяжелой степени не было ни у одной женщины.
Заключение
Представленные данные демонстрируют высокую эффективность и безопасность ИРА при кровопотере любого объема. Каких-либо осложнений при проведении 140 процедур реинфузии аутоэритроцитов при операции кесарева сечения не было ни в одном случае. Выделены следующие показания к проведению реинфузии эритроцитов в акушерстве: предлежание и преждевременная отслойка нормально расположенной плаценты, наследственные и приобретенные дефекты системы гемостаза, многоплодная беременность, варикозное расширение вен матки, гемангиомы органов малого таза, миома, разрыв матки, расширение объема оперативного вмешательства, редкая группа крови. Кроме того, еще большей эффективности метода позволяет добиться его сочетание с аутоплазмодонорством. Сочетанное применение аутоплазмы и реинфузии аутоэритроцитов дают возможность не только восстановить популяцию эритроцитов в сосудистом русле, но и значительно снизить применение донорской плазмы, а в ряде случаев и полностью отказаться от ее использования. Проведенные ранее исследования также доказали безопасность использования данного метода при абдоминальном родоразрешении беременных группы высокого риска по кровотечению при строгом соблюдении технологии метода обученным сертифицированным персоналом [23–25].
Вместе с тем при проведении ИРА при кесаревом сечении необходимо помнить о наличии тромбопластических субстанций в околоплодных водах и возможности их переноса в сосудистое русло пациентки. Поэтому перед операцией у беременной необходимо произвести амниотомию, использовать второй насос непосредственно после извлечения плода для аспирации околоплодных вод, сыровидной смазки и мекония. После этого можно пользоваться насосом для сбора крови и ее последующего отмывания и реинфузии. Кроме того, в конструкции аппаратов предусмотрен особый режим высококачественой отмывки большим количеством раствора, делающий процедуру безопасной в акушерстве. В руководствах по проведению ИРА в акушерстве рекомендуется проводить трансфузию отмытых аутоэрироцитов с использованием лейкоцитарных фильтров. Также при проведении ИРА возможна резус-сенсибилизации беременной с резус-отрицательным фактором крови при резус-положительном плоде, что еще раз подчеркивает обязательность проведения профилактики в послеродовом периоде антирезусным иммуноглобулином. Учитывая достаточно высокую стоимость данной методики, представляется важным использование реинфузии аутоэритроцитов в зависимости от уровня кровопотери при абдоминальном родоразрешении. При ожидаемых небольших объемах кровопотери ИРА может быть заменена таким методом кровесбережения, как нормоволемическая гемодилюция. Применение ИРА позволяет минимизировать использование донорских эритроцитов у родильниц с массивной кровопотерей, что позволяет избежать синдрома массивной гемотрансфузии и значительно улучшает течение послеоперационного периода. ИРА является безопасной и эффективной, и ее необходимо проводить при предполагаемой кровопотере более 20% ОЦК. Дальнейшая разработка и внедрение кровесберегающих технологий для профилактики и лечения кровотечений в акушерской практике позволит реализовать органосохраняющую тактику, сохранить репродуктивную функцию женщины, уменьшить объемы донорских компонентов крови, снизить частоту тяжелых послеоперационных осложнений.