Spina bifida (расщепление позвоночника) – наиболее часто встречаемый врожденный порок развития центральной нервной системы, при котором наблюдается неполное закрытие позвоночного столба, что часто сопровождается формированием мальформации Арнольда–Киари II типа. Самой клинически значимой и частой формой является менингомиелоцеле, когда формируется грыжа с вовлечением оболочек и ткани спинного мозга. Частота встречаемости – 1 на 1500 родов. Данный порок развития значительно влияет на качество жизни ребенка. До последнего времени единственным способом лечения являлась хирургическая коррекция порока постнатально.
В исследованиях последних лет было доказано, что внутриутробная коррекция spina bifida снижает частоту и выраженность неврологических нарушений по сравнению со стандартным хирургическим лечением новорожденных [1, 2]. Тем не менее открытая операция на плоде связана с увеличением частоты акушерских осложнений со стороны матери, таких как оперативное родоразрешение, преждевременные роды, отслойка плаценты, истончение и разрыв рубца на матке [3].
Анестезиологическое обеспечение открытых операций на плоде является сложным и отличается от стандартного ведения операции кесарева сечения или анестезии при хирургических операциях во время беременности. Обязательными компонентами являются обеспечение глубокого расслабления матки, поддержание маточно-плацентарного кровотока, фето-плацентарного кровотока и анестезия плода [4–6].
Общая анестезия является методом выбора для открытой хирургии плода, благодаря возможности титрования дозы ингаляционных анестетиков для достижения удовлетворительной релаксации миометрия и для обеспечения анестезии плода [7, 8].
Клинические наблюдения
Пациентка Б., 28 лет, поступила в Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (Центр) в январе 2019 г. с целью обследования и определения дальнейшей тактики лечения. Диагноз: Беременность 22 недели. По данным ультразвукового исследования (УЗИ) – один живой плод в тазовом предлежании, продольном положении. Врожденный порок развития (ВПР): Синдром Арнольда–Киари. Миеломенингоцеле II типа. По решению консилиума Центра пациентка госпитализирована для решения вопроса о проведении внутриутробной коррекции ВПР. С целью определения кариотипа плода выполнен трансабдоминальный амниоцентез под контролем УЗИ. По клеткам амниотической жидкости произведено пренатальное молекулярное кариотипирование на ДНК-микроматрицах, установлен кариотип плода – данных за хромосомную патологию не получено. Проведена магнитно-резонансная томография (МРТ) плода, подтверждены данные УЗИ. Течение данной беременности: в I триместре получала фолиевую кислоту, препараты йода, выявлен первичный субклинический гипотиреоз, назначено 25 мкг левотироксина натрия.
Была сформирована многопрофильная команда, состоящая из акушеров-гинекологов, нейрохирургов, анестезиологов-реаниматологов, детских хирургов и неонатологов. Перед операцией пациентке объяснили необходимость предполагаемой операции, ее возможные результаты и осложнения.
В операционной укладка пациентки с наклоном операционного стола на 15° для профилактики проявлений синдрома аорто-кавальной компрессии. Перед операцией установлены два периферических венозных катетера диаметром 16G. Налажен мониторинг: неинвазивное артериальное давление (нАД) (каждые 3 минуты), мониторируемая ЭКГ в трех отведениях, частота сердечных сокращений (ЧСС), пульсоксиметрия, контроль за температурой тела каждые 3 минуты. Поддержание нормотермии осуществлялось посредством термоматраца и согревания инфузионных растворов. В дальнейшем была выполнена комбинированная спинально-эпидуральная анестезия в положении пациентки лежа на боку. Интратекально было введено 5 мг Маркаин спинал-хэви (low-dose). В премедикацию введен антибиотик (цефазолин 1000 мг) и дексаметазон 4 мг внутривенно. Введена нагрузочная доза сульфата магния 25% – 16 мл (4 г). Преинфузия – 500 мл Стерофундина. Индукция в анестезию: тиопентал натрия в дозе 4 мг/кг и фентанил 0,1 мг, миорелаксация – рукуроний бромид 0,6 мг/кг. Глубокое расслабление матки достигалось путем набора высоких дозировок Севофлурана (до 3,8 об./%) для достижения минимальной альвеолярной концентрации (МАК), равной 1,6–1,8. Также для снижения тонуса матки на протяжении всей операции вводился сульфат магния 25% – 1 г/ч. Параллельно, с целью поддержания адекватного АД и маточно-плацентарного кровотока была начата инфузия норэпинефрина – в дозировке от 0,05 до 0,2 мкг/кг/мин. В качестве второго вазопрессора использовался фенилэфрин. Фентанил вводился женщине болюсно, суммарно за 2 ч 20 минут – 1 мг [9].
Сложность проведения анестезии при открытых операциях на плоде заключается в поддержании удовлетворительной гемодинамики матери и плода на фоне высоких дозировок ингаляционного анестетика (для максимально возможной релаксации миометрия) в сочетании с нейроаксиальным блоком. После разреза на коже концентрация Севофлурана увеличивается, чтобы обеспечить атонию матки. МАК должна быть максимальной к моменту утеротомии. В качестве дополнительного утеролитика возможно применение нитроглицерина – внутривенной или сублингвальной формы [10]. Релаксацию матки подтверждает хирург, если требуется, анестетик титруется дополнительно по мере необходимости. Момент утеротомии требует особой настороженности от анестезиолога; маловероятно, но возможно кровотечение из полностью расслабленной матки. Во время глубокой анестезии (до 1,8–2 МАК) возникает потребность в поддержании гемодинамики матери и плода за счет относительно высоких дозировок вазопрессоров. Основная цель – это поддержание перфузионного давления в маточно-плацентарных и фето-плацентарных системах кровообращения. Вазопрессоры начинают вводить с момента индукции в анестезию, с минимальных дозировок, и титруют по мере углубления анестезии. Среднее АД матери не должно снижаться ниже 65 мм рт. ст., при этом ЧСС плода должна оставаться в пределах допустимых значений.
Анестезия плода обеспечивается главным образом трансплацентарным переносом лекарственных веществ: ингаляционных анестетиков, опиоидных анальгетиков. Интраоперационный мониторинг состояния плода имеет важное значение. Методами мониторинга являются УЗИ и эхокардиография плода. Препараты для реанимации плода (атропин 20 мкг/кг, адреналин 10 мкг/кг и раствор натрия хлорида 0,9% 10 мл/кг) приготовлены заранее и в любой момент могут быть предоставлены хирургу для введения плоду. Реанимацию плода возможно проводить опосредованно через организм матери, путем оптимизации гемодинамики и введения соответствующих препаратов.
К моменту ушивания разреза на матке в эпидуральное пространство вводится раствор 0,75% ропивакаина, дальнейшая анестезия поддерживается в основном за счёт нейроаксиальной блокады. Это позволяет снижать дозировки ингаляционного анестетика для оптимизации времени экстубации трахеи. Экстубация пациентки производится только после полного пробуждения и восстановления защитных рефлексов.
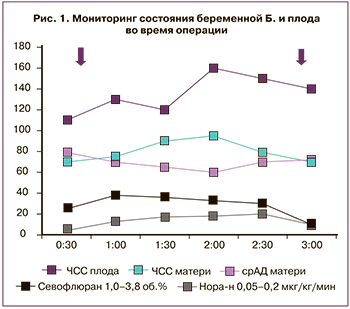 На рис. 1 представлена гемодинамика пациентки Б., ЧСС плода, степень вазопрессорной поддержки и МАК анестетика. Стрелками указано начало и окончание оперативного вмешательства.
На рис. 1 представлена гемодинамика пациентки Б., ЧСС плода, степень вазопрессорной поддержки и МАК анестетика. Стрелками указано начало и окончание оперативного вмешательства.
В послеоперационном периоде основной задачей анестезиолога-реаниматолога является поддержание аналгезии пациентки за счет болюсных введений ропивакаина в эпидуральное пространство; в случае необходимости допустимо применение опиоидных анальгетиков. Также необходимы контроль за тонусом миометрия и введение токолитических препаратов. Обязателен мониторинг состояния матери и плода.
Операция начата с участием нейрохирурга и специалистов по фетальной хирургии из Бразилии. Акушером выполнено поперечное надлобковое чревосечение, разрезом послойно вскрыта брюшная полость. В рану выведена беременная матка, соответствующая 24 неделям беременности. Произведено УЗИ с целью визуализации плода и выбора места разреза. На передней стенке матки размечена линия разреза. Возле линии разреза наложены две отдельные викриловые лигатуры, между которыми произведен разрез с помощью монополярного коагулятора, наложены 2 зажима Сатинского. Стенка матки между зажимами рассечена ножницами на протяжении 3 см, произведено прошивание стенки матки и околоплодных оболочек отдельными викриловыми швами. В проксимальном направлении наложены два зажима, стенка матки вскрыта ножницами, произведено прошивание стенки матки и околоплодных оболочек отдельными викриловыми швами. В рану выведена спинка плода с менингомиелоцеле. Плод обезболен, внутримышечно плоду введен фентанил (20 мкг/кг). Спинномозговая грыжа плода вскрыта, в дне грыжи слепо заканчивается спинной мозг. После отсепаровки от оболочек спинной мозг погружен в спинномозговой канал. Твердая мозговая оболочка восстановлена, произведено герметичное ушивание мягких тканей. Дефект кожи зашит послойно. Непрерывным викриловым швом зашиты околоплодные оболочки. Произведены восстановление количества околоплодных вод до нормального количества, профилактика инфекционных осложнений, внутриматочно введен теплый раствор Cтерофундина и цефалоспориновый антибиотик 2-го поколения. Рана на матке зашита двурядным швом. Передняя брюшная стенка зашита послойно, наглухо. На кожу – косметический монокриловый шов. Кровопотеря составила 100 мл.
После окончания операции пациентка была экстубирована на столе и переведена в отделение реанимации. Длительность операции составила 2 ч 25 минут, длительность общей анестезии – 3 ч 10 минут, в послеоперационном периоде продолжена эпидуральная аналгезия, проводилась профилактика венозных тромбоэмболических осложнений, токолитическая терапия проводилась Атозибаном (Трактоцил) по схеме согласно инструкции. Ранний послеоперационный период протекал без осложнений. 25.02 пациентка выписана по месту жительства в удовлетворительном состоянии. Продолжено амбулаторное наблюдение в Центре.
30.04.2019 г., учитывая развитие регулярной родовой деятельности, преждевременное излитие околоплодных вод, принято решение о родоразрешении путем проведения операции кесарева сечения в экстренном порядке. Операция выполнена в условиях спинальной анестезии. На 2-й минуте извлечена живая недоношенная девочка массой 2270 г, длиной 47 см. Оценка по шкале Апгар составила 8/9 баллов. Шов на матке после внутриутробного вмешательства состоятельный, произведена метропластика. После кратковременного пребывания в отделении реанимации хирургии новорожденных ребенок был переведен в отделение патологии новорожденных и недоношенных, где находился совместно с матерью.
Пациентка С., 27 лет, поступила в Центр в июле 2019 г. с целью обследования и определения дальнейшей тактики лечения. Диагноз: Беременность 24 недели. ВПР: Синдром Арнольда–Киари II типа. Миеломенингоцеле. По решению консилиума Центра пациентка госпитализирована для проведения фетальной операции. С целью определения кариотипа плода выполнен трансабдоминальный амниоцентез под ультразвуковым контролем. По клеткам амниотической жидкости произведено пренатальное молекулярное кариотипирование на ДНК-микроматрицах, установлен кариотип плода – данных за хромосомную патологию плода не получено. Анализируемый образец содержит ДНК с нормальным мужским генотипом, анеуплоидии не выявлены. Патогенных микроделеций и микродупликаций не обнаружено. Также была выполнена МРТ плода, по данным которой получена МР-картина аномалии Арнольда–Киари, внутренней симметричной гидроцефалии, spina bifida posterior в пояснично-крестцовом отделе позвоночника. Данная беременность протекала без особенностей. Экстрагенитальный анамнез не осложнен.
В августе 2019 г. на сроке 25 недель 5 дней была сформирована многопрофильная команда, состоящая из акушеров-гинекологов, нейрохирургов, анестезиологов-реаниматологов, неонатологов. Перед операцией пациентке объяснили необходимость процедуры, ее результаты и возможные осложнения.
В операционной укладка пациентки с наклоном операционного стола на 15° для профилактики проявлений синдрома аорто-кавальной компрессии. Перед операцией поставлены два периферических венозных катетера диаметром 16 и 18G. Налажен мониторинг: нАД (каждые 3 мин.), мЭКГ в трех отведениях, ЧСС, пульсоксиметрия, контроль за температурой тела каждые 3 минуты. Поддержание нормотермии осуществлялось посредством термоматраца и согревания инфузионных растворов. В дальнейшем была выполнена комбинированная спинально-эпидуральная анестезия в положении пациентки лежа на боку. Интратекально было введено 5 мг Маркаин спинал-хэви (low-dose). В премедикацию введен антибиотик (Цефазолин 1000 мг) и дексаметазон 4 мг внутривенно. Введена нагрузочная доза сульфата магния 25% – 16 мл (4 г). Индукция в анестезию: тиопентал натрия в дозе 4 мг/кг и фентанил 0,1 мг, миорелаксация – рукуроний бромид 0,6 мг/кг. Глубокое расслабление матки достигалось путем набора высоких дозировок севофлурана (3,5–3,7 об./%) для достижения 1,5–1,8 МАК. Для снижения тонуса матки на протяжении всей операции вводился сульфат магния 25% – 1 г/ч. Параллельно, с целью поддержания адекватного АД и маточно-плацентарного кровотока была начата инфузия норэпинефрина – в дозировке от 0,03 до 0,15 мкг/кг/мин. В качестве второго вазопрессора использовался фенилэфрин. Фентанил вводился женщине болюсно, суммарно за 2 ч 0,9 мг.
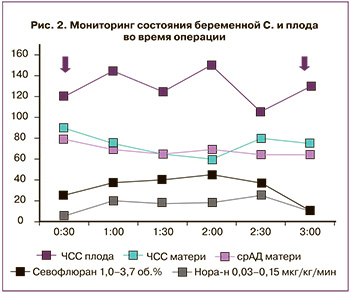 На рис. 2 представлена гемодинамика пациентки С., ЧСС плода, степень вазопрессорной поддержки и МАК анестетика. Стрелками указано начало и окончание оперативного вмешательства.
На рис. 2 представлена гемодинамика пациентки С., ЧСС плода, степень вазопрессорной поддержки и МАК анестетика. Стрелками указано начало и окончание оперативного вмешательства.
Операция начата с участием нейрохирурга. Акушером выполнено поперечное надлобковое чревосечение, разрезом послойно вскрыта брюшная полость. В рану выведена беременная матка, соответствующая 25 неделям беременности. Произведено УЗИ с целью визуализации плода и выбора места разреза. В дне матки, ближе к левому маточному углу размечена линия разреза. Возле линии разреза наложены 2 отдельные викриловые лигатуры, между которыми произведен разрез с помощью монополярного коагулятора, наложены 4 зажима Алиса, 4 фиксирующие оболочки викриловых шва. В проксимальных направлениях наложены 4 зажима Сатинского, зажимы сняты, на стенку матки наложены аппаратные рассасывающиеся скобы, стенка матки между скобами рассечена ножницами в дистальном направлении на протяжении 3 см с обеих сторон. В рану выведена спинка плода с менингомиелоцеле. Плод обезболен, внутримышечно плоду введен фентанил (20 мкг/кг). Спинномозговая грыжа плода вскрыта, в дне грыжи слепо заканчивается спиной мозг. После отсепаровки от оболочек спинной мозг погружен в спинномозговой канал. Твердая мозговая оболочка восстановлена, произведено герметичное ушивание мягких тканей. Дефект кожи зашит послойно. Произведены восстановление количества околоплодных вод до нормального количества, профилактика инфекционных осложнений, внутриматочно введен теплый раствор стерофундина и цефалоспориновый антибиотик 2-го поколения. Рана на матке зашита двурядным швом. Передняя брюшная стенка зашита послойно, наглухо. На кожу – косметический монокриловый шов. Кровопотеря составила 100 мл.
После окончания операции пациентка была экстубирована на столе и переведена в отделение реанимации. Длительность операции составила 2 ч 47 минут, длительность общей анестезии – 3 ч 20 минут, в послеоперационном периоде продолжена эпидуральная аналгезия, проводилась профилактика венозных тромбоэмболических осложнений, токолитическая терапия проводилась Атозибаном (Трактоцил) по схеме согласно инструкции. Ранний послеоперационный период протекал без осложнений. В дальнейшем пациентка выписана в удовлетворительном состоянии. Продолжено амбулаторное наблюдение.
18.09.2019 г. пациентка поступила в Центр с жалобами на тянущие боли внизу живота нерегулярного характера. Учитывая клинические проявления угрожающих преждевременных родов у повторнородящей 27 лет с рубцом на матке после открытой фетальной хирургии, принято решение продолжить лечение, направленное на пролонгирование беременности в условиях стационара.
28.09.2019 г. на сроке 33 недели и 4 дня в связи с развитием кровотечения – преждевременной отслойкой нормально расположенной плаценты принято решение об экстренном родоразрешении путем операции кесарева сечения. Операция выполнена в условиях спинальной анестезии. На 2-й минуте извлечен живой недоношенный мальчик массой 1980 г, длиной 43 см. Оценка состояния по шкале Апгар на 1-й минуте 6 баллов, на 5-й минуте – 8 баллов.
01.10.2019 г. пациентка выписана по месту жительства в удовлетворительном состоянии. Ребенок продолжил наблюдение и лечение в условиях отделения хирургии, реанимации и интенсивной терапии новорожденных Центра.
Обсуждение
Особенность работы с пациентами акушерского профиля заключается в том, что при оказании помощи беременной анестезиолог-реаниматолог всегда обязан помнить о состоянии плода; должен понимать основы физиологии и патофизиологии беременной и плода [11]. Проведение анестезии при открытых оперативных вмешательствах на плоде – это сложная и трудоемкая задача. Необходимо учитывать маточно-плацентарные и фето-плацентарные взаимодействия, знать механизмы и факторы, определяющие трансплацентарную трансфузию веществ.
Традиционно общая комбинированная анестезия является методикой выбора при проведении открытых операций на плоде. Ингаляционные анестетики оказывают расслабляющее действие на миометрий и легко переносятся через плаценту к плоду. В дополнение, дозировки летучих анестетиков легко поддаются коррекции и, в случае необходимости, возможна их быстрая элиминация [12].
Возможны альтернативные варианты проведения анестезии при данных операциях. Альтернативой общей анестезии может быть нейроаксиальная блокада в сочетании с постоянной инфузией нитроглицерина для релаксации миометрия. George R.B., Melnick A.H. применяли методику комбинированной спинально-эпидуральной анестезии. Применение нитроглицерина приводило к гипотензии, трудно поддающейся коррекции, тахикардии, тахифилаксии и метгемоглобинемии. Пациентки предъявляли жалобы на выраженную головную боль, что также связано с применением нитроглицерина. Однако этот вариант анестезии допустимо применять у пациенток, которым противопоказаны ингаляционные анестетики [13].
Rosen M.A. et al. сообщили об успешном проведении тотальной внутривенной анестезии пропофолом и мидазоламом в сочетании с инфузией нитроглицерина у пациентки с риском развития злокачественной гипертермии. Плод с полной окклюзией трахеи был успешно прооперирован, проходимость дыхательных путей восстановлена [14].
Boat A., Mahmoud M. в своем ретроспективном исследовании показали, что раннее увеличение концентрации ингаляционного анестетика (сразу после индукции) приводило к интраоперационной брадикардии плода, особенно когда применялся десфлуран. Исходя из полученных данных, авторы исследования предлагают вводить дополнительно пропофол и ремифентанил до разреза на матке и только к моменту гистеротомии повышать концентрацию ингаляционного анестетика [15].
В нашем Центре мы применяем сочетание нейроаксиальной блокады с общей комбинированной анестезией. До индукции в общую анестезию пациенткам выполняется комбинированная спинально-эпидуральная анестезия. В интратекальное пространство вводится 5 мг Маркаина хэви (low dose). Нейроаксиальный блок снижает стрессорный ответ организма на хирургическое вмешательство, обеспечивает дополнительную миорелаксацию. Это позволяет избежать дополнительного введения пропофола. Фентанил вводится пациентке болюсно на протяжении всей операции согласно общепринятым дозировкам и исходя из клинической ситуации. После индукции и до момента утеротомии концентрация МАК ингаляционного анестетика не превышает единицы. Перед разрезом матки концентрация анестетика повышается до 1,5–1,8 МАК для снижения тонуса миометрия. Релаксация матки – обязательный компонент при вмешательствах на плоде открытым доступом. Это облегчает манипуляции, усиливает маточно-плацентарный кровоток, снижает вероятность возникновения родовой деятельности [16]. Для контроля за АД используются вазопрессоры – фенилэфрин и норадреналин. Мониторинг состояния плода – обязательный компонент во время проведения оперативного вмешательства. Мониторинг плода включает прямое наблюдение, ультразвуковую регистрацию ЧСС и пульсоксиметрию. Если необходимо введение препаратов плоду, это выполняет хирург, внутримышечно или внутривенно.
Заключение
Фетальная хирургия является быстро развивающейся областью медицины. Анестезиологическое обеспечение фетальных операций развивается совместно с прогрессом в хирургической технике. Анестезиологическое обеспечение основывается на знании особенностей физиологии и патофизиологии матери и плода.
Открытая хирургия плода невозможна без командного взаимодействия многопрофильной бригады специалистов, в которую входят: акушеры-гинекологи, нейрохирурги, анестезиологи-реаниматологи, неонатологи, специалисты по фетальной медицине, операционные сестры, медицинские сестры анестезисты, акушерки; также необходимы подготовленные операционные с соответствующим оборудованием.



