Синдром поликистозных яичников (СПЯ) – одно из наиболее распространенных полигенных эндокринных расстройств женской половой системы. Его распространенность варьирует от 6 до 20% [1–3]. Несмотря на длительный период исследования этого заболевания, патогенез СПЯ до сих пор не изучен. Многочисленные исследования свидетельствуют о том, что СПЯ – генетическая патология [4]. При этом поиск заинтересованных генов продолжается до настоящего времени. Диагноз СПЯ предполагает наличие минимум двух из трех критериев: олиго/ановуляция, гиперандрогения, поликистозная морфология яичников – при исключении другой патологии, связанной с гиперандрогенией и (или) ановуляцией [1–3]. На основании различных сочетаний диагностических критериев выделяют четыре фенотипа СПЯ: классический фенотип А (гиперандрогения, олиго/ановуляция и поликистозная морфология яичников), ановуляторный фенотип B (гиперандрогения и ановуляция), овуляторный фенотип С (гиперандрогения и поликистозная морфология яичников) и неандрогенный фенотип D (олиго/ановуляция и поликистозная морфология яичников). Показано, что клинические фенотипы могут меняться в течение жизни с увеличением массы тела [5].
В настоящее время при ведении женщин с СПЯ значимое внимание стали уделять инозитолам – медиаторам действия инсулина. В 2018 г. инозитол был интегрирован в международные рекомендации по ведению пациенток с СПЯ в качестве средства альтернативной терапии [2].
Инозитолы и их производные – это одни из главных сигнальных веществ, которые опосредуют передачу сигнала от рецепторов гормонов. Из девяти изомеров инозитола в организме человека более известны миоинозитол (МИ) и D-хироинозитол (ДХИ). В клетках стереоизомеры инозитола выявляют как в несвязанной форме – МИ и ДХИ, так и в форме инозитол-фосфогликанов (ИФГ) – МИ-ИФГ и ДХИ-ИФГ, которые образуются также под воздействием инсулина. Взаимодействуя с рецепторами на клеточной мембране, инсулин стимулирует гидролиз присутствующих в ней фосфатидилинозитолов (PIP, PIP2) до инозитол-бисфосфатов (InsP2) и инозитол-трифосфатов (InsP3), включая ИФГ в осуществление передачи сигналов. После чего они дефосфорилируются с участием фермента
IMPA-1, и вновь образуется несвязанный МИ [6]. МИ-ИФГ и ДХИ-ИФГ– вторичные посредники инсулина в клетках, которые опосредуют его разносторонние эффекты [6]. Фосфогликаны МИ способствуют активации транспортера GLUT4 на мембране клеток и стимулируют утилизацию глюкозы [7], поэтому содержание МИ больше в органах с высоким поглощением глюкозы (мозг, сердце). В клетках жировой ткани МИ увеличивает чувствительность к инсулину [8] и осуществляет его антилиполитический эффект, подавляя аденилатциклазу и выделение свободных жирных кислот. При высоком уровне глюкозы в плазме крови МИ блокирует всасывание глюкозы в кишечнике, уменьшая уровень гликемии [9, 10].
Фосфогликаны ДХИ активируют гликогенез и приводят к накоплению глюкозы в клеточных структурах. Поэтому уровень ДХИ высокий в органах, содержащих гликоген (печень, мышцы), и низкий там, где активно утилизируется глюкоза [11]. ДХИ-содержащие фосфогликаны стимулируют гликолиз, активируя пируватдегидрогеназу с целью интеграции глюкозы в цикл Кребса с последующим синтезом аденозинтрифосфорной кислоты [11, 12]. В присутствии ДХИ, благодаря сокращению жирового обмена и утилизации свободных жирных кислот в клетках печени, подавляется глюконеогенез. В итоге увеличивается восприимчивость тканей к инсулину [11–13].
Кроме воздействия на обмен углеводов, МИ и ДХИ оказывают значимое влияние на органы репродукции. В половых железах МИ выполняет функции вторичного посредника фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ). Сигнальные пути гонадотропинов оказывают влияние на пролиферацию клеток теки и гранулезы. Гонадотропины стимулируют цАМФ-зависимую протеинкиназу А, это сопровождается пролиферацией клеток гранулезы и стероидогенезом через индукцию экспрессии ароматазы. Большая распространенность рецепторов к гонадотропинам влияет на Са2+-зависимые пути через выделение Са2+ из внутриклеточного пула или путем проникновения ионов кальция через каналы клеточной мембраны [6, 10]. Этот каскад включает фермент фосфолипазу С, которая гидролизует PIP2 до инозитолтрифосфата (IP3) и диацилглицерола. МИ оказывает влияние на активность гонадотропинов через IP3, он стимулирует выход ионов кальция из внутриклеточного пула. В яичниках МИ, взаимодействуя со специфическим IP3-R1-подтипом рецептора IP3, играет важную роль в оогенезе, способствует прогрессии мейоза, когда клетки обладают максимально высокой восприимчивостью к концентрации кальция. Производные МИ принимают участие в реализации ремоделирования цитоскелета и модулируют уровень антимюллерова гормона в плазме крови [6, 10].
Гиперандрогения и висцеральное ожирение, сопутствующие пациенткам с СПЯ, характеризуются нарушением баланса провоспалительных медиаторов и противовоспалительных цитокинов, как результат, хроническим системным воспалением и оксидативным стрессом [14, 15]. При этом активность системной воспалительной реакции прямо пропорциональна степени нарушения жирового обмена и индексу массы тела (ИМТ), а выраженность оксидативного стресса у женщин с СПЯ от ИМТ не зависит [14]. Тем не менее в гинекологической практике выявление маркеров хронического воспаления и окислительного стресса пока не распространено. В исследованиях продемонстрировано, что ДХИ лучше, чем другие исследованные стереоизомеры инозитолов, ингибирует протеины, принимающие участие в поддержании системного воспалительного ответа [11]. Подавление циклинзависимых киназ необходимо для физиологической редукции воспалительного процесса. Более выраженные различия МИ от ДХИ показаны в отношении матриксной металлопротеиназы. Матриксные металлопротеиназы участвуют в активации хемокинов и цитокинов, осуществляя таксис макрофагов к воспалительному очагу [11].
Мировые исследования убедительно демонстрируют позитивное влияние инозитолов на репродуктивную функцию, восстановление овуляции и ритма менструаций у женщин с СПЯ [16–19]. В 2021 г. на территории России на базе 14 клинических центров проводилось наблюдательное исследование, посвященное оценке применения витаминно-минерального комплекса (ВМК) на основе МИ/ДХИ в соотношении 5:1, марганца и фолиевой кислоты (Дикироген) для нормализации ритма менструаций и восстановления овуляции. В настоящей статье представлен анализ данных, полученных в рамках этого исследования.
Цель исследования – изучение эффективности применения ВМК на основе МИ/ДХИ в соотношении 5:1 для нормализации ритма менструаций и восстановления овуляции.
Материалы и методы
В исследование были включены 268 пациенток, соответствовавших следующим критериям: возраст 18–39 лет; наличие ановуляторного фенотипа СПЯ; индекс массы тела (ИМТ) от 18 до 24,9 кг/м2; отсутствие приема гормональных препаратов в течение 3 месяцев до включения в исследование; отсутствие тяжелой соматической патологии; согласие на участие в исследовании. У всех женщин ранее были исключены эндокринопатии, возможные причины гиперандрогении и ановуляции. Все пациентки в соответствии с классификацией Всемирной организации здравоохранения (ВОЗ) относились к группе «молодые» – возраст пациенток варьировал в диапазоне 18–39 лет, в среднем 25,1 (5,3) года. Возраст менархе варьировал от 10 до 14 лет (медиана 13 лет, IQR 12–13 лет).
На момент включения в исследование задержки менструаций более 38 дней (олигоменорея) были зафиксированы у 220/268 (82%) пациенток, нарушения менструального цикла по типу аменореи (отсутствие менструаций более 6 месяцев) были выявлены у 48 (18%) пациенток. Первичное бесплодие зафиксировано у 210 (78,4%) женщин, вторичное бесплодие – у 58 (21,6%).
Всем пациенткам был рекомендован Дикироген по 1 саше 2 раза в день в течение 3 месяцев (1 саше содержит МИ 1000 мг, ДХИ 200 мг, фолиевую кислоту 200 мкг, марганец 5 мг). Длительность наблюдения пациенток в среднем составила 83,5 (19,3) дня.
Первичными параметрами эффективности были выбраны: регулярный ритм менструаций в пределах от 24 до 38 дней с индивидуальной вариабельностью в пределах одной недели и восстановление овуляции.
В качестве вторичных параметров оценивали динамику изменений лабораторных показателей (ЛГ, ФСГ, ЛГ/ФСГ, свободный тестостерон, глюкоза), ИМТ, окружности талии (ОТ).
Наблюдение за пациентками и регистрацию показателей осуществляли в амбулаторных условиях в ходе двух визитов – c интервалом в 3 месяца. Через 3 месяца с момента инициации негормональной коррекции оценивали характеристики менструального цикла. Для большей объективизации данных все женщины вели дневник, в котором фиксировали: дату начала менструации, продолжительность менструального цикла и факт овуляции. Мониторинг овуляции осуществлялся самостоятельно женщинами с помощью цифровых тестов (Clearblue digital-тест) [20]. Контроль нежелательных явлений осуществляли на протяжении всего периода наблюдения.
В ходе исследования проведено изучение общего и гинекологического анамнеза, физикальный и гинекологический осмотр. Оценка антропометрических показателей включала рост, вес, расчет ИМТ, измерение ОТ.
Пациенткам определяли в плазме крови концентрации гонадотропинов (ФСГ, ЛГ) иммунохемилюминесцентным методом на автоматизированном анализаторе ADVIA Centaur (Bayer Diagnostics, США) и автоматической системе IMMULITE 2000 (DPC, США). Определение свободного тестостерона осуществляли с помощью иммуноферментного анализа. С целью оценки гликемического статуса изучали уровень глюкозы натощак. Ультразвуковое исследование органов малого таза (УЗИ) выполняли по стандартной методике на ультразвуковом сканере Logiq 500 PRO (GE Medical systems, США) с использованием абдоминального и вагинального конвексных датчиков частотой 3,5 и 7,5 МГц соответственно. Эхо-признаками поликистозных яичников считали наличие не менее 20 фолликулов диаметром от 2 до 9 мм в любом яичнике и/или увеличение объема любого яичника ≥10 см3 (при отсутствии желтого тела, кист или доминантных фолликулов) [1].
При проверке статистических гипотез применялся уровень значимости α=0,05 (для двусторонних тестов). Проверка данных на близость к нормальному закону распределения проверялась по ГОСТу [21]. Анализ показал, что гипотеза о нормальности закона распределения отклоняется при p<0,001 по всем вторичным показателям эффективности. Поэтому при описании и анализе данных применялась непараметрическая статистика (медиана и межквартильный интервал, а для оценки значимости динамики – парный критерий Вилкоксона, критерий Мак-Немара, Q-критерий Кохрена). Двусторонние доверительные интервалы (ДИ) частоты наступления события рассчитывались методом Вильсона. Для статистической обработки использовались пакеты STATISTICA 12.5 и AtteStat 13.1.
Результаты и обсуждение
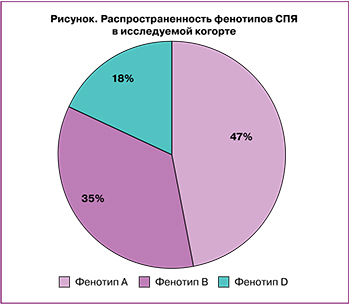
Распределение больных СПЯ по фенотипам представлено на рисунке. Самой представительной была группа пациенток с фенотипом А – 126/268 женщин (47%), фенотип B зафиксирован у 94/268 пациенток (35%), фенотип D выявлен у 48/268 женщин (18%). Клинические проявления андрогензависимой дермопатии (акне, себорея, гирсутизм) были выявлены у 109/268 (86,5%) пациенток с СПЯ с фенотипом А, у 75/268 (79,7%) – с фенотипом В, тогда как у женщин с фенотипом D данные проявления встречались в 25% случаев.
Лабораторные критерии гиперандрогении были зафиксированы у пациенток с фенотипами А и В. Уровень глюкозы натощак у всех женщин был в пределах референсных значений (табл. 1).
Увеличение овариального объема как диагностического признака СПЯ при эхографическом исследовании выявлено у пациенток с фенотипами А и D.
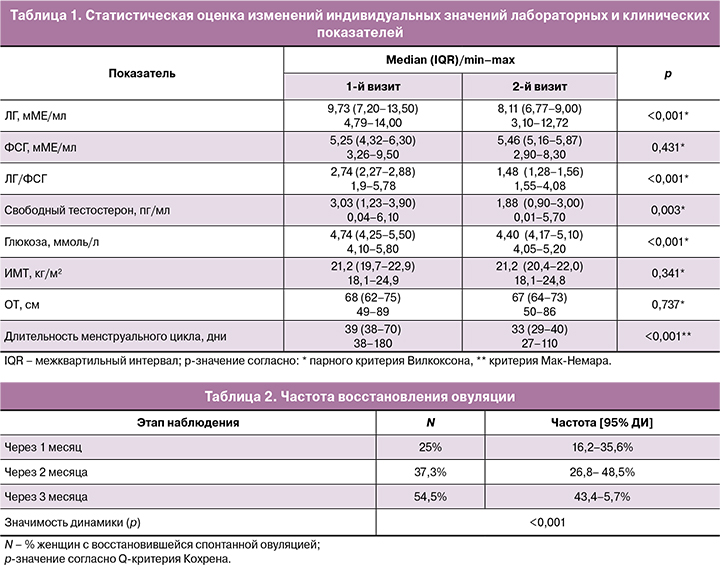
Через 3 месяца с момента инициации негормональной коррекции менструального цикла у 174/268 (64,9%) пациенток зафиксировано восстановление ритма менструаций в пределах 24–38 дней с вариабельностью не более 7 дней. Продолжительность менструального цикла до начала наблюдения варьировала от 38–180 дней (медиана 39 дней, IQR=38–70), после 3 месяцев негормональной интервенции от 27–110 дней (медиана 33 дня, IQR=29–38; p<0,001). У значительной части пациенток на фоне трехмесячного приема ВМК на основе МИ/ДХИ в соотношении 5:1, марганца и фолиевой кислоты (Дикироген) наблюдалось восстановление овуляции (табл. 2). При этом у 67 (25%) пациенток спонтанную овуляцию фиксировали уже через 1 месяц, у 100 (37,3%) – через 2 месяца. В целом за 3 месяца восстановление овуляции наблюдалось у 146/268 (54,5%) пациенток (95% ДИ 43,4–65,7%). Имела место статистически значимая связь частоты восстановления овуляции и скорректированной продолжительности менструального цикла (через 3 месяца после начала приема Дикирогена) – точечно-бисериальный коэффициент корреляции RБИС=-0,34 при p=0,004, т.е. была подтверждена ожидаемая тенденция: чем меньше стала продолжительность менструального цикла, тем выше вероятность восстановления овуляции. У 14 (5,2%) женщин наступила спонтанная беременность.
Через 3 месяца после начала приема ВМК на основе МИ/ДХИ в соотношении 5:1 по большинству лабораторных показателей наблюдалась положительная динамика (табл. 1). В частности имело место статистически значимое (при p<0,05) снижение медиан относительно исходного уровня: ЛГ – на 17%; отношения ЛГ/ФСГ – на 15%; глюкозы – на 7%; свободного тестостерона – на 1%.
Изменения ИМТ и ОТ у пациенток после 3 месяцев приема Дикирогена были статистически не значимы (p>0,05).
Из побочных и нежелательных эффектов при приеме Дикирогена были отмечены: тошнота – у 1 (0,37%) пациентки, диарея – у 2 (0,74%).
Результаты научных исследований, которые имеются на сегодняшний день, указывают на важное значение инозитолов в патогенезе болезней, ассоциированных с инсулинорезистентностью, в том числе СПЯ. Определение пропорции МИ/ДХИ, необходимой для достижения того или иного терапевтического эффекта, является злободневной задачей клинического применения инозитолов. В ряде исследований продемонстрировано, что пропорция МИ/ДХИ 40:1, идентичная физиологической концентрации в плазме крови, оптимальна для ведения женщин с СПЯ [22]. Взяв за основу в составе средства соотношение МИ/ДХИ, равное 40:1, можно ли рассчитывать на то, что после абсорбции в кишечнике содержание в плазме крови также сохранится на уровне 40:1? Вероятно, физиологическое соотношение МИ/ДХИ является результатом работы гомеостатических процессов, направленных на поддержание соотношения МИ/ДХИ на уровне 40:1 [23]. Только в клинических исследованиях можно установить оптимальное соотношение МИ/ДХИ в составе ВМК.
Подтверждение того, что пропорция МИ/ДХИ, равная 40:1, не является единственно приемлемой в гинекологической практике, демонстрируют результаты следующих клинических исследований [24–27]. Женщинам с СПЯ рекомендовали МИ/ДХИ в пропорции 10:1 в течение 6 месяцев. Наблюдался отчетливый позитивный эффект в редукции массы тела, уровней гонадотропинов, тестостерона и инсулина. [25]. Сравнивали эффективность двух соотношений МИ/ДХИ у пациенток с СПЯ, участвующих в программах вспомогательных репродуктивных технологий (ВРТ) (n=60). В течение 3 месяцев пациенткам рекомендовали МИ/ДХИ в соотношении 3:1 или 40:1. Частота наступления беременности (р=0,003), число живорожденных детей (р=0,002) были существенно выше у женщин, принимающих МИ/ДХИ в пропорции 3:1. Частота синдрома гиперстимуляции яичников была ниже у пациенток, использующих МИ/ДХИ в соотношении 3:1 [26]. Прием МИ/ДХИ в пропорции 1,8:1 пациентками с СПЯ, участвующими в программах ВРТ, сопровождался улучшением качества цитоплазмы и клеточной мембраны ооцитов (р=0,00672) по сравнению с женщинами, принимающими МИ/ДХИ в соотношении 20:1 [27]. Прием инозитола, фолиевой кислоты и марганца во II триместре беременности приводил к позитивным изменениям гликемического статуса и липидного обмена – уменьшался уровень общего холестерина (p=0,0001) и липопротеинов низкой плотности (p=0,0001) [28]. Фармацевтические композиции, содержащие МИ/ДХИ, фолиевую кислоту и марганец, могут обеспечивать более высокую эффективность коррекции инсулинорезистентности (за счет более выраженной редукции высокого уровня глюкозы) и профилактики пороков развития плода. Уровни марганца в плазме крови у пациенток с СПЯ низкие, как и при сахарном диабете 2-го типа [29]. Марганец, МИ, ДХИ, увеличивая чувствительность яичников к гонадотропинам, создают условия для восстановления овуляторных менструальных циклов [29].
Кроме того, у пациенток с СПЯ в 3 раза чаще встречается гипергомоцистеинемия по сравнению со здоровыми, что также приводит к ановуляции и может сопровождаться прерыванием беременности [1, 30]. Дотация фолатсодержащими ВМК позволяет нормализовать уровень гомоцистеина.
Заключение
СПЯ существенно влияет на репродуктивное здоровье, приводя к стойким эндокринным нарушениям, в связи с чем продолжение поиска эффективных и безопасных методов коррекции остается высокоактуальной проблемой. Перспективным направлением в ведении пациенток с СПЯ является использование инозитолов, которые способствуют нормализации менструальной и репродуктивной функции. Применение ВМК на основе МИ/ДХИ в соотношении 5:1 приводило к нормализации ритма менструаций и восстановлению овуляции у женщин с СПЯ при хорошей переносимости. Для подтверждения полученных данных, оценки свойств инозитолов необходимо проведение более крупных исследований.



