Чаще всего развитие железодефицитных состояний (ЖДС) обусловлено перерасходом железа во время беременности [1, 2]. К факторам, предрасполагающим к возникновению дефицита железа (ДЖ), относятся: 1) истощение запасов микроэлемента у 40–60% женщин до беременности; 2) интенсификация эритропоэза, увеличение эритроцитарной массы; 3) потребление плодом железа из материнского депо, вследствие которого у матери формируется отрицательный баланс железа [3, 4].
Поступление железа в организм обеспечивается его абсорбцией в желудочно-кишечном тракте, которая зависит от ряда факторов, связанных как с алиментарными формами поступающего железа, так и с индивидуальными особенностями организма. Наиболее интенсивно железо всасывается в двенадцатиперстной кишке и верхних отделах тонкого кишечника. Процесс всасывания железа определяется его количеством в пище, биологической доступностью, а также потребностью организма [1, 5].
Как известно, различают предлатентный, латентный и манифестный дефициты железа (ПДЖ, ЛДЖ и МДЖ). Частота развития ЖДС у беременных зависит от многих факторов (регион, паритет, питание, сопутствующие заболевания и др.). Однако безусловным является тот факт, что с прогрессированием беременности частота ЖДС возрастает в 3–3,5 раза [5, 6]. Следует отметить, что сведения о частоте ПДЖ и ЛДЖ среди беременных и родильниц весьма ограничены. По некоторым данным, к концу беременности ДЖ развивается в скрытой или в явной форме у всех без исключения беременных [2, 7].
Как правило, анемия в I триместре беременности встречается редко. Около 50% ЖДА развивается во II триместре после 25-й недели беременности, на долю III триместра приходится 40% и только 10% случаев МДЖ у беременных выявляют в I триместре [5, 7].
В отечественной литературе преобладает мнение, что ДЖ при беременности может выявляться у 99% беременных, если исследовать уровень сывороточного железа, а на долю ЖДА приходится 90% всех случаев анемии у беременных [8–10]. Однако в последние годы появилась другая точка зрения, согласно которой ЖДА не является самым частым видом анемии у беременных. Так, частота ЖДА (по уровню ферритина сыворотки) среди всех беременных с анемиями составила в I триместре 50%, во II – 30%, в III – 40% [3, 5]. Кроме ЖДА, одной из наиболее частых причин снижения уровня гемоглобина (Hb) во время беременности, по мнению некоторых исследователей, является недостаточность эритропоэтина (ЭПО), развивающаяся на фоне инфекционно-воспалительных заболеваний (гестационный пиелонефрит, урогенитальные инфекции и др.) и экстрагенитальной патологии [11–13].
Механизм развития ЖДС у беременных до конца не изучен. Развитие ЖДС при беременности является следствием нарушения равновесия между повышенным расходом железа и его поступлением в организм. ЖДС (ПДЖ, ЛДЖ и МДЖ) у беременных и родильниц представляют собой последовательные и обратимые стадии процесса потери или накопления запасов железа в организме и сопровождаются формированием патогенетических вариантов (компенсированного, субкомпенсированного и декомпенсированного) с взаимосвязанными изменениями показателей всех фондов метаболизма железа – транспортного, функционального, запасного и регуляторного. Значительная роль в развитии ЖДС у беременных отводится ЭПО, участнику системы железорегуляторного отдела метаболизма железа. ЭПО вырабатывается в почках и оказывает стимулирующий эффект на костный мозг, способствует пролиферации ранних эритроидных предшественников, поддерживает их выживание при созревании (препятствует апоптозу), оказывает стимулирующий эффект на синтез Hb. Определяющими факторами механизма обратной связи, регулирующими скорость продукции эритроцитов (RBC), являются гипоксия, уровень ЭПО и концентрация Hb. У беременных и родильниц при развитии ЖДС отмечается снижение уровня коэффициента адекватности (КА) продукции ЭПО пропорционально стадии ДЖ. Нарушение функционирования железорегулирующего отдела метаболизма железа (неадекватная продукция ЭПО, несоответствие уровня ЭПО степени снижения Hb) наблюдается при МДЖ у беременных и родильниц и характеризуется уровнем КА ЭПО <0,9. Частота неадекватной продукции ЭПО у родильниц пропорциональна степени тяжести МДЖ: у 12% родильниц при легкой степени тяжести; у 50% – при средней и у 80% – при тяжелой степени тяжести МДЖ. Эффективность лечения препаратами железа беременных с ЖДС во многом зависит от уровня эндогенного ЭПО. У беременных с адекватным уровнем ЭПО эффективность лечения в 2–2,5 раза выше по сравнению с беременными с неадекватным уровнем [1, 2, 6, 14, 15].
В связи с участием железа в окислительно-восстановительных процессах, реакциях кислородозависимого свободнорадикального окисления и антиокислительной системе, его дефицит проявляется нарушением этих процессов. Так, у беременных происходит прогрессирование гемической гипоксии, активации свободнорадикального окисления, коррелирующие со степенью тяжести ЖДА. Кислотно-основное состояние остается стабильным у беременных с ЖДА легкой и средней степени тяжести. При тяжелой степени ЖДА развивается компенсированный метаболический ацидоз. Активация свободнорадикального окисления и перекисное окисление липидов свидетельствуют о дестабилизации биологических мембран клеток, нарушении трансмембранного переноса ионов, изменении возбудимости и функциональной активности различных органов и тканей, в частности мышечных [5, 7].
При ДЖ нарушаются механизмы общей и тканевой резистентности (изменение синтеза интерлейкина-2, Т-киллеров даже при ЛДЖ), происходит снижение фагоцитарной активности лейкоцитов и комплементарной активности сыворотки крови, изменение функциональных показателей Т-лимфоцитов, пространственно-временной организации функциональной активности фагоцитов.
Из других нарушений в организме беременной, обусловленных ДЖ, отмечаются выраженные изменения белкового обмена, функционально сопряженного с метаболизмом железа (гипоальбуминемия, диспротеинемия), возрастает содержание α-2 и β-глобулинов, концентрация церулоплазмина, снижается уровень γ-глобулинов [2, 3, 13].
У больных ЖДА происходят сложные вегето-соматические нарушения. Наблюдаемый у них дисбаланс в вегетативной регуляции сердечной деятельности в сторону преобладания симпатикотонии оказывает влияние на клиническую картину. Это проявляется кардиалгией и изменениями при проведении электрокардиографии.
Таким образом, при ЖДС развивается тотальная органная патология с функциональными и органическими изменениями в тканях. Закономерно, что как вышеизложенные, так и другие метаболические нарушения в организме матери, связанные с ДЖ, оказывают отрицательное воздействие на формирование и функционирование фетоплацентарного комплекса (ФПК), рост и развитие плода, течение беременности, родов, послеродового периода, состояние новорожденного, а также последующее психическое, физическое и интеллектуальное развитие детей не только на протяжении первых 2 лет, но и в более отдаленные возрастные периоды жизни [8, 14].
К последствиям ЖДС относятся: увеличение частоты возникновения во время беременности невынашивания, преэклампсии, преждевременных родов, плацентарной недостаточности, задержки роста и внутриутробной гибели плода, слабости родовой деятельности, различных осложнений в послеродовом периоде, гипогалактии у родильниц.
Формирование и функционирование ФПК, в том числе и при ДЖ, у матери во многом определяется состоянием ангиогенеза. Гипоксия, которая развивается при ЖДС, оказывает стимулирующее влияние на ангиогенез в плаценте, что является компенсаторной реакцией. В связи с этим понятен интерес к проблеме влияния ЖДС на рост плаценты и ангиогенез. В частности, известно, что низкий уровень сывороточного ферритина в ранние сроки гестации ассоциируется с повышенной васкуляризацией плаценты при доношенной беременности, а ранняя анемия у беременных приводит к гипертрофии плаценты и повышенному количеству капилляров на единицу площади ворсин, что указывает на стимулирующее влияние гипоксии на ангиогенез и служит компенсаторной реакцией [3, 11].
Имеются данные об обратной корреляции между размерами плаценты и уровнем Hb, начиная с 22 недель гестации. По литературным данным, ЖДА при беременности ассоциируется с увеличением размеров плаценты при рождении, что, по-видимому, обусловлено влиянием ЖДС на ангиогенез ворсин трофобласта. При исследовании ультраструктуры плацент, даже у беременных с ЖДА легкой степени выявлялись признаки формирующейся плацентарной недостаточности. У женщин с невынашиванием беременности как при МДЖ, так и при ЛДЖ выявлена прямая корреляционная зависимость между уровнями сывороточного ферритина (СФ) и плацентарного лактогена, что свидетельствует о сопряженности метаболических нарушений, происходящих в системе мать-плацента-плод. Значительную роль железо играет в функционировании ФПК. ЖДС оказывают неблагоприятное воздействие на состояние ФПК, новорожденного и его адаптацию, выраженность которого зависит от длительности течения и степени тяжести анемии [5, 10, 13].
Наиболее доказанными осложнениями беременности, ассоциированными с ДЖ, являются угроза прерывания беременности и преждевременные роды. При ЖДС их частота возрастает от 28 до 40%. Имеются данные, что при уровне Hb у матери ниже 90 г/л атрибутивный риск развития преждевременных родов составляет 60%. По другим данным, для беременных с анемией относительный риск преждевременных родов и рождения детей с низкой массой тела составляет 2,7 и 3,1 соответственно. В патогенезе преждевременных родов при ЖДА ключевую роль играют гипоксия, оксидативный стресс и инфекция. Увеличение частоты преждевременных родов при ЖДА закономерно при развитии анемии до 20 недель беременности. Ряд исследователей указывают, что у беременных с ЖДА с I триместра имеется повышенный риск преждевременных родов (до 37 недель) и рождения детей с низкой массой тела, менее 2500 г. Вместе с тем влияние анемии, возникшей после 30 недель беременности, на частоту преждевременных родов доказано не было. При ДЖ у беременных в 1,5–2 раза чаще по сравнению с популяцией развивается преэклампсия [1, 6, 9].
Экспертами ВОЗ принята следующая классификация анемии у беременных: анемия легкой степени тяжести – концентрация Hb в крови от 90 до 110 г/л; умеренно выраженная анемия – концентрация Hb в крови от 89 до 70 г/л; тяжелая анемия – концентрация Hb в крови менее 70 г/л [2].
В большинстве случаев для коррекции ЖДА в отсутствие специальных показаний препараты железа следует назначать внутрь. Парентеральный путь введения препаратов железа у большинства беременных без специальных показаний считается нецелесообразным [5, 8, 12].
Цель – изучение эффективности профилактики и терапии ЖДС у беременных препаратом пролонгированного действия, содержащим сульфат железа (II) («Тардиферон»).
Материалы и методы
Под наблюдением находились 157 беременных с одноплодной беременностью и железодефицитной анемией легкой степени, получавших терапию препаратом пролонгированного действия, содержащим сульфат железа (II) – 247,25 мг, в пересчете на железо – 80 мг («Тардиферон»).
Критериями включения беременных в исследование явились: концентрация гемоглобина от 90 до 110 г/л, сывороточного железа ≤12,5 мкмоль/л, ферритина ≤20 мкг/л, гестационный срок 30–34 недели. Продолжительность лечения составила 28 дней, после чего оценивались показатели гемограммы. Оценку эффективности терапии определяли по динамике гематологических показателей и показателей обмена железа.
Критерии исключения: гиперчувствительность к препаратам железа, другие виды анемии, противопоказания к применению препарата «Тардиферон».
У всех женщин были проведены сбор анамнеза заболевания, оценка общего статуса, акушерско-гинекологический осмотр. У каждой беременной до начала исследования и через 4 недели проводили определение гематологических и феррокинетических параметров: гемоглобина (Hb), гематокрита (Ht), RBC, сывороточного железа (СЖ), ферритина (СФ), трансферрина (ТФ), а также определяли коэффициент насыщения трансферрина железом (КНТ). После родов определяли уровень Hb, Ht, RBC.
Количество RBC, концентрацию Hb в периферической крови, показатель Ht определяли на приборе Micros 60 (Франция). Определение концентрации CЖ, СФ и TФ в сыворотке осуществлялось на биохимическом анализаторе Коnе Ultra (Финляндия) с использованием стандартных реактивов. КНТ, отражающий процент насыщения трансферрина железом, определяли по стандартной формуле.
В последнее время одним из наиболее эффективных препаратов для профилактики и лечения ЖДС у беременных является «Тардиферон» [12]. Одна таблетка с пролонгированным высвобождением препарата «Тардиферон», покрытая пленочной оболочкой, содержит железа сульфат × 1½ H2O — 247,25 мг (что соответствует концентрации железа 80 мг). Основу таблетки составляет специальный запатентованный полимерный комплекс в виде матричной структуры, в которую включен активный ингредиент Fe2+, что обеспечивает лучшую переносимость препарата и повышает биодоступность и постепенное высвобождение двухвалентного железа из препарата. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата со стороны желудочно-кишечного тракта. После приема препарата всасывание железа происходит главным образом в двенадцатиперстной кишке и в проксимальном отделе тощей кишки. «Тардиферон» принимают перорально (внутрь), при этом предпочтительно принимать лекарственное средство до или во время приемов пищи, запивая водой.
В профилактических целях препарат назначают по 1 таблетке в день или через день на протяжении последних двух триместров беременности (или начиная с 4-го месяца). При лечении железодефицитной анемии «Тардиферон» назначают по 2 таблетки в день.
Следует отметить, что доза препарата может варьировать, рассчитывается индивидуально и адаптируется в соответствии с общим дефицитом железа по следующей формуле: общий дефицит железа (мг) = масса тела (кг) × (нормальный уровень гемоглобина – уровень гемоглобина больного) (г/л) × 0,24 + железо запасов (мг).
Для статистического анализа и построения графиков использовались пакеты статистических программ Statistica 10 и IBM SPSS Statistics 21.0. Для проверки гипотезы о нормальном распределении использовался критерий Шапиро–Уилка, для проверки равенства дисперсий – критерий Левина. Статистический анализ между зависимыми группами проводился с помощью парного t-критерия Стьюдента при соблюдении нормального распределения. Сравнение групп по качественным признакам проводилось с помощью точного критерия Фишера. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Результаты и их обсуждение
Возраст беременных колебался от 25 до 35 лет и в среднем составил 29,7 (1,5) года. Исходное значение гемоглобина колебалось от 90 до 110 г/л и в среднем составило 97,4 (1,9) г/л.
Принимая во внимание указание большинства исследователей [1, 11, 14] на высокую частоту осложнений в период беременности у пациенток с ЖДС, был проведен анализ течения беременности, родов, послеродового периода и неонатальных исходов.
Структура осложнений настоящей беременности представлена в таблице 1.
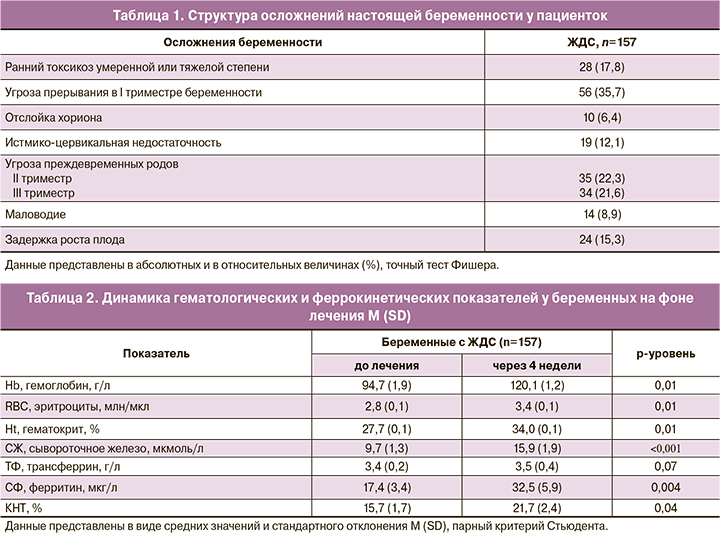
Как видно из данных, представленных в таблице 1, у пациенток с ЖДС в I триместре часто отмечались ранний токсикоз умеренной и тяжелой степени (17,8%) и ретрохориальная гематома (по данным УЗИ) (n=6,4%), а также угроза прерывания беременности (35,7%).
Во II триместре течение беременности осложнялось угрозой прерывания (22,3%) с формированием истмико-цервикальной недостаточности, потребовавшей хирургической коррекции (7,0%) или применения акушерского пессария (5,1%).
В III триместре более высока частота угрозы преждевременных родов (21,6%), задержки роста плода (15,3%), маловодия (8,9%).
Через естественные родовые пути родоразрешены 120 (76,4%) беременных, путем операции кесарева сечения – 37 (23,6%). У всех женщин родились живые дети в удовлетворительном состоянии, из них 149 (94,9%) доношенных. Средняя масса тела составила 3770 (77) г. Патологической кровопотери не было отмечено.
Был проведен скрупулезный анализ характера жалоб женщин при беременности и после родоразрешения. Основные жалобы: шум в ушах, мышечная слабость, головокружение, утомляемость, одышка при физической нагрузке.
После проведенного курса лечения препаратом «Тардиферон» жалобы на одышку и слабость исчезли у всех пациенток. При этом клинический эффект был достигнут через 2 недели приема препарата, а нормализация гематологических показателей достигнута через 4 недели.
Уровень Нb, количество RBC, Ht, СЖ, ТФ, СФ, КНТ в сыворотке крови у обследованных беременных приведены в таблице 2 и на рисунке.
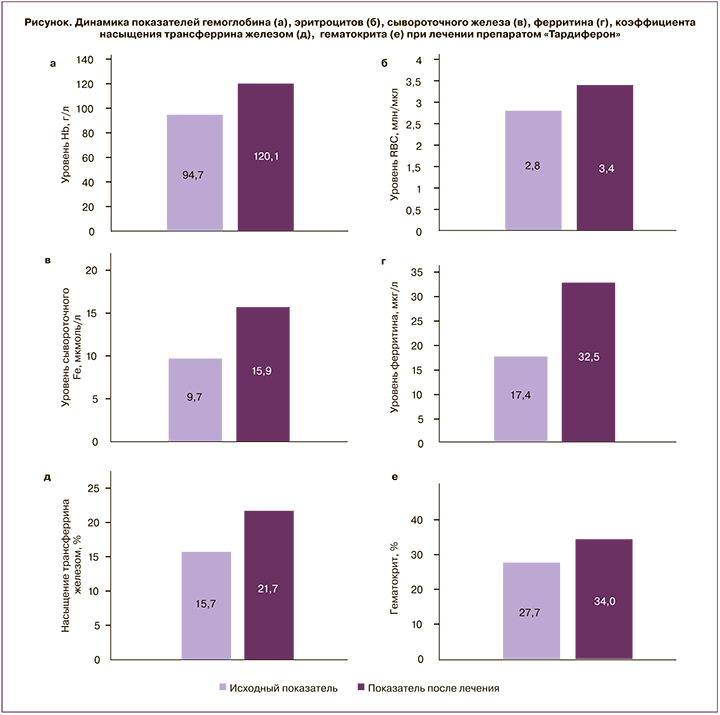
Как видно из таблицы 2, у беременных, получавших терапию анемии, обнаружено статистически значимое повышение как гематологических показателей (Hb и количества RBC, Ht), так и показателей обмена железа в сыворотке крови: уровня CЖ, СФ, КНТ. Для объективной оценки эффективности лечения был подсчитан рост каждого показателя по отношению к исходному уровню, выраженный в прќоцентах. Прирост средних значений исследованных показателей на фоне лечения соответствовал удовлетворительному результату лечения. Кроме того, отмечены статистически значимые различия в уровне показателей обмена железа и гемограммы после терапии препаратом «Тардиферон».
Следует отметить, что по данным анализа гематологических и феррокинетических показателей после родоразрешения у пациенток имелось их снижение. Исходя из этого и согласно рекомендациям по приему препарата «Тардиферон» в профилактических дозах все пациентки, вошедшие в данное исследование, после родоразрешения в течение 1 месяца продолжили прием препарата [5, 7, 8]. Лечение ЖДА всегда длительно, а эффективность напрямую зависит от переносимости препарата: хорошая переносимость обеспечивает высокую приверженность к лечению и, таким образом, увеличивает вероятность успеха терапии.
По данным литературы, применение солевых препаратов железа, особенно их таблетированных форм без пролонгированного высвобождения, может вызывать токсичность и нежелательные побочные явления: запор, боли в эпигастральной области, рвоту, понос, тошноту, металлический привкус [5, 9, 15].
В нашем исследовании при лечении препаратом «Тардиферон» побочные эффекты отмечены у 7 (4,5%) беременных, но это не потребовало отмены препарата, что свидетельствует о хорошей переносимости и, соответственно обеспечит более высокую приверженность к лечению.
Эффективность применения препаратов пролонгированного действия, содержащих сульфат железа (II) («Тардиферон»), была показана в рандомизированном плацебо-контролируемом исследовании A. Krafft и соавт. [16], в котором терапия 80 мг сульфата железа назначалась через 24–48 ч после родов, а оценка гематологических показателей проводилась в течение 12 недель применения. В группе пациенток, получавших терапию, были отмечены увеличение уровней ферритина (p<0,001), насыщения трансферрина железом (p=0,03), гемоглобина (p=0,02) и снижение уровней растворимых рецепторов трансферрина (p=0,02) и гипохромных эритроцитов (p=0,04).
В исследовании S. Palacios [17] был представлен обзор эффективности и безопасности применения различных групп препаратов железа на основании 24 исследований и сделан вывод о том, что препарат железа пролонгированного действия, содержащий сульфат железа (II), обладая хорошей биодоступностью, эффективностью и переносимостью, остается установленным и стандартным методом лечения ЖДС.
Таким образом, на основании анализа международных исследований и полученных нами данных можно сделать вывод о том, что при ЖДС «Тардиферон» обладает выраженной терапевтической эффективностью и имеет высокую безопасность. Он характеризуется хорошей переносимостью со стороны ЖКТ, не взаимодействует с компонентами пищи и применяемыми одновременно хелатными лекарственными средствами.
Таким образом, профилактика и терапия ЖДА у беременных препаратами железа пролонгированного действия являются высокоэффективными, приводят к нормализации показателей гемограммы, улучшению общего состояния пациенток, снижению акушерских и неонатальных осложнений.



