Эндометриоз – хроническое заболевание, характеризующееся доброкачественным разрастанием ткани, по морфологическим и функциональным свойствам схожей с эндометрием, вне полости матки. Встречаемость колеблется от 2 до 11% среди женщин с бессимптомным течением, от 5 до 50% – среди женщин с бесплодием [1]. Одно из наиболее часто диагностируемых проявлений эндометриоза –эндометриоидные кисты яичников [2]. По различным данным, частота рецидивов эндометриоза после хирургического лечения через 1–2 года составляет 15–21%, в течение 2– 5 лет при адекватном удалении очагов – 12–30%, спустя 5 лет – 36–47%, а через 5–7 лет – 50–55% [3]. Имеются доказательства снижения овариального резерва у женщин с бесплодием после проведения оперативного вмешательства, поэтому повторные цистэктомии должны выполняться строго по показаниям [4]. Согласно клиническим рекомендациям, пациентам назначают оперативное и гормональное лечение [5].
По данным литературы, при назначении послеоперационного лечения совокупная частота рецидивов значительно отличалась в возрастнойгруппе 20–29 лет (8,1% против 43,3%; р<0,001) и 30–39 лет (5,4% против 22,5%, р=0,007), но не отличалась в группе 40–45 лет (4,5% против 10,2%; р=0,901) [6]. Из этого следует, что риск рецидива эндометриом снижается с возрастом.
Известно, что желательно выполнить одну операцию в жизни женщины по поводу эндометриоза. Отмечено снижение овариального резерва после лапароскопической резекции яичников [6]. Показано, что кора яичников при наличии эндометриом растягивается и истончается, вызывая структурные изменения, которые негативно влияют на систему стероидогенеза и фолликулогенеза [7].
Воспаление, вызванное эндометриозом, изменяет микроокружение с повышением уровней воспалительных цитокинов, факторов роста и ангиогенных факторов, которые значительно нарушают фертильность. Например, интерлейкины напрямую влияют на подвижность сперматозоидов; фактор некроза опухоли-α, активные формы кислорода, образующиеся при эндометриозе, препятствуют взаимодействию ооцитов и сперматозоидов, снижают качество ооцитов.
Согласно клиническим рекомендациям Минздрава России 2020 г. [5] по лечению эндометриоза, медикаментозная терапия включает прогестагены и агонисты гонадотропин-рилизинг-гормона (аГнРГ).
Выраженным клиническим эффектом для лечения и профилактики рецидивов эндометриоза среди всех гестагенов в настоящее время обладает диеногест в стандартной дозировке 2 мг.
М.И. Ярмолинская оценила данные о реализации репродуктивной функции у 314 больных с наружным генитальным эндометриозом и бесплодием в возрасте от 27 до 39 лет после терапии диеногестом. После гормономодулирующей терапии диеногестом беременность наступила у 106 (33,8%) женщин; из них в естественном цикле – у 41,5% и в результате проведения процедуры ЭКО – у 58,5% пациенток. У 33% женщин беременность наступила через 3–5 циклов после отмены диеногеста [8].
В связи с актуальностью проблемы проведено наблюдательное исследование пациенток с эндометриоидными кистами в послеоперационном периоде.
Цель исследования: оценить отдаленные результаты гормонального лечения пациенток после лапароскопической цистэктомии по поводу эндометриоидной кисты яичника.
Материалы и методы
Настоящее исследование проводилось с сентября 2020 г. по сентябрь 2022 г. на базе клиники «Семейная» (Москва) – клинической базе кафедры акушерства, гинекологии и перинатологии Института клинической медицины Сеченовского Университета.
Критерии включения: репродуктивный возраст пациенток, морфологически подтвержденный эндометриоз яичников I–II стадии по классификации эндометриоидных кист яичников под редакцией Л.В. Адамян, В.И. Кулакова, отсутствие противопоказаний для приема диеногеста, комбинированных оральных контрацептивов (КОК), аГнРГ (подозреваемые прогестагензависимые новообразования, кровотечения из влагалища неясной этиологии, нарушения функции или злокачественные заболевания печени в настоящее время и в анамнезе, период грудного вскармливания, возраст до 18 лет), информированное согласие пациентки на участие в исследовании и прием препарата в указанной дозировке.
Критерии исключения: эндометриоз яичников III–IV стадии по классификации эндометриоидных кист яичников под редакцией Л.В. Адамян, В.И. Кулакова, а также его инфильтративные формы, аденомиоз, злокачественные опухоли органов репродуктивной системы, отказ от участия в исследовании или невыполнение рекомендаций врача.
Под наблюдением находились 56 пациенток в возрасте от 18 до 43 лет (средний возраст – 30,1 (3,01) года). Всем больным проводились комплексное клиническое обследование, оперативное вмешательство в объеме лапароскопической цистэктомии и амбулаторное наблюдение в послеоперационном периоде в течение 6–12 месяцев. Диагноз эндометриоидной кисты яичника гистологически верифицирован.
Болевой синдром оценивали по визуально-аналоговой шкале (ВАШ).
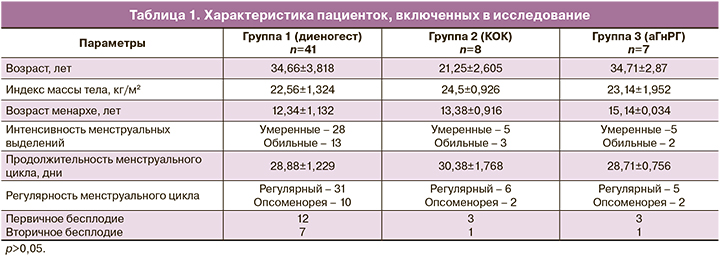
Пациентки были разделены на 3 группы. В 1-й группе (n=41 (74,4%)) пациентки принимали диеногест (препарат «Зафрилла») в ежедневной дозировке 2 мг. Длительность терапии составила 24 недели.
Во 2-й группе (n=8 (13,9%)) пациентки с целью контрацепции принимали препарат «Силует», содержащий 2 мг диеногеста.
В 3-й группе (n=7 (11,6%)) пациентки получали терапию аГнРГ в дозе 3,75 мг (1 инъекция) внутримышечно каждые 28 дней 6 месяцев.
Клиническая характеристика пациенток трех групп представлена в таблице 1.
Динамическое наблюдение было продолжено спустя 6 и 12 месяцев терапии.
Результаты и обсуждение
Проведен анализ частоты и характера бесплодия у всех пациенток. В данной выборке первичное бесплодие встречалось у 12/41 (32 %) женщин, вторичное – у 7/41(16%). В 3-й группе первичное бесплодие диагностировали у 3/7(42,8%) женщин. Статистически незначимо.
Жалобы на дисменорею, диспареунию, хроническую тазовую боль предъявляли большинство женщин. Согласно проведенной оценке по ВАШ, четко прослеживается снижение интенсивности болевого синдрома на фоне проводимой терапии через 3 и 6 месяцев у всех пациенток (табл. 2). Метаанализ 6 рандомизированных исследований, включавших женщин с прогрессирующим заболеванием (III или IV стадия), в которых сравнивалось послеоперационное лечение аГнРГ, диеногестом или КОК в течение 3–6 месяцев с отсутствием послеоперационного лечения или плацебо, выявил значительное снижение показателей боли по завершении терапии в группах лечения, хотя преимущества не были отмечены при более длительном наблюдении (до 18 месяцев) после прекращения терапии [9].
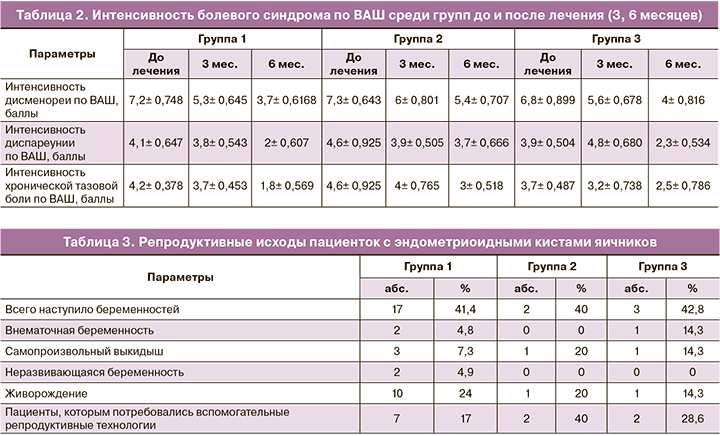
При оценке эффективности преодоления бесплодия у пациенток исследуемой когорты было установлено, что у женщин, получивших терапию диеногестом, частота наступления беременности сопоставима с результатом в группе пациенток, получивших аГнРГ (соответственно 17/41 (41,5%) против 3/7(42,8%)). Во 2-й группе 3/8 пациентки продолжили прием препарата «Силует», 5/8 женщин отменили прием препарата в связи с появлением репродуктивных планов (табл. 3).
В связи с этим представлял особый интерес анализ исходов наступивших беременностей. По нашим данным установлено, что при лечении с использованием диеногеста доля живорождений от общего числа наступивших беременностей оказалась выше по сравнению с 3-й группой. Однако эти различия статистически незначимы в виду малого количества больных.
Фиксированы нежелательные явления при приеме диеногеста, препарата «Силует», аГнРГ. Диеногест, по нашим данным, имел наименьшие побочные эффекты. Ни одна пациентка не отметила появления приливов, сухости во влагалище и каких-либо других состояний, обусловленных дефицитом эстрогенов. В качестве побочных эффектов 16/41 (39%) пациенток отмечали скудные выделения в первые месяцы приема диеногеста. Диспепсические явления в виде тошноты утром наблюдались у 4/41 (9,7%) пациенток в 1-й месяц приема; головную боль в 1-й месяц отметили также 5/41 (12,1%) пациенток. Повышение индекса массы тела отметили 6/41(14,6%) пациенток в первые недели приема, однако спустя 3 месяца наблюдали нормализацию веса. Среди пациенток 1-й группы не было отмечено снижения либидо, депрессии или других эмоциональных расстройств, существенно влияющих на качество жизни.
Следует отметить, что пациенты 3-й группы отмечали такие симптомы, как приливы (5/7 (71%)), гипергидроз (2/7 (28,6%)), сухость во влагалище (2/7 (28,6%)), снижение либидо (3/7 (42,8%)), эмоциональная лабильность (2/7 (28,6%)), депрессия (2/7 (28,6%)), головные боли (2/7 (28,6%)). Очевидно, что пациенты, получавшие аГнРГ, подвержены побочным эффектам, связанным с дефицитом эстрогенов.
На фоне приема препарата «Силует» женщины отмечали головную боль (2/8 (25%)), головокружение (1/8 (12,5%)), эмоциональную лабильность (2/8 (25%)), диспепсию (2/8 (25%)), мастодинию (1/8 (12,5%)), прибавку массы тела в первые месяцы терапии (3/8 (37,5%)), межменструальные кровянистые выделения (3/8 (37,5%)).
Данные побочные проявления у пациенток всех групп не явились показанием для отмены препаратов, купировались симптоматически или прекращались на более поздних сроках лечения.
После оперативного вмешательства пациентки принимали гормональные препараты и находились на динамическом наблюдении с контрольными явками через 6 и 12 месяцев. При обследовании пациенток рецидив эндометриоза был выявлен у 3/41 (7,3%) женщин 1-й группы, у 2/8 (25%) пациенток 2-й группы и 1/7 (14,2%) из 3-й группы.
Значительная часть опубликованных исследований, касающихся рецидива эндометриоза, была сосредоточена на локализации заболевания в яичниках, поскольку это одна из наиболее распространенных форм эндометриоза; кроме того, эндометриому яичников можно легко обнаружить при последующем обследовании. Однако частота рецидивов эндометриоидной кисты яичников после лапароскопической операции значительно различается. Это связано с отсутствием унифицированного определения рецидива (боль или рецидив кисты), периода наблюдения, характеристики пациентов, лапароскопической техники (иссечение или абляция) с послеоперационным лечением или без него и классификации различных стадий заболевания. Учитывая эти ограничения, Guo S.W. [10] подсчитал, что средняя частота рецидивов за 2 года составила 19,1% (95% доверительный интервал 17,9–20,4%). Полученные результаты согласуются с данными ряда исследователей, в которых частота рецидивирования эндометриоза в течение 1–5 лет после хирургического лечения варьирует от 8 до 30% и доказана эффективность диеногеста в снижении частоты рецидивов [11].
Заключение
Эндометриоидные кисты яичников являются распространенным заболеванием у женщин репродуктивного возраста. Показано, что гормональное лечение после операции снижает количество рецидивов заболевания. Для каждой возрастной группы, в зависимости от репродуктивных мотиваций пациенток, применяют разные препараты. При этом необходимо учитывать переносимость того или иного препарата. Диеногест занимает собственную нишу в терапии эндометриоз-ассоциированных тазовых болей, дисменореи и диспареунии у пациенток с эндометриоидными кистами яичников в качестве послеоперационной долгосрочной терапии. Препарат «Зафрилла» является препаратом выбора для пациенток, которые не планируют беременность в ближайшее время.



