За последние десятилетия частота ожирения среди женщин детородного возраста резко увеличилась, что становится предметом для беспокойства здравоохранения всей страны [1]. Все больше появляется неутешительных данных о том, что ожирение до беременности и на ее фоне – это значимые риски как для здоровья матери, так и для будущего потомства [2]. Доказано, что ожирение снижает фертильность и увеличивает время, необходимое для зачатия. Если речь заходит о вспомогательных репродуктивных технологиях (ВРТ), то среди женщин с ожирением ниже результативность в программах экстракорпорального оплодотворения (ЭКО), им требуется больше попыток для достижения беременности [3]. При наступлении беременности среди женщин с ожирением выше риск ранней спонтанной ее потери [4]. Частота пороков развития эмбриона также увеличивается, что проявляется в основном патологией нервной трубки и пороками сердца [5]. Во второй половине беременности при ожирении возрастает риск развития гестационного сахарного диабета (ГСД), преэклампсии (ПЭ), артериальной гипертензии (АГ) [6]. Кроме того, шансы на кесарево сечение (КС) у женщин с ожирением в два раза выше, чем у беременных с исходно нормальной массой тела, повышен риск развития анестезиологических и послеродовых осложнений [7].
Патогенез ожирения сложен и не до конца изучен. Доказано наличие метаболической и гормональной дисрегуляции, хронического воспаления, нарушения липидного обмена, формирования инсулинорезистентности (ИР) и стресса эндоплазматического ретикулума [8]. Известно, что для нормального функционирования организма необходим баланс между антиоксидантной защитой и свободнорадикальным окислением. Если количество свободных радикалов превышает активность антиоксидантной защиты, формируется состояние, называемое оксидативным стрессом (ОС) [9]. В настоящее время все больше внимания уделяется изучению роли ОС, который может быть первопричиной формирования многих патологических изменений в организме человека либо усугублять их [10]. Реактивные формы кислорода в физиологической концентрации ведут себя как вторичные мессенджеры в сигнальных путях и являются важными компонентами для нормальной клеточной функции. В то же время они признаны в качестве ключевого фактора запуска многочисленных патологических состояний (сердечно-сосудистые заболевания, рак, диабет), включая и ожирение. Жировая ткань выступает в качестве главного источника синтеза реактивных форм кислорода, которые патологически воздействуют на другие ткани, являясь одними из главных виновников формирования свободного радикального окисления [11]. Этим можно объяснить связь ожирения с развитием других заболеваний [12].
Доказана тесная связь между ОС и воспалением. Повышение уровня провоспалительных цитокинов приводит к активации НАДФН-оксидазного комплекса, который является первичным источником активных форм кислорода [13]. В основе таких патологических состояний, как гипергликемия, гиперлептинемия, эндотелиальная дисфункция, гиперлипидемия, митохондриальная дисфункция, лежит ОС [14]. На первых стадиях ожирения наблюдаются усиление активности антиоксидантных ферментов и снижение оксидативного повреждения (стресса), однако по мере накопления жировой ткани и усугубления хронического воспаления антиоксидантная защита начинает терять свою активность, ОС усугубляется [15].
Известно, что ОС имеет место у человека и при физиологических состояниях, например, во время беременности. Активные формы кислорода участвуют в регуляции ангиогенеза, пролиферации и инвазии трофобласта, что очень важно для формирования здоровой беременности [16]. Как ожирение, так и беременность характеризуются повышением ОС. Наслаивание этих двух состояний приводит к серьезной нагрузке организма, а нарастание уровня свободнорадикального окисления является одним из предполагаемых механизмов, связанных со многими нарушениями репродуктивной функции и периода гестации [17].
Указанные данные фундаментальной медицины явились для нас основанием для изучения баланса оксидативной и антиоксидантной системы у пациенток с ожирением и бесплодием, планирующих программу ВРТ (ЭКО).
Для оценки ОС был выбран маркер 8-OH-дезоксигуанозин, который является наиболее распространенным видом окислительного повреждения нуклеиновых кислот и считается одним из основных биомаркеров ОС, отражающего степень повреждения ДНК, вызванного воздействием активных форм кислорода [18].
Цель исследования – изучить возможность применения препарата «Редуксин Форте» у пациенток с ожирением, планирующих ЭКО.
Материалы и методы
В наблюдение были включены 30 пациенток с бесплодием и ожирением, планирующих проведение программы ЭКО. Пациентки с ожирением имели индекс массы тела (ИМТ) более 30 и впервые диагностированную или ранее существующую ИР (HOMA-IR более 2,7). Критерии включения: возраст до 35 лет, бесплодие, планирование программы ЭКО. Критерии исключения: необходимость других методов ВРТ (использование донорских ооцитов, суррогатное материнство, ИКСИ), мужской фактор бесплодия, врожденные или приобретенные деформации полости матки, эндометриоз 3–4-й степени, наличие тяжелой экстрагенитальной патологии. Участие в исследовании подтверждалось подписанием добровольного информированного согласия. Пациентки перед циклом ЭКО вступали в программу прегравидарной подготовки, которая была рассчитана на 3 месяца. Программа включала рекомендации по питанию и физическим нагрузкам, а также медикаментозную коррекцию ожирения и ИР препаратом «Редуксин Форте» (сибутрамин 10–15 мг/сутки + метформин 850 мг/сутки). С целью регистрации нежелательных явлений и переносимости препарата использовали специальные анкеты.
Все пациентки проходили клинико-лабораторное обследование согласно приказу №107 Н МЗ РФ, включая сбор анамнеза, физикальное и антропометрическое обследования (рост, вес, ИМТ, окружность талии (ОТ), окружность бедер (ОБ), ОТ/ОБ). Дополнительно проводилась оценка уровней инсулина, глюкозы, НОМА-IR, а также маркера ОС 8-OH-дезоксигуанозина (8-OHdG). Определение 8-OHdG в сыворотке крови человека проводили методами биохимической реакции и иммуноферментного анализа на аппарате Multiskan Plus Plate Reader Thermo Fisher Scientific (Type 355, Serial 355019186) при помощи специального программного обеспечения Multisсan Magic v 3.1, с использованием следующих тест-систем: Antioxidant Assay Kit (Item: 709001; Batch: 0519127) «Набор для определения общей антиоксидантной способности»; DNA Damage ELISA Kit (Cat. no.: ADI-EKS-350; Lot.no.: 11011707G) «Иммуноферментный набор для специфического определения и измерения уровня 8-ОН-2-дезоксигуанозина в моче, сыворотке и слюне».
Оценку всех параметров проводили дважды, до и после лечения. По окончании программы прегравидарной подготовки пациентки вступали в программу ЭКО.
Результаты и обсуждение
Средний возраст пациенток, вступивших в программу прегравидарной подготовки, составил 32,0 года. Анамнестическая оценка места проживания и занятости характеризовалась следующими показателями. Большая часть пациенток проживала в городе – 28/30 (93,4%) и только 2/30 (6,6%) – в сельской местности. У 17/30 (56,6%) работа была связана с умственным трудом и малой физической активностью в течение рабочего дня, 6/30 (20%) занимались физическим трудом, 9/30 (30%) не работали.
При оценке акушерско-гинекологического анамнеза было выявлено, что средняя продолжительность бесплодия в группе составляла 5,1 года. У 14/30 (46,6%) бесплодие было первичным, у 16/30 (53,3%) – вторичным. По факторам, классифицирующим бесплодие, группа была гетерогенной. Трубно-перитонеальный фактор имел место у 2/30 (6,67%) пациенток, эндокринный фактор – у 13/30 (43,3%), сочетание трубного и эндокринного бесплодия наблюдалось у 4/30 (13,3%) женщин, у 10/30 (33,3%) – бесплодие неуточненного генеза. В анамнезе среди гинекологической патологии наиболее часто отмечены: доброкачественная дисплазия молочных желез – у 20/30 (66,6%) пациенток, нарушение менструального цикла – у 18/30 (60%), синдром поликистозных яичников – у 11/30 (36,6%) и воспалительные заболевания органов малого таза – у 11/30 (36,6%). Значительно реже встречались: миома матки – у 5/30 (16,6%), гиперпластический процесс эндометрия – у 4/30 (13,3%) и эндометриоз – у 2/30 (6%). Гиперандрогения надпочечникового генеза выявлена у 6/30 (20%) женщин и гипотиреоз – у 6/30 (20%), функциональная гиперпролактинемия установлена у 5/30 (16,6%) пациенток. Известно, что ожирение ассоциировано с развитием экстрагенитальной патологии [19]. Контролируемая АГ имела место у каждой третьей (33,3%) пациентки, у 6/30 (20%) пациенток отмечены заболевания печени и желудочно-кишечного тракта (ЖКТ).
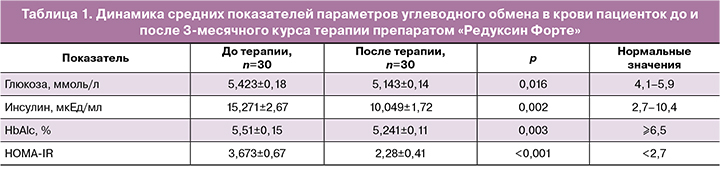
Установлено, что в группе пациенток с ожирением до проведения программы средний уровень глюкозы составлял 5,423±0,18 ммоль/л, инсулина – 15,271±2,67 мкЕд/мл, НОМА-IR – 3,673±0,67, гликированного гемоглобина (HbAlc) – 5,51±0,15%, маркера ОС (8-OHdG) – 0,361±0,082 нг/мл. Таким образом, у пациенток с ожирением 1-й степени до лечения отмечена ИР и повышен 8-OHdG (табл. 1).
После обследования пациентки были включены в программу с акцентом на снижение веса и коррекцию углеводного обмена. В качестве медикаментозной терапии был предложен препарат «Редуксин Форте», одобренный в нашей стране для лечения ожирения и профилактики метаболических нарушений. Препарат представляет фиксированную комбинацию сибутрамина в дозе 10 мг и метформина в дозе 850 мг в одной таблетке. Данная комбинация позволяет повысить эффективность и безопасность терапии ожирения за счет комплексного многофакторного воздействия, при этом сможет увеличить приверженность к терапии за счет простого понятного режима дозирования и удобного способа применения. Эффективность и безопасность совместного применения компонентов препарата подробно изучены в рамках масштабной программы «АВРОРА». Всероссийская неинтервенционная наблюдательная программа «АВРОРА», которая включала наблюдение в динамике за 5812 пациентами разных возрастных групп, показала высокую эффективность комбинированного применения редуксина с метформином в лечении ожирения, коррекции углеводного и липидного обменов, при низкой частоте нежелательных явлений [20]. Кроме того, метформин, являющийся компонентом препарата «Редуксин Форте», является одним из эффективных средств коррекции нарушений ИР, что очень важно в рамках профилактики синдрома гиперстимуляции яичников, частота развития которого в программах ВРТ имеет место в 5–10% случаев [21].
Важным фактором на пути к преодолению бесплодия является время. Доказано, что увеличение продолжительности бесплодия негативно влияет на результативность в программах ЭКО [22]. Важно, чтобы программа прегравидарной подготовки быть оптимизирована по срокам, а на прегравидарном этапе использовали препараты с доказанной эффективностью. В нашем исследовании продолжительность прегравидарной подготовки составляла 3 месяца. По ее завершении проводили сравнительную оценку антропометрических параметров и биохимических показателей. После окончания лечения у женщин с ожирением 1-й степени произошли подтвержденные изменения: снижение веса на 10,8% (90,597±5,79 кг против 80,773±5,58 кг; p=0,017), ИМТ (33,324±1,53 кг/м2 против 29,719±1,55 кг/м2; p=0,002), уменьшение ОТ (96,733±3,92 см против 89,133±3,91 см; p=0,008) и ОБ (114,067±4,40 см против 107,733±3,54 см; p=0,028) (табл. 2).

Кроме улучшения антропометрических характеристик, отмечены положительные изменения биохимических показателей крови (см. табл. 1). Следует подчеркнуть снижение уровня инсулина (15,271±2,67 мкЕд/мл против 10,049±1,72 мкЕд/мл; p=0,002) и индекса НОМА (3,673±0,67 против 2,28± 0,41; p<0,001), а также уровня маркера ОС 8-OHdG (0,361±0,082 нг/мл против 0,240±0,029 нг/мл; p=0,007) (табл. 3).
Нежелательные явления (сухость во рту, головные боли, тошнота) при приеме препарата «Редуксин Форте» за время терапии наблюдались у 7/30 (2,3%) пациенток в начале лечения, они носили преходящий характер и не требовали отмены препарата.
Главной задачей прегравидарной подготовки является создание благоприятных условий для зачатия и беременности, а для пациенток, планирующих ЭКО, еще и повышение результативности ВРТ. Ранее нами было проведено ретроспективное исследование, которое показало, что у пациенток с ожирением частота наступления беременности в программах ВРТ составляет 22,03±10,58%, а у пациенток с нормальной массой тела — 37±9,46% (p=0,04), что доказывает неблагоприятное воздействие ожирения на репродуктивную систему [23].
В последующие 1–3 месяца, после завершения программы прегравидарной подготовки, пациентки планировали вступление в программу ЭКО. После завершения прегравидарной подготовки 4/30 (13,3%) пациентки перенесли вступление в программу на более поздний срок по семейным обстоятельствам. В протокол ЭКО вступили 18/26 (69,2%) пациенток, так как у 8/26 (30,7%) пациенток наступила спонтанная беременность. Из 18 вступивших в программу ЭКО пациенток после прегравидарной подготовки беременность наступила у 8 (44,4%). Таким образом, наши данные показывают, что после лечения частота наступления беременности сопоставима с таковой у пациенток с исходно нормальной массой тела, без ИР.
Заключение
Таким образом, применение лекарственного препарата «Редуксин Форте» в течение 3 месяцев наряду с физическими упражнениями и диетой у пациенток с ожирением 1-й степени, планирующих ЭКО, приводит к снижению инсулина, HbAlc, что отражает коррекцию ИР; снижению маркера ОС 8-OHdG. Клиническим проявлением эффективности предлагаемой программы (физические упражнения, диета и применение препарата «Редуксин Форте») является улучшение антропометрических показателей пациенток. Следует особо подчеркнуть, что, по нашим данным, беременность наступила у 8/18 (44,4%) женщин после ЭКО и у 8/26 (30,7%) женщин в естественном цикле.



