Современное понимание глобального значения дефицита витамина D в развитии различных патологических состояний диктует необходимость не только активного изучения процессов, связанных с дефицитом витамина D, но и разработки рекомендаций по профилактике и лечению гиповитаминоза D в различных группах населения [1]. Беременные женщины и дети раннего возраста являются группой особого внимания в связи с тем, что ранний онтогенез является периодом, когда дефицит витамина D может стать пусковым фактором начала различных заболеваний, проявляя не только краткосрочные эффекты, связанные с состоянием здоровья новорожденного. Дефицит витамина D оказывает влияние и на процессы, определяющие здоровье в долгосрочной перспективе: патология опорно-двигательного аппарата, хронические неинфекционные заболевания (сердечно-сосудистые заболевания: атеросклероз, ишемическая болезнь сердца, сахарный диабет, рак, ожирение), аутоиммунные заболевания, осложнения беременности, нарушения памяти и внимания, психические расстройства, аллергические заболевания, повышенная заболеваемость острыми респираторными заболеваниями и др. [2–5].
Дефицит витамина D у беременных связан с рядом патологических состояний, как со стороны женщины, так и со стороны ребенка, включая преэклампсию, преждевременные роды, задержку внутриутробного развития, что часто связано с изменениями функции плаценты. Несмотря на то, что специфические механизмы эффектов витамина D во время беременности являются недостаточно изученными, известно, что витамин D является критическим для имплантации, плацентации, иммунных процессов и ангиогенеза в плаценте [6, 7]. Витамин D и его метаболиты стимулируют синтез хорионического гонадотропина, плацентарного лактогена, эстрогенов и прогестерона, влияя на течение беременности. Плацента человека экспрессирует все метаболические компоненты, связанные с сигналингом витамина D, включая VDR, RXR, CYP27B1, CYP24A1, CYP2R1. Превращение 25(ОН)D в 1,25(ОН)2D во время беременности происходит в плаценте, почках матери и плода, децидуальной оболочке [8, 9].
Плацента, являясь связующим звеном между матерью и плодом, играет важную роль в метаболизме витамина D при беременности, транспортируя 25(ОН)D и 24, 25-дигидроксивитамин D от матери к плоду, о чем свидетельствует наличие корреляций этих метаболитов в пуповинной крови и крови матери. По данным литературы, концентрация 25-дигидроксивитамина D в пуповинной крови составляет 25–100% уровня в крови матери [8, 9]. Во время беременности сывороточный уровень 1,25(ОН)2D возрастает до 2 раз к 10–12-й неделе гестации и остается максимально высоким в 3-м триместре. Данных об изменении уровней 25(ОН)D в течение беременности недостаточно, однако возросший уровень активности VDR позволяет предположить усиление эффектов витамина D на уровне тканей, обеспечивая благоприятный исход беременности [9, 10].
 Исследования, проведенные в разных регионах мира, указывают на высокую частоту дефицита витамина D у беременных женщин и у новорожденных детей [11–16]. Немногочисленные исследования по изучению обеспеченности беременных витамином D в России показали, что доля женщин с нормальными уровнями 25(ОН)D также весьма невысока [17–21]. Данные факты делают весьма актуальным использование препаратов витамина D, как для профилактики осложнений беременности, так и для обеспечения нормального эмбриогенеза, внутриутробного развития плода, дальнейшего развития организма в периоды раннего детства и подросткового возраста с учетом мощного эпигенетического потенциала витамина D.
Исследования, проведенные в разных регионах мира, указывают на высокую частоту дефицита витамина D у беременных женщин и у новорожденных детей [11–16]. Немногочисленные исследования по изучению обеспеченности беременных витамином D в России показали, что доля женщин с нормальными уровнями 25(ОН)D также весьма невысока [17–21]. Данные факты делают весьма актуальным использование препаратов витамина D, как для профилактики осложнений беременности, так и для обеспечения нормального эмбриогенеза, внутриутробного развития плода, дальнейшего развития организма в периоды раннего детства и подросткового возраста с учетом мощного эпигенетического потенциала витамина D.
На сегодняшний день отсутствуют данные исследований об оценке уровней витамина D в диаде: мать-новорожденный в условиях приарктической зоны Российской Федерации, позволяющие провести оценку ситуации.
Цель настоящего исследования – оценить обеспеченность витамином D новорожденных и рожениц г. Архангельска в диаде «мать-дитя» в зимний период года.
Материал и методы исследования
Исследование проводилось в декабре 2016 года, тип исследования – поперечное. Проведена оценка уровня 25(ОН)D в пуповинной крови и крови матерей 55 новорожденных детей на базе ГБУЗ АО Архангельский клинический родильный дом им. К.Н. Самойловой.
Критерии включения в исследование: проживание матерей в Архангельской области; наличие информированного согласия матери на участие в исследовании.
Критерии невключения: тяжелые заболевания новорожденного, потребовавшие реанимационных мероприятий в родильном зале, отказ матери от участия в исследование.
Протокол исследования одобрен независимым этическим комитетом Северного государственного медицинского университета (г. Архангельск).
Пуповинную кровь собирали в пробирки с анитикоагулянтом в одноразовые системы Vacutainer (Bodywin, Китай) после пересечения пуповины. Взятие крови у матери осуществляли из вены в родильном зале. Кровь центрифугировали при 2000 оборотах в течение 10 минут. Затем отбиралась сыворотка, которая до отправки в лабораторию хранилась в стеклянной пробирке с идентификационным номером при -20 °С.
 Лабораторное количественное определение 25-ОН витамина D – 25(ОН)D в сыворотке крови проводили методом иммуноферментного анализа (ELISA, DRGInstrumentsGmbH, Германия) на базе лаборатории Архангельской детской областной клинической больницы (г. Архангельск). Предел определения – 1,9 нг/мл.
Лабораторное количественное определение 25-ОН витамина D – 25(ОН)D в сыворотке крови проводили методом иммуноферментного анализа (ELISA, DRGInstrumentsGmbH, Германия) на базе лаборатории Архангельской детской областной клинической больницы (г. Архангельск). Предел определения – 1,9 нг/мл.
Обеспеченность витамином D оценивали на основании следующих критериев: нормальным считали содержание 25(ОН)D в пределах 30–80 нг/мл, 20–30 нг/мл соответствовали недостаточности, 10–19 нг/мл – дефициту, а <10 нг/мл – тяжелому дефициту [22].
Статистическую обработку данных проводили с использованием пакета программ STATA (StataCorp., США). Анализ нормальности распределения значений исследованных признаков выполнен при помощи критерия Шапиро–Уилка. Количественные данные представлены в виде медианы (25-й; 75-й процентили). В случае номинальных переменных для вычисления зависимостей между ними применяли кросстабуляционный анализ, статистическую значимость определяли критерием χ2 Пирсона. Различия считали статистически значимыми при р<0,05.
Результаты исследования
Средний возраст матерей составил 28,94±5,19 года, медиана возраста – 29 лет, минимальный возраст – 18 лет, максимальный – 44 года. Анализ выборки показал, что 20 (36,4%) детей родились от первых родов, 30 (54,5%) от вторых родов, 5 (9,1%) детей от третьих и последующих родов. Недоношенными родились 7 (12,7%) детей, 48 (87,3%) родились в сроке гестации от 37 до 42 недель, 2 ребенка (3,64%) были зачаты методом ЭКО. Все дети родились естественным путем.
По данным медицинской документации у матерей были зафиксированы следующие осложнения беременности: анемия на разных сроках беременности у 22 (40%), угроза прерывания беременности у 12 (21,8%) женщин, гестационный сахарный диабет у 5 (9,1%), преэклмапсия у 20 (36,3%), хроническая фетоплацентарная недостаточность была диагностирована у 4 (7,3%) женщин. Отягощенный акушерский анамнез был зафиксирован у 24(43,6%), ожирение – у 2 (3,6%) женщин. В 4(7,3%) случаях женщины курили во время беременности.
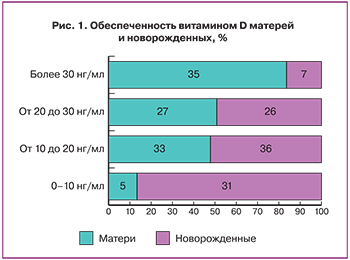
Анализ данных (рис. 1) показал низкую обеспеченность матерей витамином D: лишь 19 (35%) обследованных женщин имели уровни витамина D выше нижней границы нормы (30 нг/мл), большинство обследованных женщин – 18 (33%) – имели уровни 25(ОН)D 10–19 нг/мл, доля матерей с недостаточностью составила 15 (27%), с тяжелым дефицитом – 3 (5%).
Полученные результаты указывают на значительно более низкую обеспеченность витамином D новорожденных по сравнению с матерями: лишь у 4 (7%) детей отмечен нормальный уровень витамина D, 20 (36%) имели уровень, соответствующий дефициту, тяжелый дефицит выявлен у 17 (31%) новорожденных, недостаточность – у 14 (26%). Уровни 25(ОН)D у матерей (Me, Q25-75) и новорожденных составили соответственно 27,8 (18,7–41,7) нг/мл и 14,23 (7,5–22,1) нг/мл. При этом уровни 25(ОН)D у матерей значимо выше, чем у новорожденных (Z=-6,452, р=0,0000), также больше доля матерей с нормальным уровнем 25(ОН)D (35%), по сравнению с новорожденными (7%). Выявлена положительная корреляционная связь между уровнями витамина D у матерей и новорожденных (коэффициент корреляции Спирмена 0,535, р=0,000).
Нами не было выявлено взаимосвязи между уровнем витамина D в пуповинной крови и антропометрическими показателями новорожденных.
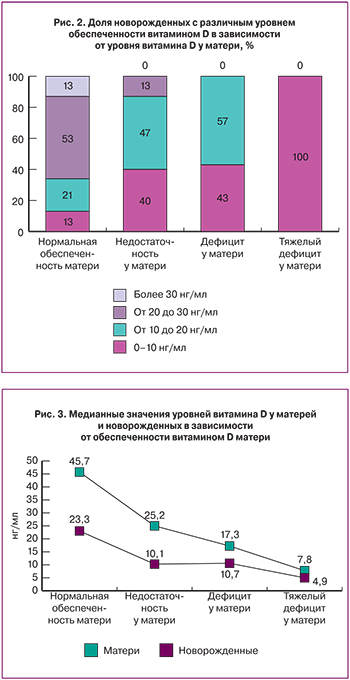
На рис. 2 представлены данные о структуре обеспеченности витамином D новорожденных, в зависимости от обеспеченности матери. У всех детей, рожденных от матерей с тяжелым дефицитом (уровни 25(ОН)D ниже 10 нг/мл) также зафиксирован тяжелый дефицит; у детей, рожденных от матерей с дефицитом (уровни 25(ОН)D 10–19 нг/мл) в 43% отмечен тяжелый дефицит, в 57% – дефицит витамина D; у детей, рожденных от матерей с недостаточностью витамина D (уровни 25(ОН)D 20–30 нг/мл) в 40% выявлен тяжелый дефицит, в 47% – дефицит, в 13% – недостаточность витамина D.
У большинства (53%) детей, рожденных от матерей с нормальными уровнями 25(ОН)D зафиксированы значения 25(ОН)D от 20 до 30 нг/мл; у 21% детей – дефицит; у 13% детей – тяжелый дефицит. Следует отметить, что все 3 ребенка, имеющие нормальные значения витамина D, рождены от матерей с уровнями витамина D от 99,2 до 123,15 нг/мл.
Рис. 3 демонстрирует динамику снижения обеспеченности витамином D новорожденных в зависимости от уровней 25(ОН)D матери, демонстрируя четкую зависимость от материнских значений. Но, тем не менее, представленные на рис. 2 и 3 данные показывают, что наличие у матери значений 25(ОН)D, соответствующих нормальным (более 30 нг/мл), не гарантирует обеспечения потребностей ребенка. Причиной этого явления могут быть различные отклонения в состоянии здоровья матери. Нами выявлена значимая роль отягощенного акушерского анамнеза в развитии тяжелого дефицита (ниже 10 нг/мл) витамина D у новорожденных (точный критерий Фишера 0,04414).
Обсуждение
Полученные данные свидетельствуют о низкой обеспеченности витамином D рожениц и критически низкой обеспеченности новорожденных г. Архангельска, рожденных в период минимальной инсоляции, что подтверждает полученные ранее сведения о низких уровнях витамина D у беременных женщин и новорожденных детей.
Наши результаты иллюстрируют тесную взаимосвязь между уровнями 25(ОН)D матери и ребенка, что соотносится с данными других авторов. Именно обеспеченность матери витамином D, состояние плацентарного барьера являются факторами, определяющими риски развития различных патологических состояний у ребенка в случае протекания беременности в условиях дефицита витамина D. По данным литературы, использование стратегии алиментарной коррекции дефицита витамина D является единственно эффективной для всех групп населения, включая беременных женщин [9].
Следует обратить внимание на желательные значения 25(ОН)D сыворотки крови у беременных, так как результаты нашего исследования показали, что пороговое значение 25(ОН)D, соответствующее 30 нг/мл не гарантирует обеспеченности витамином D ребенка, в то время как нормальные уровни 25(ОН)D в пуповинной крови отмечены в случаях значений 25(ОН)D у матерей от 99,2 до 123,15 нг/мл.
Крайне низкая обеспеченность витамином D новорожденных детей указывает на необходимость адекватной алиментарной коррекции дефицита витамина D с рождения, так как это дети с низкими антенатальными запасами и позднее начало приема препаратов витамина D или использование низких доз препаратов холекальциферола не сможет привести к достижению нормальной обеспеченности ребенка в последующие периоды.
В целом результаты указывают на необходимость проведения дальнейших исследований, направленных на оценку уровней 25(ОН)D в пуповинной крови в разные периоды года и подбор адекватных доз препаратов витамина D у беременных.
Выводы
- Беременные женщины г. Архангельска, роды которых приходятся на период минимальной инсоляции, являются группой риска по развитию дефицита витамина D. Целесообразно определение исходного уровня 25(ОН)D у беременных женщин для назначения соответствующей этому уровню дозы препаратов витамина D.
- Критически низкие уровни витамина D в пуповинной крови указывают на необходимость продуманных коррекционных мероприятий с использованием адекватных схем коррекции дефицита витамина D, как для беременных женщин, так и для новорожденных детей, которым в случае выявления дефицита витамина D у матери необходимо назначение препаратов витамина D с рождения.



