Эндометриоз сегодня прочно лидирует, входя в пятерку наиболее распространенных гинекологических заболеваний. Среди женщин репродуктивного возраста данная патология выявляется у каждой 10-й, приводя к тазовой боли и субфертильности [1]. Связь между эндометриозом и бесплодием неоднозначна [2], однако данные эпидемиологических исследований убедительно доказывают, что частота обнаружения эндометриоза у бесплодных женщин в 6–8 раз выше, чем у фертильных. Вероятность наступления беременности в течение одного менструального цикла у здоровых пар составляет 15–20%, тогда как у пациенток с эндометриозом она снижена до 2–10% [3]. Механизмы инфертильности при эндометриозе точно не установлены, среди них предполагаются эндокринные расстройства, изменение состава перитонеальной жидкости, патология эндометрия [4], а при выраженной распространенности процесса к перечисленным факторам присоединяются нарушение анатомии органов малого таза и снижение количественных и качественных характеристик ооцитов [2, 5]. Наличие заболевания связано с изменениями иммунного ответа, васкуляризации, нервной функции, перитонеальной среды и эутопического эндометрия, что свидетельствует о системном, а не локализованном патологическом процессе [6]. Клеточная и молекулярная теория этиологии эндометриоза как воспаления и эстроген-зависимого нарушения улучшили понимание сути заболевания [7], но не дали ключа к решению проблемы бесплодия. Основной метод лечения наружного генитального эндометриоза (НГЭ) – тщательная лапароскопическая эксцизия и коагуляция патологических очагов, к сожалению, малоэффективна в отношении восстановления фертильности, поэтому в большинстве случаев требуется применение более эффективных методик, таких как экстракорпоральное оплодотворение (ЭКО) [8]. Попытки выявления системных биомаркеров НГЭ и прогностических маркеров исхода программ ЭКО активно проводятся в последние годы, но данные их весьма противоречивы [9]. Одни авторы указывают на статистически значимое повышение уровня сосудисто-эндотелиального фактора роста при умеренно/тяжелых стадиях заболевания [10], а также интерлейкина (ИЛ) -6, ИЛ-8, фактора некроза опухолей (ФНО)-α при НГЭ, что ведет к снижению качества ооцитов и эмбрионов в программе ЭКО у пациенток с эндометриозом [11, 12]; другие указывают на отсутствие значимых различий в уровнях данных показателей [13–15]. Использование вспомогательных репродуктивных технологий (ВРТ) позволяет решить проблему эндометриоз-ассоциированного бесплодия лишь частично. Данные исследований показали, что результативность программ ЭКО при НГЭ отличаются более низкой эффективностью [16, 17], а частота осложнений беременности (выкидыши, преждевременные роды, преэклампсия, задержка роста плода) гораздо выше [3] ввиду присутствия локальных и системных нарушений, свойственных данной патологии. Взаимосвязь данного заболевания с параметрами врожденного иммунитета заставляет искать пути решения проблемы фертильности у пациенток с НГЭ путем изучения в крови, фолликулярной и перитонеальных жидкостях различных медиаторов иммунных реакций (цитокины и факторы роста), а также острофазовых белков, обладающих иммунорегуляторными свойствами. К числу таких белков относятся альфа2-макроглобулин (α2-МГ), альфа1-антитрипсин (α1-АТ) и лактоферрин (ЛФ). Все три белка являются не только острофазовыми (а2-МГ – отрицательный реактант, α1-АТ и ЛФ – положительные), α2-МГ и α1-АТ – основные ингибиторы протеиназ. α2-МГ – полифункциональный белок, компонент врожденного иммунитета: транспортирует и презентирует цитокины, гормоны и другие биологически активные вещества, принимает участие в регуляции гомеостаза. Кроме того, видоизмененный в результате окисления при воспалительных реакциях белок меняется структурно, становится частично чужеродным и приобретает массу других свойств [18]. ЛФ является не только транспортером железа с выраженной противовирусной и противомикробной активностью, но и медиатором взаимодействий врожденного и адаптивного иммунного ответов [19, 20].
Цель исследования – оценка содержания острофазовых белков: α2-МГ, α1-АТ, ЛФ, альбумина (АЛБ); цитокинов: ФНО-α, ИЛ-6 и 8; интерферона (ИФН)-γ в сыворотке крови и фолликулярной жидкости инфертильных пациенток с НГЭ 1–2 степени как возможных маркеров заболевания и их значимости в прогнозе результативности программ ЭКО.
Материалы и методы
В исследование включены 32 инфертильные пациентки с верифицированным диагнозом НГЭ 1–2 степени (минимальная и легкая) согласно классификации Американского общества по репродуктивной медицине (r-ASRM) (основная группа) и 37 здоровых женщин с бесплодием мужского генеза (группа контроля), проходившие лечение по восстановлению фертильности методом ЭКО на базе клиники «Медика-2» г. Новокузнецк (Россия). Показанием к проведению программы ЭКО в основной группе было отсутствие эффекта от ранее проводимой терапии бесплодия (лапароскопическая коагуляция очагов эндометриоза с последующим периодом отслеживания наступления беременности в течение 1 года, без проведения дополнительной гормональной терапии). Критериями включения в исследование были: возраст пациенток от 20 до 35 лет; отсутствие противопоказаний для процедуры ЭКО; изолированный фактор бесплодия; наличие бластоцисты высокого качества (не ниже 3–5 АВ согласно шкале Гарднера) на 5-е сутки культивирования. Критериями исключения были: гипоплазия эндометрия менее 7 мм в день эмбриотрансфера; индекс массы тела (ИМТ) пациенток 34,9 и более кг/м2; инфекционные, аутоиммунные заболевания, злокачественные новообразования любой локализации в анамнезе или в настоящее время. Всем пациенткам проводилось комплексное обследование в соответствии с приказом №107н от 30.08.2012г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [21]. Верификация диагноза НГЭ 1–2 степени проводилась на основании данных лапароскопии. Индукцию суперовуляции в обеих группах проводили по стандартному протоколу с использованием антагонистов гонадотропин рилизинг гормона [22]. В качестве триггера финального созревания ооцитов применяли хорионический гонадотропин человека в дозе 6.500 ед. Оплодотворение ооцитов производили методом ЭКО в основной группе, ИКСИ – в группе контроля. Селективный перенос не более 2 бластоцист высокого класса качества – на 5-е сутки культивирования. От всех принимавших в исследовании женщин было получено добровольное информированное согласие на участие в исследовании. Сбор сывороток венозной крови из локтевой вены осуществляли перед вступлением в программу ЭКО и в день трансвагинальной пункции фолликулов. Получение фолликулярной жидкости (ФЖ) осуществляли во время проведения трансвагинальной пункции преовуляторных фолликулов. В случае попадания проводной крови в ФЖ исследование данного материала не проводилось. Биологический материал замораживали при температуре -20 ºС и хранили для дальнейших иммунологических исследований. Содержание α2-МГ, α1-АТ определяли методом количественного ракетного иммуноэлектрофореза, концентрацию ЛФ и цитокинов (ИЛ-8, ИЛ-6, ФНО-α, ИФН-γ) – методом иммуноферментного анализа с использованием соответствующих коммерческих тест-систем (ЗАО «Вектор-Бест», г. Новосибирск, Россия), уровень АЛБ и ОБ в сыворотке крови и ФЖ изучали биохимическими методами (с бромкрезоловым зеленым и биуретовым методами соответственно).
Статистический анализ полученных результатов проводилси в свободно распространяемой программной среде статистической обработки данных R v.3.4. Распределение большинства показателей было отлично от нормального (проверяли с помощью критерия Шапиро–Уилкса), в связи с этим описательная статистика представлена медианой и интерквартильным размахом – Me(Q1;Q3). Для выявления различий в двух связанных выборках применялся критерий Вилкоксона (W), в двух несвязанных – критерий Манна–Уитни (U). Описательная статистика качественных признаков представлена относительными (%) и абсолютными (число пациентов с признаком/общее число пациентов в группе) показателями, анализ различий проводился с помощью критерия Хи-квадрат. Различия считались статистически значимыми при p≤0,05. Для выявления критического значения показателя применяли однофакторную логистическую регрессию [23].
Результаты
Все пролеченные пациентки были сопоставимы по возрасту, паритету, длительности бесплодия, основным характеристикам индуцированного фолликулогенеза (продолжительности стимуляции, курсовой дозе ФСГ, количеству растущих фолликулов), количеству и качеству полученных ооцитов, проценту оплодотворения и количеству бластоцист. Отличительным признаком в группе инфертильных пациенток с НГЭ 1–2 степени было некоторое повышение уровня эстрадиола сыворотки крови в день введения триггера финального созревания ооцитов, равнозначное в подгруппах как забеременевших, так и незабеременевших в последующем пациенток, однако, данные отличия были недостоверны (табл. 1).

Концентрации малоизученных иммунорегуляторных белков (α2-МГ, α1-АТ и ЛФ), транспортного белка АЛБ и цитокинов (ИЛ-8, ИЛ-6, ФНО-α, ИФН-γ) исследовались в сыворотке крови (до вступления в программу ЭКО и в день трансвагинальной пункции фолликулов) и ФЖ 32 инфертильных пациенток с НГЭ 1–2 степени. Полученные данные сравнивали с аналогичными значениями 37 женщин группы контроля (с мужским фактором бесплодия).
Оценка результативности программ ЭКО проводилась по частоте наступления клинической беременности (ЧНБ) и составила 37,5% (12/32) в группе НГЭ 1-2 степени и 38% (14/37) в группе контроля, что не имело статистически значимых отличий (χ2=0,01, p=0,94).
Для выявления возможного влияния изучаемых показателей, а также их динамики в процессе индукции суперовуляции на ЧНБ у пациенток с НГЭ 1–2 степени проведен анализ полученных значений в зависимости от исхода программы ЭКО (наступление или отсутствие беременности после переноса эмбриона). Изучаемые показатели сравнивали с аналогичными значениями группы контроля. Полученные данные представлены в табл. 2.
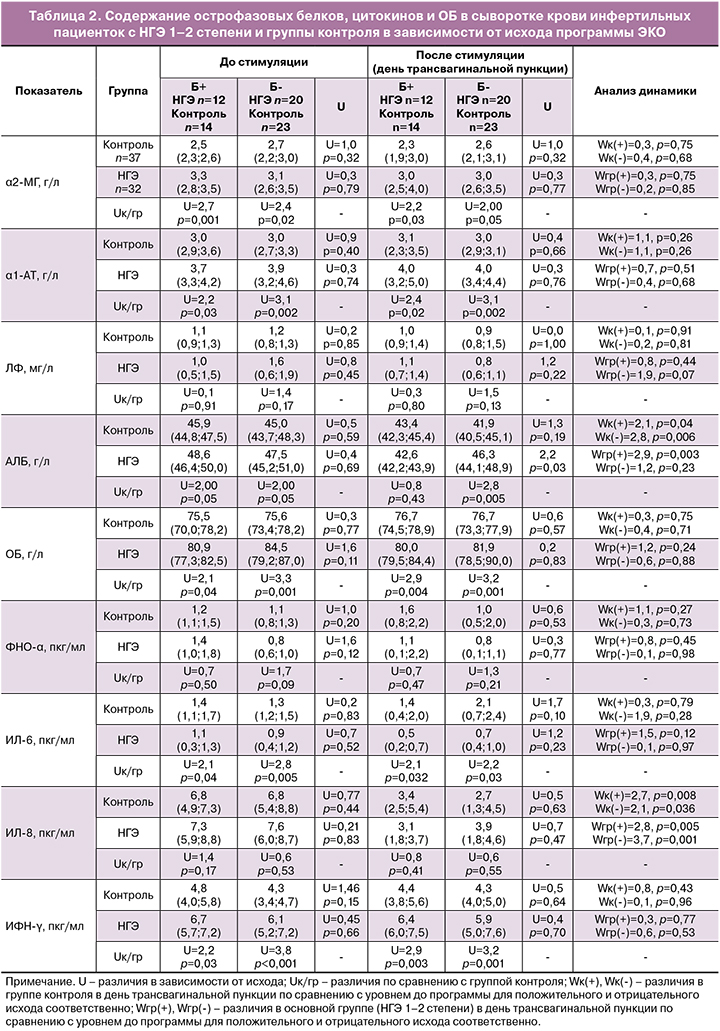
Анализ полученных данных продемонстрировал достоверно повышенные сывороточные значения α2-МГ, α1-АТ, ИФН-γ, ОБ, близко к достоверному повышение уровня АЛБ и сниженный уровень ИЛ-6 у инфертильных пациенток с НГЭ 1–2 степени по сравнению с показателями женщин группы контроля.
После проведенной индукции суперовуляции в группе пациенток с НГЭ 1–2 степени сохранялись повышенные относительно группы контроля значения α2-МГ, α1-АТ, ИФН-γ, ОБ и сниженный уровень ИЛ-6 без влияния на результативность программ ЭКО. Динамика изучаемых показателей выражалась в снижении сывороточных значений ИЛ-8 и была аналогичной группе контроля. Необходимо отметить, что концентрации ИЛ-8, как до, так и после проведения индукции суперовуляции, были сопоставимы с аналогичными показателями пациенток группы контроля и не оказывали влияния на факт наступления беременности. Тогда как динамика сывороточного уровня АЛБ, определяемого в повышенных концентрациях у пациенток с НГЭ 1–2 степени до вступления в программу ЭКО, была ассоциирована с результативностью данных программ. Нами отмечено, что благоприятным фактором в отношении наступления беременности после эмбриотрансфера у инфертильных пациенток с НГЭ 1–2 степени было динамическое снижение концентрации сывороточного АЛБ до значений, сопоставимых с группой контроля. И наоборот, сохранение повышенной концентрации АЛБ сыворотки крови в день трансвагинальной пункции обусловливало отсутствие имплантации перенесенного в полость матки эмбриона.
 Для расчета критических значений уровня АЛБ сыворотки крови у инфертильных пациенток с НГЭ 1–2 степени проведен анализ чувствительности с помощью однофакторной логистической регрессии. Результаты проведенного анализа свидетельствуют о статистически значимой взаимосвязи уровня АЛБ сыворотки крови и исхода программы ЭКО: коэффициент B=0,32, статистика Вальда W=4,3, p=0,04, ОШ и его 95%ДИ ОШ=1,4[1,1–1,9], площадь под ROC-кривой AUC=0,75. Критическое значение АЛБ определялось по уровню чувствительности (вероятность отрицательного исхода 80% и более) и составило 47,5 г/л (рисунок).
Для расчета критических значений уровня АЛБ сыворотки крови у инфертильных пациенток с НГЭ 1–2 степени проведен анализ чувствительности с помощью однофакторной логистической регрессии. Результаты проведенного анализа свидетельствуют о статистически значимой взаимосвязи уровня АЛБ сыворотки крови и исхода программы ЭКО: коэффициент B=0,32, статистика Вальда W=4,3, p=0,04, ОШ и его 95%ДИ ОШ=1,4[1,1–1,9], площадь под ROC-кривой AUC=0,75. Критическое значение АЛБ определялось по уровню чувствительности (вероятность отрицательного исхода 80% и более) и составило 47,5 г/л (рисунок).
Для оценки взаимосвязи изучаемых показателей с результативностью программы ЭКО концентрации острофазовых белков, обладающих иммунорегуляторными свойствами, а также уровни цитокинов и ОБ определяли в составе ФЖ инфертильных пациенток с НГЭ 1–2 степени в день трансвагинальной пункции. Полученные значения сравнивали с аналогичными показателями женщин группы контроля. Результаты проведенного исследования представлены в табл. 3.
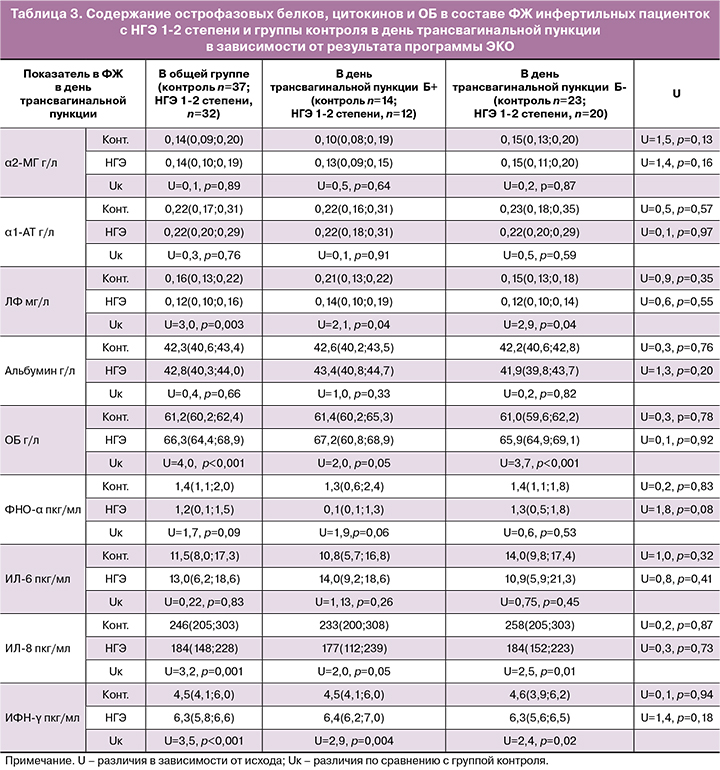
Проведенный нами анализ полученных данных продемонстрировал наличие статистически значимых отличий в составе ФЖ у инфертильных пациенток с НГЭ 1–2 степени и женщин группы контроля в виде сниженных значений ИЛ-8, ЛФ и повышенных концентраций ОБ и ИФН-γ при НГЭ 1–2 степени. Однако статистически значимых отличий в содержании изучаемых иммунологических показателей в ФЖ забеременевших и незабеременевших в программах ЭКО пациенток с НГЭ 1–2 степени не выявлено.
Обсуждение
Таким образом, по результатам проведенного исследования к числу диагностических маркеров, сопровождающих инфертильность женщин с НГЭ 1–2 степени, относятся повышенные сывороточные уровни острофазовых белков, обладающих иммунорегуляторными свойствами (α2-МГ, α1-АТ) и цитокина – ИФН-γ, а также повышенные концентрации острофазового, транспортного белка – АЛБ и ОБ. Снижение на этом фоне в сыворотке крови инфертильных пациенток с НГЭ 1–2 степени концентраций ИЛ-6 (стимулятора синтеза негативных реактантов воспаления: АЛБ и α2-МГ), по всей вероятности, свидетельствует о задержке в кровотоке и дефекте утилизации белков при данной патологии. Одной из причин данного явления могут быть нарушения в механизмах утилизации белков на уровне клеточных рецепторов эндоцитоза (LRP). Косвенным подтверждением этому является значимое повышение в крови ИФН-γ, который реэкспрессирует данные рецепторы. Динамика изученных параметров от вступления в программу ЭКО ко дню трансвагинальной пункции в контрольной группе характеризовалась статистически значимым снижением сывороточных концентраций АЛБ и ИЛ-8. Данные изменения не оказывали влияния на результативность программ ЭКО, что позволяет расценивать данную ситуацию как нормальный иммунный ответ на индукцию суперовуляции в программе ЭКО препаратами ФСГ и введение хорионического гонадотропина в качестве триггера финального созревания ооцитов. Динамическое снижение содержания АЛБ сыворотки крови, являющегося транспортным белком, на наш взгляд, может быть также итогом его повышенного расходования в условиях усиленного стероидогенеза, в процессе проводимой индукции суперовуляции. Результаты нашего исследования продемонстрировали также снижение почти в два раза уровня сывороточного ИЛ-8 у женщин группы контроля в день трансвагинальной пункции фолликулов по сравнению с концентрацией до начала индукции суперовуляции. При этом содержание данного хемокина в ФЖ в несколько десятков раз превышало его сывороточные значения. Это обстоятельство доказывает активное участие ИЛ-8 не только в иммунных процессах, но и в регуляции фолликулогенеза и овуляции. Динамика изученных показателей пациенток с НГЭ 1–2 степени была аналогичной группе контроля относительно содержания ИЛ-8, но имела и свои отличия. Особенностью динамики исследованных показателей у инфертильных пациенток с НГЭ 1–2 степени с неудавшейся имплантацией был сохраняющийся ко дню трансвагинальной пункции повышенный уровень АЛБ сыворотки крови выше 47,5 г/л, в 80% случаев ассоциирующийся с отрицательным исходом программы ЭКО у пациенток данной группы.
Особенностями локального иммунного профиля инфертильных пациенток с НГЭ 1–2 степени было повышение концентрации ИФН-γ (как и в сыворотке крови), а также снижение уровня ЛФ и ИЛ-8 (кофакторы, синтез которых взаимозависим) в составе ФЖ, однако выявленные изменения не оказывали влияния на исход программы ЭКО. Повышенные концентрации ИФН-γ в составе ФЖ, на наш взгляд, дополнительное подтверждение высказанного раннее предположения о наличии системного нарушения в рецептивности клеточного аппарата при данной патологии. Полученные данные частично перекликаются с результатами исследований ряда авторов [24], которые отмечают не только изменение концентрации ИЛ-8 при НГЭ, но и влияние его уровня на исход программы ЭКО. Некоторые исследователи относят НГЭ к аутоиммунным эстрогензависимым процессам [25, 26]; возможно именно поэтому резкая активация стероидогенеза в ходе индукции суперовуляции у части пациенток с НГЭ 1–2 степени ведет к усилению активности патологических очагов, дисфункции регуляторных цитокиновых молекул и ростовых факторов, инициирующих каскад сигнального ответа и опосредующих дистанционное влияние патологического очага на яичники [27], сбою межклеточной двунаправленной коммуникации в граафовом пузырьке.
Заключение
Повышенные концентрации острофазовых белков и цитокинов (α2-МГ, α1-АТ, АЛБ, ИФН-γ), а также ОБ в крови женщин с НГЭ 1–2 степени могут служить дополнительными диагностическими маркерами заболевания. По всей вероятности, накопление данных белков в кровотоке свидетельствует о нарушении их утилизации, как из-за структурно видоизмененных молекул, что наблюдается при воспалительной реакции (особенно α2-МГ), так и в результате нарушения их связывания с рецепторами эндоцитоза (LRP), на что указывает повышенная концентрация ИФН-γ, блокирующая экспрессию рецепторов. Сниженные в ФЖ уровни ИЛ-8 и ЛФ и повышенные концентрации ИФН-γ – дополнительное подтверждение нарушений рецептивности клеточного аппарата при НГЭ 1–2 степени. Усугубляющим фактором является индуцированная гиперэстрогенемия, стимулирующая патологическую активность очагов эндометриоза, оказывающую негативное влияние на процесс имплантации эмбриона в программе ЭКО. Предиктором отрицательного исхода программы ЭКО пациенток с НГЭ 1–2 степени является повышенный уровень сывороточного АЛБ выше 47,5 г/л в день пункции фолликулов, что позволяет рекомендовать определение данного показателя в качестве дополнительного прогностического критерия результативности программы ЭКО у данной категории инфертильных пациенток и расширения показаний к криоконсервации и отсроченному переносу эмбрионов в более благоприятных условиях.



