Распространенность бесплодия среди супружеских пар репродуктивного возраста растет, достигая 15%. С развитием экстракорпорального оплодотворения (ЭКО) многие проблемы, связанные с бесплодием, были успешно преодолены. Неудивительно, что в 2010 г. Нобелевская премия в области физиологии и медицины была присуждена профессору R.G. Edwards за технологию искусственного оплодотворения in vitro, прорыв, который помог миллионам бесплодных пар во всем мире зачать и родить детей [1]. Сегодня, по оценкам экспертов, 2–3% всех родов в развитых странах являются результатом программ ЭКО [2].
Современные подходы к диагностике и лечению бесплодных супружеских пар основаны на достижениях фундаментальных наук в области изучения молекулярно-генетических механизмов, лежащих в основе реализации процесса репродукции у человека. Расшифровка генетических механизмов регуляции репродуктивной системы способствует созданию персонализированного подхода к лечению бесплодия в репродуктивной медицине.
Были предложены различные предикторы исходов стимуляции функции яичников, такие как возраст, овариальный резерв (объем яичников и число антральных фолликулов), гормональный статус, курение и др. [3–5].
Кроме того, генетическая изменчивость также представляется важным фактором, детерминирующим овариальный ответ на стимуляцию суперовуляции в программе ЭКО [6]. Клинико-ассоциативные исследования по изучению генных объединений выявили ряд полиморфизмов генов (single nucleotide polymorphisms, SNP), участвующих в овариальном ответе, затрагивающих гонадотропин, стероидные гормоны и др. Большинство из них оказывает эффект на уровне мРНК или последовательности связывания белков. Этим можно объяснить встречающуюся индивидуальную вариабельность в ответе яичников на стимуляцию их функции [7].
Влияние полиморфизмов генов на исходы стимуляции суперовуляции в программе ЭКО анализировалось не одной группой исследователей, но фармакогенетический подход к дозированию экзогенного ФСГ по-прежнему до конца не разработан [6].
Современное представление о взаимодействие генов, вовлеченных в регуляцию овариального ответа, представлено на рисунке.
Полиморфизм гена рецептора ФСГ (FSHR)
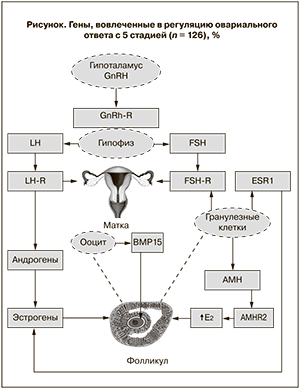 К настоящему времени ген рецептора ФСГ является первым и наиболее изученным генетическим фактором, имеющим значение при стимуляции суперовуляции. Хорошо известно, что физиологическое действие ФСГ зависит от активации его рецептора (FSHR), который экспрессируется гранулезными клетками. Поскольку успех стимуляции функции яичников в значительной степени зависит от эффективности вводимой пациентке дозы ФСГ, то основным геном, который может «объяснить» различные исходы стимуляции суперовуляции, является ген рецептора ФСГ [6].
К настоящему времени ген рецептора ФСГ является первым и наиболее изученным генетическим фактором, имеющим значение при стимуляции суперовуляции. Хорошо известно, что физиологическое действие ФСГ зависит от активации его рецептора (FSHR), который экспрессируется гранулезными клетками. Поскольку успех стимуляции функции яичников в значительной степени зависит от эффективности вводимой пациентке дозы ФСГ, то основным геном, который может «объяснить» различные исходы стимуляции суперовуляции, является ген рецептора ФСГ [6].
Ген FSHR локализуется на участке хромосомы 2p21 и состоит из 10 экзонов. В нем идентифицировано более 148800 SNPs, из которых наиболее изучены rs6165 и rs6166. Оба полиморфизма локализованы в экзоне 10, rs6165 приводит к аминокислотной замене Thr307Ala во внеклеточном домене белка (гормон-связывающей области), а rs6166 – к аминокислотной замене Asn680Ser во внутриклеточном домене [6]. Имеется большое количество данных, подтверждающих, что генетическая изменчивость рецептора ФСГ влияет на результаты стимуляции суперовуляции [8–10].
Аллель 680Ser FSHR ассоциирован с повышенным базальным уровнем ФСГ (ключевого маркера овариального резерва и наиболее изученного возможного предиктора овариального ответа на стимуляцию суперовуляции) и необходимостью введения высоких доз гонадотропинов при стимуляции функции яичников [7, 10].
При этом в исследовании, проведенном Boudjenah и соавт. (2012), показано, что женщины, гомозиготные по аллелю 680Ser, имели большее число зрелых ооцитов, чем гомозиготные по аллелю 680Asn (9,8±4,6 против 7,2±4,0 ооцитов, р=0,0009) [7].
Недавно проведенный метаанализ 4 основных европейских исследований, в которых пациенты были разделены на группы с «бедным» и нормальным овариальным ответом, подтвердил роль 680Ser в развитии «бедного» овариального ответа в программах IVF. Женщины с аллелем 680Ser составляют до 75% пациенток в программах IVF [11].
В другом опубликованном метаанализе исходов программы IVF у пациенток с различными генотипами Asn680Ser внимание было сфокусировано на оценке уровня базального ФСГ, дозах вводимого рекомбинатного ФСГ, количестве полученных ооцитов и проценте наступления беременности. В этом метаанализе сделан вывод о том, что для носителей генотипа 680Ser/Ser характерны повышение уровня базального ФСГ и необходимость введения более высоких доз экзогенного ФСГ в процессе стимуляции суперовуляции в сравнении с носителями аллеля 680Asn. Однако не было найдено существенных различий в количестве полученных ооцитов и проценте наступления беременности у пациенток в зависимости от генотипа [12].
Аллель 160Thr полиморфизма Ile160Thr часто выявляется у пациенток с гиперответом [13]. Однако данные других исследователей не подтверждают эти результаты [14].
Недавние исследования предоставляют новые молекулярные взгляды на роль FSHR в исходах стимуляции функции яичников. Показано, что изменение уровня mRNA FSHR, приводящее к изменению экспрессии рецептора на гранулезных клетках, приводит к разному овариальному ответу: низкая экспрессия характерна для «бедного» ответа, а высокая экспрессия дает хороший овариальный ответ на стимуляцию суперовуляции гонадотропинами [6].
Однако эти результаты были получены на небольшой выборке пациенток и требуют дальнейших исследований.
Полиморфизм гена β-субъединицы лютеинизирующего гормона (LHB)
Лютеинизирующий гормон (ЛГ) – гетеродимерный гликопротеин, состоящий из α и β-субъединиц. Гормоны ФСГ и ЛГ содержат общую α-субъединицу, в то время как β-субъединица является гормон-специфичной и содержит рецептор-связывающий домен. ЛГ синергично с ФСГ стимулирует рост и созревание фолликулов, стероидогенез, процессы овуляции и лютеинизации.
Ген LHB локализуется на участке хромосомы 11p13 и содержит 3 экзона. В гене описано 179 SNPs [6]. Были обнаружены 3 функционально значимых полиморфизма в кодирующей области гена, приводящие к снижению активности ЛГ. Замены Trp8Arg и Ile15Thr связаны с незначительным снижением фертильности [15], бесплодием, ассоциированным с нарушением менструального цикла, и привычным невынашиванием. Полиморфизм Gly102Ser ассоциирован с бесплодием и нарушением менструального цикла [6].
Среди пациенток, обратившихся для проведения программы ЭКО, гаплотип 8Arg-15Thr чаще встречался в группе со сниженным овариальным ответом на стимуляцию суперовуляции препаратами рекомбинантного ФСГ [16], или вовсе резистентных даже к высоким дозам препаратов, соответственно у таких пациенток получали малое количество ооцитов [17].
Авторы сделали вывод, что таким пациенткам целесообразно проводить стимуляцию суперовуляции комбинированными ЛГ-содержащими препаратами, такой подход улучшает исход программ ВРТ и снижает потребность в высоких дозах рекомбинантного ФСГ [18]. Однако требуется проведение дальнейших исследований в этой области.
Полиморфизм гена рецептора лютеинизирующего гормона/гонадотропина (LHCGR)
ЛГ оказывает свое влияние путем связывания с рецептором на поверхности клеток; ЛГ и хорионический гонадотропин связываются с одним и тем же рецептором, имеющим решающее значение для поддержания теки, созревания фолликулов и овуляции.
Ген LHCGR расположен на участке хромосомы 2p21, состоит из 11 экзонов и содержит более 520 SNPs. [6] Полиморфизмы rs4539842 (18insLeuGln), rs12470652 (Asn291Ser) и rs2293275 (Ser312Asn) гена LHCGR ассоциируются с повышением активности рецептора [19].
Проведены исследования, в которых полиморфизм 18insLeuGln ассоциирован с развитием синдрома гиперстимуляции яичников [20].
В исследовании O’Brien и соавт. (2013) изучался полиморфизм LHCGR (rs4073366 G>C). Результатом данной работы стал вывод о наличии повышенного риска развития синдрома гиперстмуляции яичников у носителей этого полиморфизма (р=0,033) [21], что требует проведения более детальных исследований.
Полиморфизм генов эстрогеновых рецепторов α и β (ESR1и ESR2)
Хорошо изучено влияние эстрогенов на рост фолликулов и созревание ооцитов. Эстрогеновые сигналы воспринимаются эстрогеновыми рецепторами. Определены 2 типа эстрогеновых рецепторов, они кодируются двумя генами – ESR1 (6q25) и ESR2 (14q22) соответственно [6].
Показано, что изменчивость генов эстрогеновых рецепторов влияет на исходы стимуляции функции яичников [5, 8]. Первое исследование процессов стимуляции суперовуляции с фармакогенетической позиции было проведено в 1997 г., в нем изучался полиморфизм гена ESR1 [6].
Ген ESR1 высоко изменчив (полиморфен), в нем описано около 2200 SNPs, в то время как в гене ESR2 определено около 720 SNPs.
Наиболее изученными полиморфизмами гена ESR1 являются rs2234693 (-397 С>Т, определяемый при расщеплении участка рестриктазой Pvull) и rs9340799 (-351 А>G, определяемый рестриктазой Xbal), локализованные в некодирующей области гена (интроне I) и полиморфизм (ТА)n динуклеотидных повторов в промоторной зоне [6].
В исследованиях, проведенных Georgiou и соавт., Sundarrajan и соавт., выявили, что генотип Pvull T/T ассоциирован со сниженным шансом наступления беременности у женщин в программах ВРТ [6]. Ряд других авторов в своих исследованиях такой связи не обнаружили [22, 23], однако сделали вывод, что полиморфизм ESR1 Pvull влияет на течение уже наступившей беременности, а не на результативность переноса эмбриона в полость матки [6].
Пациенты с генотипом Pvull С/С в программе ЭКО демонстрируют большое количество фолликулов, качественные зрелые ооциты и эмбрионы [22, 23].
Ayvaz и соавт. (2009) в своем исследовании продемонстрировали связь другого распространенного SNP в гене ESR1, Xbal А>G с исходами стимуляции функции яичников; стадия зрелости ооцитов и наступление беременности были выше у пациенток с генотипом G/G [23]. Кроме того, у пациенток с генотипом G/G отмечается более высокий уровень эстрадиола в процессе стимуляции суперовуляции [6].
Суммируя вышеизложенное, нельзя опровергнуть мнение, что эстрогеновые рецепторы определенным образом влияют на результаты стимуляции функции яичников. Тем не менее, необходимы дальнейшие разработки в этой области с целью подтверждения или опровержения представленных результатов.
Полиморфизм гена антимюллерова гормона (АМГ)
Предположительно, ряд генов, принадлежащих к «суперсемейству» трансформирующего фактора роста β, играют важную роль в исходах стимуляции суперовуляции [6].
АМГ является одним из наиболее изучаемых в настоящее время пептидов данной группы. АМГ экспрессируется в гранулезных клетках первичных и антральных фолликулов [6]. АМГ оказывает свое влияние посредством рецепторов АМГ II типа (AMHR2). Такие рецепторы присутствуют на гранулезных клетках и клетках теки [24].
Концентрация АМГ в сыворотке крови все чаще используется как предиктор овариального резерва и овариального ответа на стимуляцию суперовуляции. Так, низкий уровень АМГ в сыворотке крови, определяемый перед началом программы ЭКО, считается предиктором «бедного» овариального ответа, и наоборот [25].
Ген, кодирующий АМГ, локализуется на участке хромосомы 19p13.3, а его рецептор (AMHR2) расположен на длинном плече 12-й хромосомы 12q13 [6].
Генетическая изменчивость функционирования АМГ представляет интерес и была описана Kevenaar и соавт. (2007). В это исследование были включены нормогонадотропные женщины и была продемонстрирована связь полиморфизма генов AMH и AMHR2 с повышенным уровнем эстрадиола в течение всего менструального цикла. Это может быть косвенным показателем повышенной чувствительности к ФСГ. Kevenaar и другие исследователи нашли SNP, присутствующие в генотипе примерно 19% женщин. При такой высокой распространенности данные полиморфизмы целесообразно определять до начала стимуляции суперовуляции в качестве предикторов овариального ответа [26].
По данным ряда авторов, концентрация АМГ отрицательно коррелирует с концентрацией эстрадиола в антральных фолликулах, это является доказательством того, что АМГ может быть со-регулятором стероидогенеза в клетках гранулезы [6].
Вместе с тем, в исследовании, проведенном Hanevik и соавт. (2010), изучались 6 SNP AMH (rs10407022 и rs4807216) и AMHR2 (rs2002555, rs2071558, rs3741664 и rs11170555), и не было отмечено достоверно значимого влияния ни одного из них на исход стимуляции суперовуляции [24].
Полиморфизм гена BMP15
Белок BMP15, как и АМГ, относится к протеинам группы трансформирующего фактора роста β. Он экспрессируется в фолликулах на ранней стадии развития, детерминирует рост, развитие фолликулов и процесс овуляции [6].
Persani и соавт. (2009) отмечают, что ген BMP15 является первым геном, расположенным на Х-хромосоме (Хр11.2), детерминирующим функцию яичников [27].
Kovanci и соавт. (2007) сообщили о роли этого белка в развитии преждевременной недостаточности яичников [28].
Что касается непосредственного влияния полиморфизмов гена BMP15 на исходы стимуляции суперовуляции, то полиморфизмы -673C>T, -9C>G, IVSI±905A>G ассоциированы с хорошим овариальным ответом, ростом большого числа фолликулов. При этом связи с развитием клинически значимого синдрома гиперстимуляции яичников при наличии в генотипе этих полиморфизмов отмечено не было [6].
В другом недавно опубликованном исследовании (Hanevik и соавт., 2011) также была определена связь аллеля -9G с высоким овариальным ответом на стимуляцию суперовуляции [29].
Генетическая вариабельность в популяции субфертильных пациенток исключает возможность единого подхода в программах стимуляции суперовуляции. Такая вариабельность может быть обусловлена единичными однонуклеотидными полиморфизмами. Взаимодополняющая стратегия включает в себя изучение генетических закономерностей, оказывающих определенное влияние на репродуктивную систему, в частности, на ответ яичников на стимуляцию [7].
Однако, несмотря на многочисленные проведенные исследования в этой области, точное прогнозирование реакции яичников на введение экзогенных гонадотропинов в настоящее время не представляется возможным, поиск оптимальных биомаркеров продолжается. В то же время очевидно, что нет оснований ожидать появления одного маркера. Стратегия научного поиска должна быть направлена в сторону изучения ген-генных и ген-средовых взаимодействий. Перспективно использование биоинформационных подходов и математического моделирования для создания комплексных многофакторных прогностических алгоритмов [30].
Исследования, проводимые до настоящего времени, не масштабные, а результаты остаются противоречивыми. Необходимо проведение рандомизированного исследования для решения этой проблемы.
Таким образом, проблема поиска наиболее оптимального предиктора овариального ответа в программах ВРТ остается актуальной, нет единого мнения о наиболее оптимальной персонализированной тактике стимуляции суперовуляции при проведении повторных циклов ЭКО, что требует дальнейшего изучения. Тем не менее, накопленные знания о полиморфизме ключевых генов, регулирующих овариальный ответ, могут быть использованы для разработки математической модели прогнозирования овариального ответа.



