Препараты фолликулостимулирующего гормона (ФСГ) используются для лечения бесплодия с 1975 г., когда впервые появились сообщения об индуцированной овуляции у женщины с использованием гормонов гипофиза. В настоящее время клиническое применение препаратов рекомбинантного ФСГ (рФСГ) при лечении бесплодия привело к неуклонному росту количества рожденных детей [1].
Овариальный ответ на стимуляцию гонадотропинами обладает индивидуальной вариабельностью [2]. В начале 1980-х гг. были определены 3 типа овариального ответа на стимуляцию функции яичников: «бедный» (или низкий), нормальный (или «хороший») и высокий (или «гипер») ответ [3]. Однако даже спустя 30 лет нет единого определения групп овариального ответа, хотя термины широко используются как в научных исследованиях, так и в повседневной клинической практике [3].
В 2011 г. на встрече Европейского общества репродуктологов и эмбриологов (European Society of Human Reproduction and Embryology, ESHRE) была определена концепция, согласно которой «бедный» овариальный ответ предполагает созревание менее трех фолликулов при стимуляции суперовуляции большими дозами гонадотропинов [4].
Частота «бедного» овариального ответа варьирует от 9 до 24% среди пациенток, находящихся на лечении в программах ВРТ [5, 6].
Согласно Educational Bulletin American Society of Reproductive Medicine (ASRM, 2008), «гипер» ответ на стимуляцию функции яичников предполагает созревание более 10 фолликулов [7, 8]. Частота этого типа овариального ответа существенно варьирует в популяции пациенток с бесплодием от 0,1 до 33% [9, 10].
Соответственно нормальный ответ яичников на стимуляцию подразумевает рост в среднем от 4 до 10 фолликулов.
Согласно проведенным исследованиям, изменения в рецепторе ФСГ могут объяснить индивидуальную вариабельность овариального ответа на стимуляцию функции яичников.
 К настоящему времени, ген рецептора ФСГ (FSHR) является первым и наиболее изученным генетическим фактором, имеющим значение при стимуляции «суперовуляции» [11]. ФСГ оказывает свое действие путем связывания со специфическим рецептором, расположенным в плазматической мембране гранулезных клеток яичников [12]. Многие исследования сосредоточены на изучении роли рецептора ФСГ как одного из важнейших факторов, связанных с овариальным ответом.
К настоящему времени, ген рецептора ФСГ (FSHR) является первым и наиболее изученным генетическим фактором, имеющим значение при стимуляции «суперовуляции» [11]. ФСГ оказывает свое действие путем связывания со специфическим рецептором, расположенным в плазматической мембране гранулезных клеток яичников [12]. Многие исследования сосредоточены на изучении роли рецептора ФСГ как одного из важнейших факторов, связанных с овариальным ответом.
Большой интерес представляет изучение полиморфизма гена FSHR при бесплодии [1]. Наиболее широко изучаемыми являются полиморфизмы FSHR-29G>A, Thr307Ala [rs 6165] и Asn680Ser [rs 6166] [12]. Thr307Ala и Asn680Ser локализованы в экзоне 10 и приводят к заменам аминокислот в позициях 307 аланин (Ala) на треонин (Thr) и 680 аспарагин (Asn) на серин (Ser). Эти 2 полиморфизма, находясь в непосредственной близости на хромосоме (позиции в гене 919 и 2039 соответственно, рис. 1), наследуются вместе, образуя устойчивые блоки сцепления [1]. Большинство исследований сфокусированы почти исключительно на полиморфизме в кодоне 680 [2].
Показано снижение активности рецепторов при носительстве аллеля 680Ser. При носительстве данного полиморфизма в гомозиготном состоянии (680Ser/Ser) рецепторы ФСГ оказываются более устойчивыми к действию ФСГ даже при нормальном менструальном цикле [13]. Так как изоформы FSHR отличаются чувствительностью к ФСГ во время стимуляции яичников в программах ВРТ, они оказывают существенное влияние на тип овариального ответа, что необходимо учитывать при выборе дозы препарата ФСГ [14]. Начиная с 2000 г. в ряде исследований четко прослеживается ассоциация полиморфизма FSHR с типом овариального ответа в программе ЭКО [2, 15].
Целью настоящего исследования стал анализ особенностей фолликулогенеза, оогенеза, эмбриогенеза и исходов программ ВРТ у пациенток в зависимости от полиморфизма гена FSHR в российской популяции пациенток с бесплодием.
Материал и методы исследования
Были обследованы 135 пациенток, обратившиеся для лечения бесплодия в отделение вспомогательных технологий ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России, строго соответствовавших критериям включения (возраст пациенток от 18 до 36 лет, женское бесплодие трубного происхождения, мужской фактор бесплодия без выраженной патозооспермии, наличие регулярного менструального цикла, подписанное пациенткой информированное согласие на участие в исследовании). Из исследования были исключены пациентки с противопоказаниями для проведения ЭКО, в том числе с экстрагенитальной патологией, онкологическими заболеваниями, перенесенными оперативными вмешательствами на яичниках, эндокринным фактором бесплодия, эндометриозом, патологией эндометрия, генетическими аномалиями, пороками развития половых органов и др.
Пациентки были разделены на 3 группы. Группа № 1 сформирована из 31 пациентки с «бедным» ответом яичников на стимуляцию (согласно Bologna criteria, ESHRE 2011) [4]. Группу № 2 составили 35 пациенток с «гипер» ответом яичников на стимуляцию (согласно Educational Bulletin ASRM, 2008) [7, 8]. Группу сравнения составили 69 пациенток с нормальным овариальным ответом на стимуляцию.
Стимуляция функции яичников проводилась в соответствии со стандартными протоколами с препаратами рФСГ и антГнРг со 2–3-го дня менструального цикла. Оценка эмбрионов проводилась согласно классификации, разработанной D. Gardner [16].
Полиморфизм гена FSHR: 2039 G>A (Ser680Asn) [rs6166] определялся методом ПЦР с анализом кривых плавления модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), в лаборатории молекулярно-генетических методов ФГБУ НЦАГиП им. В.И. Кулакова с помощью коммерческих тест-систем ООО «НПО ДНК-Технология», Россия. Определяли наличие гуанидина (G) или аденина (A) в 2039 позиции гена, что соответствует наличию аспарагина (Asn) или серина (Ser) в 680 позиции белка. ДНК для генотипирования выделяли из образцов периферической крови взятой с ЭДТА в качестве антикоагулянта с помощью комплекта реагентов «Проба-ГС-генетика» ООО «НПО ДНК-Технология», Россия. Определение температуры плавления олигонуклеотидных проб проводили с помощью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова.
Статистическая обработка данных выполнена на компьютере с помощью электронных таблиц Microsoft Excel и пакета прикладных программ SPSS Statistics 17.0. В качестве меры центральной тенденции количественных признаков была выбрана медиана (Me), а в качестве интервальной оценки – верхний (H) и нижний квартили (L). Результаты представлены в виде Me (L-H). Для оценки значимости межгрупповых различий применялся U-критерий Манна–Уитни для несвязанных совокупностей. Достоверность различий в частоте встречаемости качественных признаков определяли по критерию χ2. Статистически значимыми считались различия при р<0,05. Отношение шансов (OR) приведено с 95% доверительным интервалом.
Результаты исследования
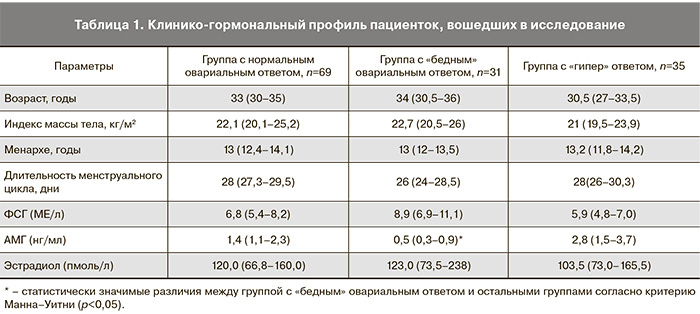
Все пациентки, включенные в исследование, были репродуктивного возраста, статистически значимых различий по показателям возраста, росто-весовых параметров, менструального цикла женщин в исследуемых группах выявлено не было. Характеристики менструальной функции женщин были сопоставимы в исследуемых группах, на момент обследования все они имели регулярный менструальный цикл. Статистически значимых различий в уровнях ФСГ и эстрадиола в крови между тремя группами пациенток выявлено не было, уровень АМГ в крови был ниже у пациенток в группе с «бедным» овариальным ответом (р<0,05) (табл. 1).
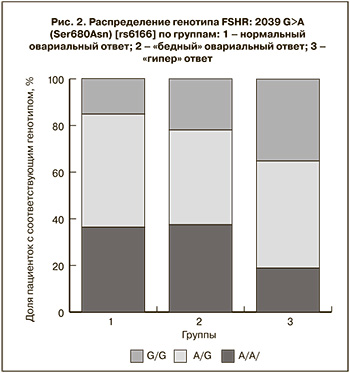
При анализе распределения частоты генотипов по группам получены следующие результаты: в группе с нормальным овариальным ответом частота генотипа A/A составила 24 (36,4%), в группе с «бедным» овариальным ответом – 12 (37,5%), в группе с «гипер» ответом – 7 (18,9%). Частота генотипа A/G в группе с нормальным овариальным ответом составила 32 (48,5%), в группе с «бедным» овариальным ответом – 13 (40,6%), в группе с «гипер» ответом – 17 (45,9%). Частота генотипа G/G в группе с нормальным овариальным ответом составила 10 (15,2%), в группе с «бедным» овариальным ответом – 7 (21,9%), в группе с «гипер» ответом – 13 (35,1%) (рис. 2).
Таким образом, выявлена статистически значимая ассоциация полиморфизма гена FSHR (Asn680Ser) с типом овариального ответа. Аллель G статистически значимо чаще встречался у пациенток с «гипер» ответом (p=0,019). Согласно аутосомно-рецессивной модели наличие генотипа G/G предрасполагает к «гипер» ответу (OR=2,38 (1,0–5,64), р=0,046).
При анализе ассоциации полиморфизма FSHR Asn680Ser с количеством ооцитов статистически значимых различий получено не было. Однако в группе с «бедным» овариальным ответом наблюдалась тенденция к снижению числа аспирируемых ооцитов при носительстве генотипа G/G (1 (0–2) против 2 (1–2)), хотя различия не достигали статистической значимости вследствие малого количества пациенток с генотипом G/G в данной группе.
Кроме того, был проведен анализ качества эмбрионов в зависимости от исследуемых генотипов. Выявлена предрасположенность к увеличению количества эмбрионов плохого качества (класса С и/или D) у пациенток – носительниц аллеля G (р=0,035). Данная предрасположенность наблюдалась при всех типах овариального ответа. В группе пациенток со сниженным овариальным ответом (n=31) у 3 носительниц аллеля G (15,8%) получены эмбрионы плохого качества, в то время как у всех 12 пациенток с генотипом А/А эмбрионы принадлежали к классам А и/или В. В группе пациенток с нормальным овариальным ответом (n=69) среди носительниц аллеля G у 20 (44,4%) эмбрионы были плохого качества, в то время, как при генотипе А/А лишь у 7 пациенток (29,2%) эмбрионы принадлежали к классам С и/или D. В группе пациенток с «гипер» ответом яичников на стимуляцию прослеживалась аналогичная тенденция. При наличии аллеля G эмбрионы плохого качества обнаруживались у 13 пациенток (46,4%), а среди носительниц генотипа A/A только у 2 (28,6%).
Таким образом, вероятность получения эмбрионов плохого качества была статистически значимо выше при наличии в генотипе пациентки аллеля G (39,1 против 20,9%). Согласно аутосомно-доминантной модели OR составило 2,43 (1,05–5,61) для генотипов G/G и G/A против генотипа A/A (р=0,037).
При проведении анализа влияния полиморфизма Asn680Ser на частоту наступления беременности статистически значимой ассоциации выявлено не было.
Обсуждение
 Полученные результаты могут свидетельствовать о наличии молекулярных механизмов, регулируемых рецепторами ФСГ и влияющих на степень созревания ооцитов. Нарушение этого процесса может приводить к развитию эмбрионов плохого качества в программах ВРТ. Однако такие пациентки склонны к более активному овариальному ответу на стимуляцию препаратами ФСГ, вследствие чего есть возможность получения большего количества ооцитов и эмбрионов, пригодных для переноса. Можно предположить, что данные механизмы могут действовать и в естественном цикле, приводя к снижению фертильности у носительниц определенного генотипа FSHR, но при этом к более эффективному ответу на препараты ФСГ, что в некоторой степени может компенсировать снижение фертильности и способствовать закреплению данного генетического варианта FSHR в популяции.
Полученные результаты могут свидетельствовать о наличии молекулярных механизмов, регулируемых рецепторами ФСГ и влияющих на степень созревания ооцитов. Нарушение этого процесса может приводить к развитию эмбрионов плохого качества в программах ВРТ. Однако такие пациентки склонны к более активному овариальному ответу на стимуляцию препаратами ФСГ, вследствие чего есть возможность получения большего количества ооцитов и эмбрионов, пригодных для переноса. Можно предположить, что данные механизмы могут действовать и в естественном цикле, приводя к снижению фертильности у носительниц определенного генотипа FSHR, но при этом к более эффективному ответу на препараты ФСГ, что в некоторой степени может компенсировать снижение фертильности и способствовать закреплению данного генетического варианта FSHR в популяции.
Одной из важнейших задач врача является наиболее точное прогнозирование возможных исходов стимуляции суперовуляции до вступления пациентки в программу ЭКО.
Проводимые исследования полиморфизма гена FSHR демонстрируют обнадеживающие результаты, которые могут быть применены в клинической практике, в частности для персонализации подбора протоколов стимуляции суперовуляции.
Генотипирование рецептора ФСГ может дополнить арсенал уже использующихся «инструментов», позволяющих прогнозировать результаты стимуляции функции яичников и исходы программы ВРТ.
Подтверждением данного вывода служат и недавно проведенные мета-анализы Moron и Ruiz (2010), Altmae и соавт. (2011) и La-Marca и соавт. (2013), в которых также предполагается, что полиморфизм гена рецептора ФСГ можно расценивать как потенциальный предиктор овариального ответа [11, 17, 18].
Разработка критериев прогнозирования овариального ответа в программах ВРТ путем оценки индивидуальных генетических маркеров является перспективным в современной репродуктологии. В связи с этим последнее время особое внимание уделяется новому для отечественной практики понятию «персонифицированная медицина» [19]. Под этим термином подразумеваются инновационные методы профилактики, диагностики и лечения, основанные на знаниях индивидуальных особенностей пациентов, в частности особенностей генотипа.
Заключение
Исследование рецептора ФСГ может служить малоинвазивным, недорогим тестом, применяемым перед началом стимуляции функции яичников. В результате это поможет персонализировано подобрать протокол стимуляции яичников и скорректировать дозу вводимого препарата ФСГ.
Таким образом, полиморфизм гена FSHR является перспективным маркером, определение которого до начала лечения может позволить повысить качество терапевтического воздействия в программах ВРТ и избежать возможных осложнений.



