Репродуктивным (фертильным) возрастом женщины называется период, в течение которого она способна к вынашиванию и рождению ребенка (от 15 до 49 лет), в котором отдельно выделяется поздний репродуктивный возраст (ПРВ) (после 35–37 лет). В настоящее время проблема бесплодия у женщин ПРВ является крайне актуальной во всем мире: средний возраст первородящих женщин неуклонно увеличивается, кроме того, возрастает потребность в применении вспомогательных репродуктивных технологий (ВРТ).
Пациентки ПРВ имеют ряд особенностей, усложняющих реализацию репродуктивной функции, по сравнению с пациентками раннего репродуктивного возраста. Во-первых, у женщин старше 35 лет происходит постепенное снижение овариального резерва [1].
После 40 лет скорость атрезии фолликулов увеличивается вдвое [1]. Во-вторых, эта группа женщин, как правило, имеет отягощенный гинекологический анамнез (наружный генитальный эндометриоз, миому матки, гиперплазию эндометрия, оперативные вмешательства на органах малого таза и др.). В-третьих, даже при сохранном овариальном резерве у пациенток старше 35 лет увеличивается риск анеуплоидии ооцитов и, как следствие, эмбрионов, что также снижает вероятность наступления беременности [2, 3].
Одним из наиболее современных методов лечения бесплодия является экстракорпоральное оплодотворение (ЭКО). Однако в группе пациенток ПРВ эффективность ВРТ не превышает 10%, а вероятность наступления беременности снижается на 4,7% из расчета на каждый год жизни женщины старше 30 лет [4].
Преимплантационный генетический скрининг (ПГС) является методом, предотвращающим перенос эмбрионов с аномальным числом хромосом (анеуплодии и числовое нарушение кариотипа). Благодаря этому методу диагностики возможно производить отбор эуплоидных эмбрионов, что, в свою очередь, приведет к увеличению частоты наступления беременности, уменьшению репродуктивных потерь и снижению риска рождения детей с генетическими нарушениями. Несмотря на предполагаемые преимущества от использования ПГС в группе пациенток ПРВ, на сегодняшний день данные об эффективности ПГС у данной категории пациенток противоречивы [5, 6]. Кроме того, высокая стоимость данного метода ограничивает его применение в рутинной клинической практике.
Цель исследования – оценить клиническую и клинико-экономическую эффективность ПГС у пациенток ПРВ.
Материал и методы исследования
В проспективное когортное исследование были включено 85 супружеских пар с бесплодием, обратившихся для лечения бесплодия методами ЭКО в период 2015–2017 гг., с отсутствием противопоказаний к проведению ЭКО и подписанным информированным согласием на участие в исследовании. Критериями включения стали нормальный кариотип обоих супругов и возраст пациентки 40 лет и старше (собственные данные, пороговый возраст анеуплоидии эмбрионов в программе ВРТ). Критериями исключения стало использование донорских гамет или суррогатного материнства, а также развитие осложнений ЭКО в изучаемом цикле.
Пациенты были стратифицированы на две группы: группу 1 составили 32 пациентки, которым была проведена программа ЭКО с ПГС. Группа 1 была стратифицирована на 2 подгруппы в зависимости от вида ПГС: группа 1а – пациентки, которым проводили ПГС методом флуоресцентной гибридизации in situ (FISH)/полногеномной гибридизации (CGH) на 3-и сутки (n=21), группа 1б – пациентки, которым проводили ПГС методом CGH на 5-е сутки (n=11). Группу 2 составили 53 пациентки, которым была проведена программа ЭКО без использования ПГС.
Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий (ВРТ), противопоказаниях и показаниях к их применению» [7].
Стимуляция функции яичников проводилась с применением рекомбинантного фолликулостимулирующего гормона (рФСГ) или комбинированного препарата рФСГ и лютеинизирующего гормона, и назначением антагонистов гонадотропин-рилизинг-гормона. Триггер овуляции вводился при наличии лидирующих фолликулов диаметром 17 мм и более. В качестве триггера использовали препарат агониста гонадотропин-рилизинг гормона в дозе 0,2 мг. Трансвагинальная пункция яичников осуществлялась через 36 часов после введения триггера овуляции. Оплодотворение ооцитов у всех пациенток осуществлялось методом интрацитоплазматической инъекции сперматозоида в ооцит (ИКСИ).
Морфологическую оценку эмбрионов проводили на 3-и и 5-е сутки после трансвагинальной пункции согласно классификации Gardner и соавт. [8]. Биопсию бластомеров в группе 1а проводили на третий день культивирования эмбрионов in vitro (через 72 часа после аспирации фолликулов), если в эмбрионе визуализировалось как минимум шесть бластомеров. Биопсии подвергали один бластомер. Биопсию осуществляли с помощью микроманипулятора Narishiga (Япония), а для рассечения блестящей оболочки использовали лазерную пушку Fertilase (Германия). Для аспирации бластомера использовали микропипетку Cook (Австралия). Пациенткам в группе 1б биопсию клеток трофоэктодермы бластоцисты проводили на 5–6-й день культивирования эмбрионов in vitro. Хетчинг эмбриона, предшествующий биопсии, проводили на 4–5-й день культивирования эмбрионов с использованием лазерной пушки. Забор клеток с использованием микроманипулятора и подготовку клеток для CGH проводили согласно принятым в рутинной практике методикам [9].
Подготовку ядра для гибридизации in situ проводили согласно протоколу, рекомендуемому фирмой-производителем. Анализ препаратов после процедуры FISH проводили с помощью флуоресцентного микроскопа Axioplan 2 фирмы Zeiss при увеличении 100Х10, оборудованным соответствующим набором фильтров (Orange, Green, Aqua, Blue, Gold). Процедура ПГС методом CGH проводилась с использованием оборудования фирмы Agilent (США). Полногеномную амплификацию ДНК исследуемых бластомеров проводили с помощью набора PicoPlex SingleCell WGA Kit (Rubicon Genomics, США). Качество и количество полученной в ходе амплификации ДНК контролировали с помощью 1,2 агарозного электрофореза. Мечение ампликонов проводили с помощью набора Sure Print G 3 8 х 60 KCGH (Aglient, США), гибридизовали 16 часов, после чего проводили отмывку и сканирование на сканере биологических чипов SureScanMicroarrayScanner. Интерпретацию полученных результатов проводили с помощью программного продукта Agilent CytoGenomics 2.5.8.1.
Все бластоцисты хорошего качества подвергались криоконсервации у пациенток в обеих группах, во всех случаях перенос эмбрионов осуществляли в «криоциклах».
Подготовка эндометрия для переноса криоконсервированных эмбрионов проводилась с использованием циклической гормональной терапии (эстрадиола валерат в дозе 8 мг/сутки с 4–5-го дня менструального цикла, микронизированный прогестерон 400–600 мг/сутки с 15–16-го дня менструального цикла). Перенос эмбрионов осуществляли на 20–21-й день цикла, размораживание эмбрионов осуществляли согласно принятым в клинической практике протоколам.
При наличии подъема уровня сывороточного хорионического гонадотропина через 14 дней после переноса эмбрионов в полость матки регистрировали биохимическую беременность, а при визуализации плодного яйца в полости матки через 21 день после переноса эмбрионов – клиническую беременность.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Статистический анализ проводился с применением χ2-теста для сравнения категориальных переменных, t-теста для сравнения средних показателей. Мерой ассоциации для сравнения бинарных данных были отношение шансов (ОШ) с 95% доверительным интервалом (95% ДИ). Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05. Анализ затраты-эффективность ПГС был проведен с помощью программы TreeAge Pro Inc (США). Была построена модель принятия решений.
Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Результаты исследования
При оценке клинико-анамнестических характеристик групп сравнения отмечено, что средний возраст и средний индекс массы тела пациенток не имели статически значимых различий. Особенности менструальной функции, гинекологической и соматической заболеваемости пациенток также не различались в группах сравнения. Среднее число беременностей в анамнезе было выше у пациенток группы 1 и составило 4,3±3,0 в группе 1 по сравнению с 2,3±2,1 в группе 2 (р=0,0034). При оценке особенностей протокола овариальной стимуляции значимых различий получено не было (табл. 1).
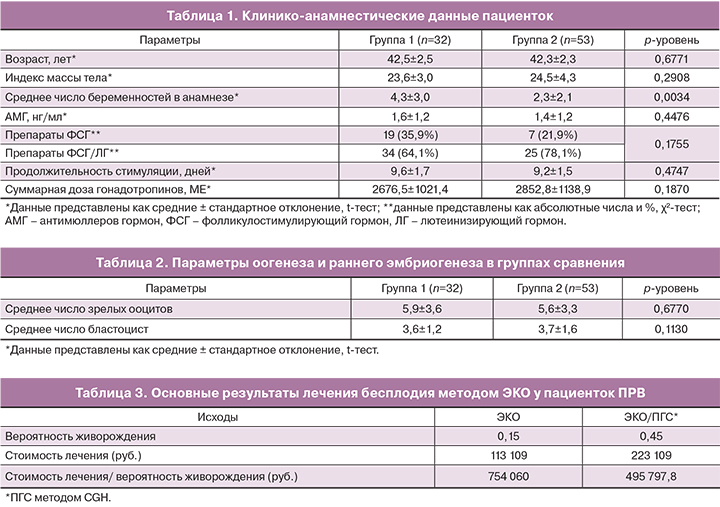
В группе 1 было получено 179 зрелых ооцитов (в среднем 5,9±3,6 на 1 пациентку), в группе 2 – 314 ооцитов (в среднем 5,6±3,7 на 1 пациентку) (р=0,0023). Все ооциты были оплодотворены методом ИКСИ, частота оплодотворения не различалась между группами. Среднее число бластоцист не различалось между группами (табл. 2).
У пациенток, которым проводили ПГС на 5-е сутки (группа 1б), было зарегистрировано значимо больше клинических беременностей (5 случаев, 45,4%) по сравнению с пациентками, которым проводили ПГС на 3-и сутки (группа 1а, 1 случай, 4,7%), и теми, кому ПГС не проводили (группа 2, 10 случаев, 18,8%) (р=0,0200). Живорождение было зарегистрировано у 5 пациенток (45,4%) группы 1б, 1 пациентки (4,7%) группы 1а и 8 пациенток (15,1%) группы 2 (р=0,0117).
Таким образом, единственным эффективным методом для повышения результативности программ ВРТ стал ПГС методом CGH на 5-е сутки. Напротив, применение ПГС на 3-и сутки снижало эффективность программ ВРТ. ОШ наступления беременности при применении ПГС методом CGH на 5-е сутки в группе пациенток в возрасте 40 лет и старше составило 3,6 (95% ДИ 0,9; 14,1). ОШ живорождения при применении ПГС методом CGH на 5-е сутки в группе пациенток в возрасте 40 лет и старше составило 4,7 (95% ДИ 1,1; 19,1).
На втором этапе исследования был проведен анализ клинико-экономической эффективности ПГС методом CGH на 5-е сутки у пациенток ПРВ. Была создана модель принятия решений (TreeAge Pro Inc), в которой было проведено сравнение 2 стратегий: рутинного ЭКО и ЭКО с ПГС методом CGH у бесплодных пациенток ПРВ для определения минимальной стоимости одного живорождения на одного пациента, проходящего вышеуказанное лечение бесплодия.
В анализе были учтены только прямые затраты на проведение ЭКО и ЭКО/ПГС, то есть непосредственная стоимость медицинских услуг. Стоимость ЭКО в свежем цикле рассчитывалась как норматив финансовых затрат на 1 случай применения процедуры за счет средств обязательного медицинского страхования в 2016 году [10]. Стоимость ПГС рассчитывалась по прайсу ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России и включала стоимость биопсии эмбриона и подготовки бластомеров для ПГС методом СGH для 4 эмбрионов (среднее число эмбрионов у пациенток в возрасте 40 лет и старше; собственные данные).
Вероятность живорождения при применении одного цикла ЭКО у пациенток ПРВ составила 15% по сравнению с 45% для пациенток ПРВ при применении одного цикла ЭКО/ПГС. Средняя стоимость лечения методом ЭКО составила 113 109 руб. по сравнению со 223 109 руб. при лечении методом ЭКО/ПГС.
Средняя стоимость лечения методом ЭКО для одного живорождения составила 754 060 руб., при лечении методом ЭКО/ПГС – 495 797,8 руб. Стоимость лечения бесплодия методом ЭКО/ПГС в расчете на одно живорождение была на 34% меньше по сравнению со стоимостью лечения бесплодия методом ЭКО (табл. 3).
Показатель приращения затрат (инкрементный показатель соотношения стоимости и эффективности – ICER) на ведение пациентки ПРВ при назначении или не назначении ПГС составил 258 262,2 руб. Показатель ICER означает, что для достижения дополнительного 1% эффективности (то есть 1% случаев живорождения) при отсутствии проведения ПГС как более эффективной методики требуется дополнительное вложение 258 262,2 руб.
Обсуждение
В настоящее время проблема восстановления фертильности у женщин ПРВ находится в эпицентре внимания врачей во всем мире. Программа ЭКО является одним из наиболее современных методов лечения бесплодия. При этом возраст является одним из основных факторов, влияющих на эффективность программ ВРТ. В связи с тем, что доля первородящих женщин ПРВ стремительно увеличивается с каждым годом, возрастает потребность в изучении методов, позволяющих повысить эффективность ВРТ у данной категории пациенток. Таким методом в настоящее время является ПГС, позволяющий производить отбор эуплоидных эмбрионов, тем самым повышая частоту наступления беременности. Несмотря на большое количество исследований в данной области, вопрос о необходимости проведения ПГС в данной группе пациенток остается предметом дискуссии.
В результате проведенного исследования установлено, что ПГС методом CGH на 5-е сутки в группе пациенток в возрасте 40 лет и старше увеличивает шансы наступления беременности в 3,6 раза и живорождения в 4,7 раза, что делает данный метод наиболее эффективным в циклах ЭКО/ПГС. Похожие результаты были получены в исследовании F. Ubaldi и соавт.: несмотря на то, что доля эуплоидных эмбрионов у пациенток в возрасте 44 лет и старше не превышала 14%, частота живорождения в расчете на перенос эмбриона составила 57,1% [11].
Интересно отметить, что проведение ПГС на 3-и сутки, напротив, снижало эффективность ВРТ. Полученные данные согласуются с исследованием S. Debrock и соавт., в котором применение ПГС методом FISH не влияло на эффективность ВРТ у пациенток 35 лет и старше [12]. В мета-анализе S. Mastenbroek и соавт. применение ПГС аналогичным способом не влияло на эффективность ВРТ в общей популяции пациенток, но снижало частоту живорождения в группе пациенток позднего возраста [13]. Неэффективность ПГС с изучением дробящегося эмбриона может быть связана с мозаицизмом, а также с потенциальной способностью эмбриона к самокоррекции [14]. Некоторые авторы также не исключают прямого негативного воздействия биопсии на эмбрион [13]. Необходимо учитывать, что в большинстве исследований эффективности ПГС на 3-и сутки генетическое исследование проводилось методом FISH, а значит, анализу подвергались ограниченное число хромосом, что также могло оказать влияние на полученные результаты.
На втором этапе исследования был проведен анализ затраты-эффективность ЭКО с ПГС методом CGH на 5-е сутки у пациенток ПРВ. ЭКО/ПГС является более клинико-экономически эффективным методом лечения бесплодия у пациенток ≥40 лет. Для достижения одного дополнительного процента живорождения в программах ВРТ в случае применения ПГС методом CGH на 5-е сутки культивирования эмбрионов происходит экономия 258 262,2 рублей по сравнению с отсутствием проведения ПГС. Противоположные результаты получены в исследовании J. Mersereau и соавт.:
ЭКО/ПГС не являлся клинико-экономически выгодной стратегией в подгруппах пациенток различного возраста [15]. Следует отметить, что в данной работе ПГС проводили методом FISH, что могло оказывать влияние как на стоимость, так и на эффективность метода.
Заключение
Суммируя все вышеизложенное, в данном исследовании показано, что у пациенток в возрасте 40 лет и старше, которым проводили ПГС методом CGH при биопсии бластоцисты, возрастала частота наступления клинической беременности и живорождения. Проведение ЭКО с ПГС методом CGH в данной группе пациенток является клинико-экономически выгодной стратегией. Полученные результаты подтверждают точку зрения, что ПГС является важным этапом при планировании беременности у пациенток ПРВ.



