В структуре гинекологической патологии эндометриоз занимает 3-е место после воспалительных заболеваний и миомы матки [1, 2]. В настоящее время серьезной проблемой является высокая частота рецидивов (до 45%) после завершения лечения [3]. Нет четкого понимания этиологии и патофизиологии заболевания, а интерпретация получаемых учеными данных носит противоречивый характер.
Отсутствие надежной неинвазивной диагностики малых форм эндометриоза [4] приводит к увеличению промежутка времени между первым проявлением симптомов боли, бесплодия и хирургическим подтверждением диагноза [5–7].
Эндометриоз – хроническое гинекологическое заболевание, главными клиническими проявлениями которого являются персистирующая боль и бесплодие, представляет собой доброкачественное разрастание вне полости матки ткани, по морфологическим и функциональным свойствам подобной эндометрию [8–10].
Особая роль в развитии наружного генитального эндометриоза (НГЭ) принадлежит процессам, происходящим в перитонеальной полости, приводящим к развитию или регрессу эндометриоидного очага [11]. Известно, что количество перитонеальной жидкости (ПЖ) у женщин с эндометриозом значительно увеличено и характеризуется высоким содержанием активированных макрофагов и продуцируемых ими цитокинов: фактор некроза опухоли-α (ФНО-α) [12], трансформирующий фактор роста-β (ТФР-β) [13], стимулирующих ангиогенез. ТФР-β, обнаруженный в высоких концентрациях в ПЖ больных НГЭ [14], обладает противовоспалительными свойствами и способен ингибировать синтез ФНО-α и других цитокинов, угнетать пролиферацию эндотелиальных клеток и способствовать развитию фиброза [15]. ФНО-α участвует в процессах, приводящих к апоптозу [16], активирует процессы липолиза и подавляет липогенез. Данные о локальной продукции факторов роста при эндометриозе неоднозначны.
ПЖ также содержит большое количество липопротеинов, особенно низкой плотности, которые генерируют окисленные липидные компоненты в составе макрофагальной воспалительной среды [17]. Параоксоназа (ПОН1) ассоциирована с липопротеинами высокой плотности (ЛПВП) и, предположительно, участвует во взаимодействии ЛПВП и липопротеинов низкой плотности (ЛПНП) [18].
Повышение уровня липидов у больных снижает функцию эндотелия и повышает степень окислительного стресса (повышается уровень продуктов окисления). Окислительный стресс обеспечивает условия для воспалительного и спаечного процесса тазовой брюшины, имеющего место при эндометриозе [19].
При этом известно, что хронические воспалительные процессы часто сопровождаются гиперхолестеринемией [15]. Однако механизмы повышения уровня ТФР-β1 при гиперхолестеринемии остаются мало исследованными.
Эти процессы при НГЭ мало изучены, в связи с чем представляется актуальным изучение изменений уровня липопротеинов и влияния их на продукцию цитокинов, а также поиск новых маркеров этого заболевания.
Цель исследования: оптимизировать диагностику НГЭ у пациенток репродуктивного возраста на основании определения продукции липидов и цитокинов.
Материал и методы исследования
Нами проведен проспективный анализ клинических проявлений заболевания и лабораторных исследований у 96 пациенток. Все пациентки были репродуктивного возраста (средний возраст 29,3±0,3 года) и проходили обследование и лечение в отделении гинекологии ФГБУ РНИИАП с 2010 по 2012 гг. В ходе проводимого исследования все больные были разделены на 3 клинические группы: I группу составили 28 больных с I–II стадиями НГЭ по классификации Американского общества фертильности (1985), II группу – 46 пациенток с III–IV стадиями заболевания. III контрольную группу составили 22 пациентки без эндометриоза, проводившие обследование по поводу бесплодия.
Для реализации поставленных задач использовались следующие методы исследования: клинические (анамнез, осмотр), лабораторные, ультразвуковое исследование, эндоскопические (лапароскопия, гистероскопия, кольпоскопия), гистологическое исследование удаленных во время лапароскопии биоптатов. Липопротеины в сыворотке крови и ПЖ определяли наборами фирмы Randox (Германия) на биохимическом анализаторе Сапфир-400 (Япония). Эндогенный уровень оксида азота в форме нитрит-аниона (NO-) определяли с помощью реактива Грисса. Определение СА-125 проведено набором DRG (Германия). Активность нитрооксидсинтазы (NOS) измеряли по увеличению продукции оксида азота из L-аргинина в присутствии NADPH. Факторы роста – цитокины определяли методом твердофазного иммуноферментного анализа наборами фирмы R£DSystems (США). Статистическая обработка данных осуществлялась с помощью лицензионного пакета программ Statistica 5.1, Stat Soft. Достоверность различий между сравниваемыми показателями определяли по критерию Стьюдента и его аналогу для непараметрических распределений – критерию Манна–Уитни. Результаты оценивали как статистически значимые при р<0,05. С целью определения диагностической чувствительности и специфичности анализируемых параметров мы проанализировали Roc-кривые или, иными словами, характеристические кривые распределения.
Результаты исследования и обсуждение
Изучены факторы пролиферации эндометриоидных гетеротопий (цитокины и факторы роста) и метаболических (липидных) показателей, которые влияют на активность ферментов, участвующих в процессах ангиогенеза.
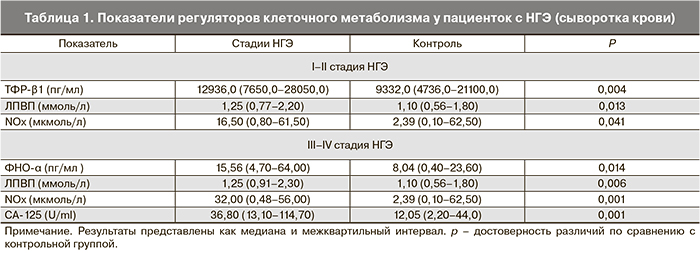
Полученные результаты у женщин с НГЭ I–II стадий представлены в табл. 1, из которой следует, что содержание ТФР-β1 в сыворотке крови пациенток с НГЭ I–II стадий в 1,4 раза больше по сравнению с контрольной группой (p<0,004). Значение системного уровня регуляции метаболичесикх процессов, контролирующих клеточный рост (ТФР-β1), свидетельствует о наличии компенсаторных реакций с участием мелатонина, блокирующего эстрадиол-обусловленную стимуляцию гетеротопий.
В липидном спектре выявлены изменения в содержании ЛПВП в сыворотке крови данных пациенток, характеризующиеся их повышением в 1,1 раза (p<0,013) (табл. 1). Такое увеличение ЛПВП обусловливает повышение содержания параоксоназы-1 (ПОН-1), входящей в состав данного комплекса липопротеинов, а следовательно, и ее активности. Подтверждением этого положения служит результат изучения полиморфизма гена параоксоназы [20], которое показало отсутствие его различий по сравнению с показателями у пациенток контрольной группы. Модификация ЛПВП у женщин с I–II стадиями НГЭ на системном уровне носит компенсаторный характер, направленный на предупреждение формирования более «значимых» эндометриоидных гетеротопий на местном уровне.
Содержание метаболитов оксида азота (NOх) в сыворотке крови пациенток с НГЭ I–II стадий оказалось повышенным по сравнению с контрольной группой в 6,9 раза (p<0,041), тогда как активность NO-синтазы достоверно не изменялась и оставалась на уровне физиологических показателей (табл. 1). Можно предположить, что причиной повышения NO является активация нитритредуктазного пути его синтеза.
В данной ситуации гиперпродукция метаболитов NO способствует прогрессированию эндометриоидных гетеротопий, что, с одной стороны, обусловлено вазодилатацией. С другой стороны, фактор, способный стимулировать миграцию и пролиферацию эндотелиальных клеток, приводит к образованию новых сосудов, в результате чего усиливается кровоснабжение, а следовательно, и рост гетеротопий. Кроме того, NO известен как мощное антиапоптозное соединение [8]. Известно, что высокая генерация NO играет важную роль в синтезе и отложении коллагена, способствующего образованию спаек.
Как видно из табл. 1, содержание ФНО-α в сыворотке крови пациенток с НГЭ III–IV стадий оказалось в 1,9 раза больше по сравнению с контрольной группой (p<0,014), что способствует усилению индукции фосфолипазы А2 (ФЛА2), участвующей в запуске каскада арахидоновой кислоты, в результате чего обеспечивается синтез простагландинов, обусловливающих болевой синдром. По данным нашего исследования, у 68,9% (51) больных с НГЭ имели место периодические боли перед или во время менструации, диспареуния была у 8,1% (6).
Исходя из действия ФНО-α на пролиферирующие клетки, конечным результатом которого является апоптоз, можно полагать, что у данных женщин имеет место воспалительный процесс, так как синтез ФНО-α не наблюдается в не стимулированных клетках, что позволяет считать высокий уровень ФНО-α результатом действия инфекции. У 14,4% больных этой группы обнаружены инфекции, передающиеся половым путем, у 78,3% – воспалительные заболевания органов малого таза.
ФЛА2 является структурной единицей ЛПНП (уровень которых у данных пациенток с III–IV стадиями НГЭ соответствует контрольным значениям, см. табл. 1). Можно полагать, что в данной ситуации на системном уровне это достигается повышенным содержанием ЛПВП, в состав которых входит фермент параоксоназа, защищающий от окисления ЛПНП и обеспечивающий расщепление и выведение окисленного холестерина. Представленные в табл. 1 данные позволяют констатировать, что достоверные изменения в содержании изученных липидных фракций касались только ЛПВП.
Содержание NOх в сыворотке крови пациенток с НГЭ III–IV стадий (табл. 1) в 13,4 раза повышено по сравнению с контрольной группой (p<0,001).
Для доказательства отсутствия неопластического процесса у пациенток с НГЭ нами проведено определение СА-125. У больных с I–II стадиями заболевания они соответствовали нормальным величинам, характерным для здоровых женщин. Уровень СА-125 повышается в крови женщин при выраженных формах эндометриоза [21] (табл. 1) и колеблется в нормальных пределах при меньшей выраженности заболевания. Предполагается, что эндометриоидные гетеротопии содержат большое количество СА-125 по сравнению с эндометрием, а сопутствующая эндометриозу локальная воспалительная реакция способствует поступлению этого маркера в кровь.
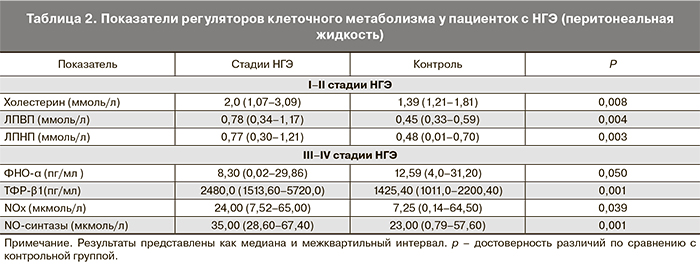
Изучение липидного спектра в ПЖ у пациенток с I–II стадиями НГЭ показало, что имеет место повышенное содержание свободного холестерина в 1,43 раза, ЛПВП в 1,73 раза и ЛПНП в 1,6 раза (p<0,008, p<0,004, p<0,003 соответственно) (табл. 2).
Высокий уровень холестерина ЛПВП (ХС ЛПВП) в ПЖ у этих пациенток направлен на подавление воспаления. Такое положение вытекает из ранее выявленного нами воспалительного процесса в ПЖ, подтвержденное повышенным содержанием в ней провоспалительных цитокинов (ФНО-α и интерлейкин 1β) [22]. Однако установлено, что при воспалительном процессе ЛПВП изменяют свою функцию на провоспалительную вследствие снижения концентрации основного аполипопротеина ЛПВП – АпоА, который обеспечивает обратный транспорт холестерина в печень и увеличивает активность параоксоназы. В ПЖ у женщин с НГЭ в отличие от сыворотки крови обнаружено увеличение уровня и ЛПНП (p<0,003) относительно контрольных данных, что может быть результатом компенсаторных реакций, направленных на увеличение активности ФЛА2 – структурной единицы ЛПНП. Содержание ФНО-α в ПЖ у пациенток с НГЭ III–IV стадиями в 1,5 раза меньше по сравнению с контрольной группой (p<0,050) (табл. 2). В то же время уровень ТФР-β1 у данных женщин был в 1,7 раза выше референтных показателей (р<0,001). Такие изменения в продукции ФНО-α дают основание полагать, что в ПЖ имеет место сниженная функция этого цитокина как фактора ангиогенеза и клеточной пролиферации. Регуляторные возможности ФНО-α в ПЖ, определяемые также прежде всего его способностью индуцировать апоптоз и осуществлять антибактериальный защитный эффект, резко снижены.
Что касается ТФР-β1, то в условиях НГЭ III–IV стадий в ПЖ высокий уровень данного фактора роста может быть одним из метаболических соединений, результатом действия которого является развитие фиброза (основа спаечного процесса). Высокий уровень этого фактора роста, можно предположить, является результатом наличия воспалительного процесса, на что указывают исследования Н.В. Ермоловой (2008), которые подчеркивают, что воспаление считается ярким признаком эндометриоидных образований и обладает одновременно локальными и системными последствиями [22].
Содержание NOх в ПЖ пациенток с НГЭ III–IV стадий – мощного фактора роста сосудов, вазодилататора и ингибитора апоптоза [23] в 3,3 раз повышено по сравнению с контрольной группой (p<0,039) (табл. 2). Это обусловливает усиленное кровоснабжение эндометриоидных гетеротопий. В ПЖ высокая генерация NOх обусловлена NO-синтазным путем, о чем свидетельствует высокая активность данного фермента, превышающая физиологические показатели почти в 1,5 раза (p<0,001). Избыток NOх сопровождается оксидантным стрессом и выступает как мутагенный и канцерогенный фактор или антиапоптозный фактор [8].
В доступной на сегодняшний день литературе вопрос о маркерах НГЭ остается открытым в связи с отсутствием их специфичности и чувствительности [4, 7]. В связи с этим нами предпринята попытка оценить диагностические возможности изучаемых нами параметров (холестерина, ЛПВП, ЛПНП, NO, ФНО-α, СА-125) применительно к цели нашего исследования.
Нами проведен ROC-анализ четырех моделей для определения диагностической чувствительности и специфичности анализируемых параметров в качестве неинвазивных маркеров НГЭ: 1-я модель, содержащая такие параметры, как ЛПВП, NO, СА-125; 2-я модель (холестерин, ЛПВП, ЛПНП, NO, ФНО-α, СА-125); 3-я модель (ЛПВП, ЛПНП, NO, ФНО-α, СА-125); 4-я модель (ЛПВП, NO, ФНО-α, СА-125). Все модели соответствуют очень хорошему качеству с достоверностью р<0,0001.
С учетом полученных нами данных о специфичности и чувствительности предложенных моделей лучшими являются 2-я модель (AUC = 0,86; специфичность 83%, чувствительность 75%) и 4-я модель (AUC = 0,86; специфичность 82%, чувствительность 80%). Исследование этих показателей у пациенток с подозрением на НГЭ может быть рекомендовано для практического использования в виде клинического протокола. При этом более экономичный вариант представлен в 4-й модели.
Заключение
На системном уровне (сыворотка крови) у женщин с НГЭ I–II стадий обнаружено высокое содержание ТФР-β1 и ЛПВП, а также метаболитов NO. Модификация метаболических процессов на системном уровне может иметь существенное значение в нарушении их на местном уровне. Однако модификация молекулярных взаимосвязей липидного обмена (ЛПВП) с ангиогенными соединениями в эндотелиальных клетках увеличивает генерацию NO, обусловливая усиление кровоснабжения гетеротопий. Высокий уровень ТФР-β1 ингибирует NO-синтазу, снижая одну из реакций образования NO, то есть на системном уровне имеет место развитие компенсаторных процессов (нитритредуктазный путь синтеза NO). В то же время в ПЖ имело место повышение свободного холестерина, ЛПНП и увеличение показателей ЛПВП, что свидетельствует о наличии адаптивных реакций, способствующих снижению пролиферации и воспаления.
Обнаруженные закономерности у пациенток с III–IV стадиями НГЭ свидетельствуют о взаимосвязи ЛПВП и ФНО-α, обладающих противоспалительными свойствами. В ПЖ у больных этой группы значительно увеличены показатели ТФР-β1, метаболитов NO и NO-синтазы, что свидетельствует о NO-синтазном пути синтеза оксида азота.
При подозрении на наличие НГЭ у пациенток, страдающих дисменореей, бесплодием и наличием кистозных образований в яичниках в клиническом протоколе следует использовать определение в сыворотке крови с целью малоинвазивной диагностики одну из моделей показателей: ЛПВП, NO, ФНО-α, СА-125 или холестерин, ЛПВП, ЛПНП, NO, ФНО-α, СА-125. Если содержание в сыворотке крови ЛПВП менее 1,25 ммоль/л, метаболитов оксида азота менее 16,50 ммоль/л, ФНО-α менее 15,56 пг/мл, СА-125 менее 36,8 U/ml, диагноз НГЭ не подтверждается. При значения сывороточного содержания ЛПВП более 1,25 ммоль/л, метаболитов оксида азота более 16,50 ммоль/л, ФНО-α более 15,56 пг/мл, СА-125 более 36,8 U/ml устанавливают диагноз НГЭ.
Выявленные изменения во взаимосвязи липидного спектра, факторов роста и ангиогенных соединений являются теоретическим основанием для проведения дополнительных лечебных мероприятий, направленных на нормализацию обменных процессов при НГЭ.



