Эндометриоз – генетически обусловленное, хроническое, дисгормональное, иммунозависимое заболевание с разрастанием ткани, аналогичной по морфологическому строению и функции эндометрию, за пределами слизистой оболочки матки.
Поражение мочевыделительной системы эндометриозом встречается редко и составляет 1–2% из всех случаев эндометриоза [1]. Чаще всего поражается мочевой пузырь (84%), поражение мочеточников составляет 10%, причем левый мочеточник поражается чаще, чем правый [2], почки – 4%, а уретра поражается в 2% наблюдений. По литературным данным за последние годы увеличилась частота заболеваемости (0,3–12%).
В патогенезе эндометриоза мочевыводящиx путей авторы обсуждают все 4 основныx патогенетическиx теории развития эндометриоза: эмбриональная теория [3, 4] миграционная или метастатическая [5], трансплантационная (ретроградная менструация) [6, 7] и ятрогенная теория [4, 8]. В последние годы возобновлены исследования по изучению роли стволовых клеток эндометрия в возникновении эктопических эндометриоидных очагов [9]. Для детекции стволовых клеток эндометрия и эндометриоидных очагов авторы использовали разные маркеры, Oct-4 [10], мРНК Oct4 [11], Musashi-1 [12], Bcl-2, CD117 и CD34 [13], CD13 и CD9 [14]. Данных по содержанию в эндометрии и эндометриальных гетеротопиях одних из основных маркеров стволовости ALDH1 и CD15 в доступной литературе нами не найдено. Кроме того, остаются дискуссионными механизмы роста эндометриоидных гетеротопий и участие в них эпителиально-мезенхимальной трансдифференцировки.
Цель исследования: выявить клинико-морфологические и иммуногистохимические особенности, а также роль клеток с признаками стволовости в патогенезе инфильтративного эндометриоза мочевыводящих путей.
Материал и методы исследования
В исследование были включены 62 пациентки, проходивших обследование и лечение в НЦАГиП им. В.И. Кулакова по поводу инфильтративного эндометриоза с поражением мочевыводящих путей в период с февраля 2010 по май 2015 г.

Пациентки были разделены на две группы. I группу составили пациентки с инфильтративным эндометриозом мочевыводящих путей, обратившиеся впервые по поводу заболевания. II группу составили пациентки с инфильтративным эндометриозом мочевыводящих путей, которые ранее получали лечение по поводу эндометриоза. Для иммуногистохимического исследования создана контрольная группа (III).
Пациентки I и II группы проходили физикальное обследование, были проведены все необходимые клинико-лабораторные и инструментальные исследования (ультразвуковое исследование, магнитно-резонансная томография, компъютерная томография, колоноскопия, цистоскопия) для уточнения диагноза и подготовки к оперативному лечению.
Хирургическое лечение проведено у 61 пациентки, 1 пациентка была выписана домой накануне оперативного лечения по семейным обстоятельствам. Предоперационная подготовка, вид анестезии и послеоперационное ведение пациенток проведено в соответствии с планируемым и проведенным объемом оперативного лечения.
В контрольной группе (III) исследовали здоровый эндометрий в стадии пролиферации, взятый у 10 женщин (суррогатных матерей).
На гистологическое исследование были направлены все интраоперационно иссеченные ткани, резецированные части органов или удаленные органы.
Для данного исследования использовали соскобы эндометрия, взятые у пациенток с эндометриозом мочевыводящих путей, резецированные части или иссеченные участки стенок мочевого пузыря, резецированные отделы мочеточников и эндометриоидные инфильтраты, прилегающие и сдавливающие мочеточники. Гистологическое исследование проведено у 61 пациентки. Диагноз «эндометриоз» был подтвержден у всех больных.
Гистологическое исследование проведено у 61 пациентки с фиксацией материала в 10% забуференном формалине по общепринятой методике с окраской гематоксилином и эозином.
Иммуногистоxимическое исследование проведено у 25 пациенток: у 5 из I группы, у 10 из II группы и у 10 в контрольной группе.
Иммуногистохимическое исследование проводили на депарафинированных срезах толщиной 4–5 мкм по общепринятым протоколам (DAKO protocols).
Иммуногистоxимическое исследование проведено у 25 пациенток: у 5 из I группы, у 10 из II группы и у 10 в контрольной группе по общепринятым протоколам (DAKO protocols), с помощью моноклональных антител выявляли Cytokeratinw – polyclonal rabbit antibody, 1:500, Dako, Claudin 3 – polyclonal rabbit antibody, RTU, Thermo Scientific. Vimentin – monoclonal mouse antibody ( clone V9), RTU, Dako, CD15 – monoclonal mouse antibody ( clone MMA), 1:50, Cell Marque., Aldh1A1 – rabbit monoclonal antibody (clone EP1933Y), 1:400, GeneTex, Musashi1 – rabbit monoclonal antibody (clone EP1302), 1:200, GeneTex, SOX2 – rabbit monoclonal antibody ( clone SP76), 1:100, Cell Marque, PTEN – monoclonal mouse antibody (clone 6H2.1), 1:100, Dako. В качестве вторичных антител и агентов для детекции ставили положительные и отрицательные контрольные реакции.
Результаты иммуногистохимической реакции оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (-) – 0 баллов; менее 5% иммуноокрашенных клеток (+) – 0,5 балла, менее 20% (+) – 2 балла; от 20 до 40% (++) – 4 балла; более 40% (+++) – 6 баллов.
Для достоверности полученных результатов иммуногистоxимическиx исследований использовалась контрольная группа, в которой исследовали здоровый эндометрий в фазе пролиферации. Для статистической оценки результатов использовался метод Манна–Уитни.
Результаты исследования
Возраст пациенток в обеих группах находился в пределах от 23 до 50 лет, средний возраст составил 35±1 год. Большинство пациенток были репродуктивного возраста – 93,5%; 6,5% – перименопаузального возраста.
Из 62 пациенток, участвующих в исследовании, у 29 (47%) был диагностирован эндометриоз мочевого пузыря, 20 (32%) поражение мочеточников и у 13 (21%) сочетанное поражение мочевого пузыря и мочеточников. Эндометриоидное поражение других отделов мочевыделительной системы (уретры, почек и верхней трети мочеточников) в данной группе не диагностировано.
Урологические симптомы отмечали 23 пациентки (37,1%) из 62. Из них 9 (39,1%) отмечали появление или усиление урологических симптомов до и во время менструации. В I группе количество пациенток с урологическими жалобами составило 8 (34,8%) а во II группе – 15 (38,4%). Самыми частыми предъявляемыми урологическими жалобами являлись учащенное мочеиспускание – 9 (39,1%), болезненное мочеиспускание – 8 (35%), затрудненное мочеиспускание – 4 (17,4%) и циститы в анамнезе – 5 (21,7%). Боли в нижних отделах живота с иррадиацией в поясничную область и в спину предъявляли 4 (17,4%) пациентки при поражении мочеточников. В 62,9% заболевание протекало без урологическиx симптомов.

С помощью нефросцинтиграфии и компъютерной томографии у 6 пациенток была диагностирована потеря почечной функции, по 3 пациентки в каждой группе.
По результатам инструментальных методов исследования и интраоперационно в сочетании с поражением органов мочевыводящих путей было выявлено эндометриоидное поражение органов малого таза и брюшной полости. Данные приведены в таблице.
Из приведенной таблицы можно увидеть, что во II группе проксимальные отделы кишечника чаше вовлекаются в эндометриоидный процесс. Поражение тонкой кишки во II группе был диагностировано у 5 пациенток, а в I группе – всего у 1. Также можно отметить, что во II группе встречались двойные эндометриоидные инфильтраты разных отделов кишечника у одной и той же пациентки.
В результате изучения анамнестическиx данных установлено, что промежуток между рецидивами у пациенток II группы, вне зависимости была ли проведена гормональная терапия в послеоперационном периоде или нет, составил от 3 месяцев до 3 лет. У некоторыx больныx выявлены многократные рецидивы (от 2 до 4). При этом при каждом следующем рецидиве в эндометриоидный процесс вовлекалось все больше органов малого таза и брюшной полости, с нарушением их функции.
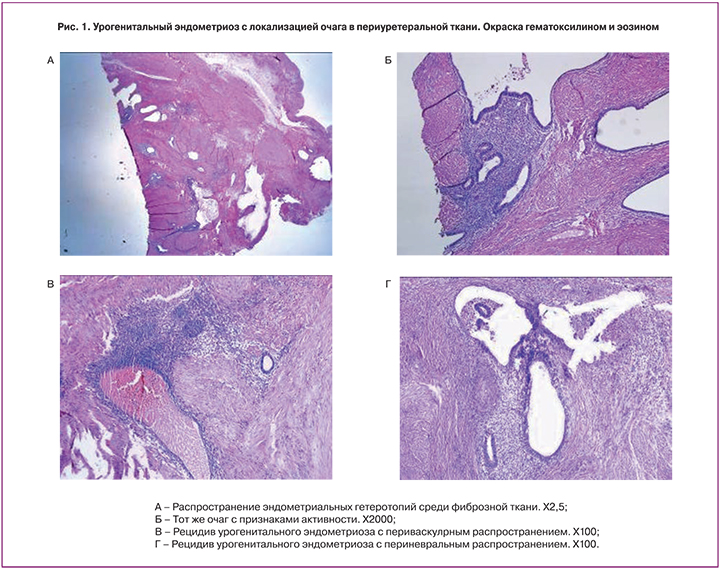
Морфологическое исследование: эндометриоидные гетеротопии локализовались в стенке мочевого пузыря, мочеточников (рис. 1), около мочеточниковой жировой клетчатке и прорастали в просветы мочевого пузыря и мочеточников, а также периневрально и периваскулярно распространялись до крестцовых сплетений и подвздошных костей. Очаги обладали свойствами активных очагов, описанных нами ранее [15]. В I группе (n=22) у 9 (41%) эпителий очагов был пролиферативного типа, в 4 (18%) наблюдениях обнаружен периваскулярный рост эндометриоидного инфильтрата. Во II группе кистозные трансформации выявлены у 12 (30,7%) пациентов, пролиферативная форма эпителия у 15 (38,4%) и у 12 (30,7%) – гиперпластическая форма эпителия. В 4 (10,2%) наблюдениях обнаружен периневральный рост инфильтрата с разрушением ганглиев. У 8 (20,5%) пациентов в очагах эндометриоза обнаружены признаки воспаления (рис. 1).
Иммуногистохимическое исследование
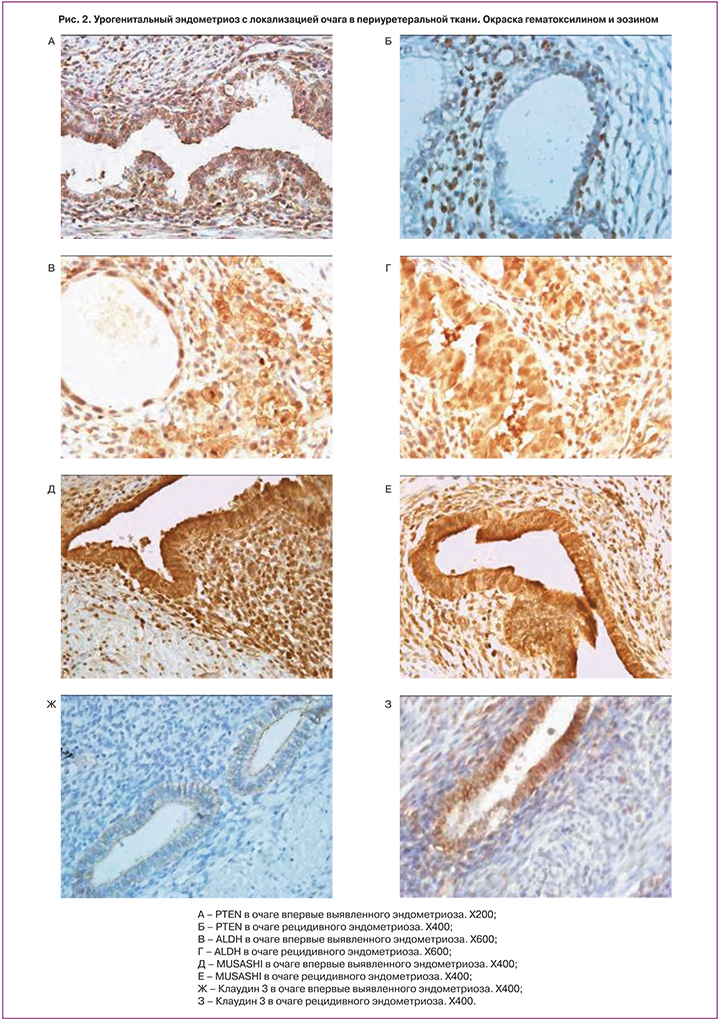
При изучении результатов иммуногистохимических реакций обнаружены особенности экспрессии маркеров стволовости (PTEN,CD15, ALDH1, Musashi, SOX2) в эндометриоидных гетеротопиях и в аутологичном эндометрии (рис. 2).
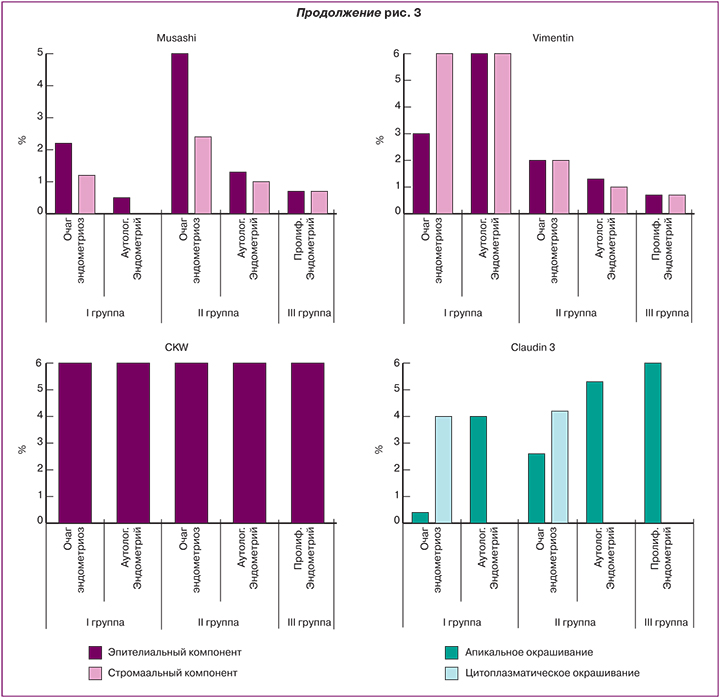
В обеих группах отмечена частичная потеря PTEN в очагах эндометриоза с гиперпластическими изменениями эпителия и аутологичном эндометрии по сравнению с контрольной группой (р<0,05) (рис. 2 А,Б; рис. 3). Aldh A1 и SOX2 в эндометриоидных гетеротопиях была достоверна выше по сравнению с аутологичным эндометрием в обеих группах (р<0,05). Экспрессия обоих маркеров была более выражена во II группе. В контрольной группе экспрессии SOX2 и Aldh A1 не выявлено (р<0,05) (рис. 2 В, Г; рис. 3). Экспрессия CD15 выявлена только в эпителиальных компонентах очагов эндометриоза и аутологичного эндометрия I и II группы и не выявлена в контрольном эндометрии. Во II группе экспрессия была более выражена (р<0,05). Экспрессия Musashi была обнаружена во всех III группах. Наиболее выраженная экспрессия выявлена в очагах эндометриоза у пациенток из II группы (р<0,05) (рис. 2 Д, Е; рис. 3).
При изучении результатов иммуногистохимических реакций обнаружены особенности экспрессии маркеров эпителиальной и мезенхимальной дифференцировки (CKW, Cld3, Виментин) в эндометриоидных гетеротопиях и аутологичном эндометрии. Виментин обладал более высокой экспрессией у пациенток с эндометриозом по сравнению с контрольной группой (р<0,001), которая выявлялась как в ткани эндометрия, так и очагах эндометриоза (рис. 3). Экспрессия CKW определялась только в эпителиальных клетках; по количественным показателям в I, II и контрольной группе не отличалась и оценивалась на 6 баллов (рис. 3). При статистической обработке различий между группами не обнаружено (p>0,05). В очагах эндометриоза в I и во II группах преобладало цитоплазматическое окрашивание Клаудин 3. Напротив, в эндометрии уровень апикального окрашивания был доминирующим и наиболее выраженным в группе контроля. Это может свидетельствовать о роли эпителиально-мезенхимальной трансформации в формировании агрессивных свойств очагов эндометриоза, так как эпителиально-мезенхимальная трансформация способствует инфильтративному росту (рис. 2 Ж, З; рис. 3).
Обсуждение
Обобщая данные по изучению маркеров стволовости в клетках очагов эндометриоидных гетеротопий и аутологичном эндометрии следует отметить следующие особенности: во-первых, эпителиальный компонент очагов эндометриоза достоверно более сильно экспрессирует маркеры стволовости CD15, ALDH1, Musashi, SOX2 , особенно в рецидивных случаях; во-вторых, эпителиальный компонент очагов эндометриоза частично теряет экспрессию PTEN. Полученные данные могут свидетельствовать об участии стволовых эндометриоидных клеток (или стволовых клеток другого происхождения) и в формировании очагов эндометриоза и в его инфильтративном росте, а частичная потеря PTEN аналогична тому, что наблюдается при атипической гиперплазии эндометрия и эндометриальной интраэпителиальной неоплазии. Полученные нами данные подтверждаются наблюдениями Song и соавторов (2014) которые изучили транскрипцию фактора плюрипотентности SOX2 NANOG (Nanog homeobox) и OCT4 у женщин репродуктивного возраста с и без эндометриоза яичников. Исследование показало, что в эндометрии у женщин с эндометриозом яичников экспрессия указанных маркеров была значительно выше, чем в эндометрии у женщин без эндометриоза. Кроме того, было выявлено, что в очагах эндометриоза экспрессия данных маркеров значительно превышала показатели эутопического эндометрия [16].
Резюмируя данные по изучению маркеров клеточной дифференцировки в очагах эндометриоидных гетеротопий и в аутологичном эндометрии необходимо подчеркнуть следующие особенности: во-первых эпителиальный компонент очагов эндометриоза достоверно более сильно экспрессирует маркер мезенхимальной дифференцировки – виментин, особенно в рецидивных случаях (клетки – гибриды экспрессирующие маркеры и мезенхимальной и эпителиальной дифференцировки); во-вторых, эпителиальный компонент очагов эндометриоза частично теряет в области межклеточных контактов клаудин 3; в-третьих, патологическая экспрессия виментина и клаудина 3 обнаруживается и в аутологичном эндометрии пациенток с эндометриозом.
Заключение
Эндометриоидные гетеротопии отличаются от аутологичного эндометрия не только структурой, но и степенью зрелости клеток и их молекулярной организацией по виментину, Musashi, ALDH1,CD15 и SOX2. Эндометриоидные гетеротопии обладают более высокой экспрессией маркеров стволовости, что свидетельствует о их относительной незрелости, которая выражается более активной пролиферацией и инфильтративным ростом.
Повышенная экспрессия виментина во II группе в эндометриоидных очагах свидетельствует о возможности эпителиально-мезенхимальной трансформации и обеспечивает инвазивный рост очагов. Потеря апикальной части клаудина 3 в очагаx эндометриоза обеспечивает легкую диссеминацию активныx эндометриоидныx частиц. Потеря PTEN в эндометриоидныx очагаx, особенно I группы, свидетельствует о снижении апоптоза в эндометриоидной ткани и также способствует активной пролиферации. Повышенная экспрессия CKW – еще одно свидетельство активного пролиферативного процесса.
Таким образом, полученные результаты иммуногистохимического исследования полностью объясняют морфологические особенности и клиническую картину эндометриоза мочевыводящих органов.



