По данным различных авторов, частота хронического эндометрита (ХЭ) в структуре гинекологической патологии колеблется от 3 до 73% [1, 2], что во многом связано с трудностями морфологической верификации диагноза [3]. Еще большую проблему представляет лечение бесплодия с применением вспомогательных репродуктивных технологий при ХЭ: персистирующее повреждение эндометрия инфекционным агентом и сопутствующее подострое воспаление приводят к множественным вторичным морфофункциональным изменениям, нарушающим циклическую биотрансформацию и рецептивность слизистой оболочки тела матки [4]. Учитывая, что результативность программ ЭКО зависит от готовности эндометрия к имплантации и снижается с увеличением количества неэффективных попыток [5, 6], выявление наличия остаточного воспаления, а также сопутствующих изменений в тканях является актуальной проблемой современной репродуктологии.
Отсутствие клинических проявлений при хроническом воспалении сопровождается изменениями соотношений локального и системного содержания регуляторно-транспортных белков и гормонов, а также активности экспрессии рецепторов на клетках и активацией локальной секреции провоспалительных цитокинов [1, 7]. Содержание гормонов и цитокинов подвержено значительной индивидуальной вариабельности, и более перспективными маркерами хронического воспаления представляются менее чувствительные к кратковременным изменениям и позволяющие эффективнее прогнозировать исход программы ЭКО концентрации регуляторно-транспортных белков в системе кровообращения и непосредственно в эндометрии. В их числе – полифункциональный α2-макроглобулин (α2-МГ), ингибирующий протеиназы при воспалении, участвующий в распознавании бактериальных протеиназ, транспортирующий и модулирующий синтез цитокинов, гормонов и липидов [8]; альбумин (АЛБ), также являющийся металлопротеином, белком скавенджером и общепризнанным негативным реактантом воспаления; и модулятор синтеза цитокинов – лактоферрин (ЛФ), являющийся позитивным маркером воспалительной реакции в крови (значительное количество депонировано в нейтрофилах и высвобождается при воспалении) и обладающий выраженной антибактериальной и противовирусной активностью [9]. Необходимо отметить, что α2-МГ и АЛБ являются еще и маркерами селективности экссудации [10].
Цель настоящего исследования состояла в оценке содержания регуляторно-транспортных белков (α2-МГ, АЛБ, ЛФ) в крови и внутриматочных смывах пациенток с бесплодием трубно-перитонеального генеза, ассоциированным с ХЭ для прогноза результативности программ ЭКО.
Материал и методы исследования
Основная группа состояла из 77 женщин (средний возраст 29,0±1,5 года), с нарушением фертильности, обусловленным трубно-перитонеальным фактором, ассоциированным с ХЭ. Из них 13 пациенток обследованы в динамике: перед вступлением в программу ЭКО и в день TВП (трансвагинальной пункции фолликулов), 51 – только в день TВП. Группа сравнения была представлена 73 женщинами с трубным фактором бесплодия без указания на наличие хронического воспалительного процесса в полости матки. При этом 15 пациенток обследованы в динамике: до начала программы ЭКО и в день TВП, 43 – только в день TВП.
Длительность бесплодия в среднем составляла 5,0±1,8 года. Всем пациенткам проводилось комплексное обследование в соответствии с приказом № 107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению». Верификация диагноза ХЭ проводилась на основании общеклинических, микробиологических, лабораторных исследований, трансвагинальной эхографии, а также посредством гистероскопии в первую фазу менструального цикла (7–10-й день) с морфологическим исследованием аспиратов эндометрия. При выявлении патогенной микрофлоры в аспиратах эндометрия проводился курс антибактериальной терапии с учетом чувствительности с последующим контролем эрадикации возбудителя воспалительного процесса. У пациенток с ХЭ с целью восстановления его рецептивности, проводились курсы гормональной терапии препаратами эстрадиола валерата с 5-го по 25-й день цикла и производными прогестерона с 16-го по 26-й день цикла. После проведения лечебных и подготовительных процедур всем женщинам проводилась программа ЭКО. В программах ЭКО у пациенток с ХЭ нами назначалась терапия препаратами эстрадиола валерата с добавлением производных прогестерона после TВП. Индукция суперовуляции в обеих группах проводилась по «короткому» протоколу с использованием антагонистов гонадотропин-рилизинг-гормона по стандартной методике [11]. Оплодотворение ооцитов производилось методом ЭКО. Осуществлялся селективный перенос 1 бластоцисты 4–5-го класса качества на 5-е сутки культивирования.
Сбор коллекций образцов внутриматочных смывов для проведения иммунологических исследований осуществлялся перед стимуляцией суперовуляции на 19–21-й день менструального цикла, предшествовавшего программе ЭКО. Получение смывов осуществлялось при помощи следующей методики: в полость матки через пластмассовый катетер диаметром 2 мм вводилось 3 мл физиологического раствора, экспозиция около 1 минуты, затем содержимое аспирировалось. Сбор сывороток венозной крови из локтевой вены осуществлялся перед началом программы и перед ТВП. В качестве контрольной группы исследованы внутриматочные смывы от 10 здоровых женщин сопоставимого возраста (26±1,8 года) из группы суррогатных матерей и доноров ооцитов.
От всех принимавших в исследовании женщин было получено добровольное информированное согласие.
Содержание α2-МГ в сыворотке крови определяли методом количественного ракетного иммуноэлектрофореза, а во внутриматочных смывах – методом твердофазного иммуноферментного анализа (ИФА) с использованием исследовательских тест-систем, разработанных на базе НИЛ иммунологии ГБОУ ДПО НГИУВ (г. Новокузнецк, Россия)
Для определения концентрации ЛФ в сыворотке крови и во внутриматочных смывах методом ИФА использовали коммерческие тест-системы (ЗАО «Вектор-Бест», г. Новосибирск, Россия).
Концентрации АЛБ в сыворотке крови изучали стандартным биохимическим методом (с бромкрезоловым зеленым), а в составе внутриматочных смывов – количественным ракетным иммуноэлектрофорезом с использованием исследовательской тест-системы, разработанной на базе НИЛ иммунологии ГБОУ ДПО НГИУВ (г. Новокузнецк, Россия)
Статистический анализ полученных результатов проводился при помощи сертифицированной коммерческой программы InStat II (GraphPad, США). Использовалась проверка распределения по Колмогорову–Смирнову, в зависимости от ее результатов проводилось парное межгрупповое сравнение показателей с применением параметрического (по критерию Стьюдента) либо непараметрического вариантов t-статистики.
Результаты исследования и обсуждение
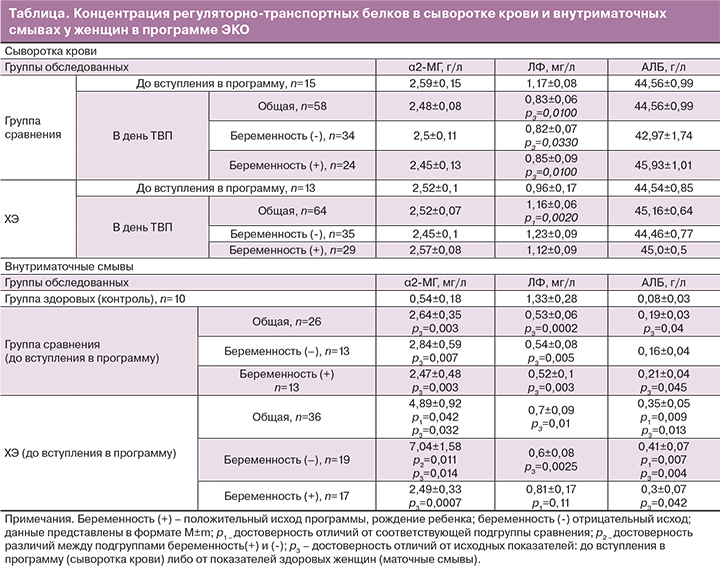
Согласно полученным данным, не обнаружено статистически достоверных отличий в содержании α2-МГ и АЛБ в крови у женщин с ХЭ от показателей в группе сравнения до и во время TВП вне зависимости от исхода программы (таблица).
Концентрации ЛФ в крови женщин с ХЭ, вступавших в программу ЭКО, статистически значимо не отличались от группы сравнения (таблица).
В группе пациенток с ХЭ, получавших препараты эстрадиола-валерата в программе ЭКО, уровень ЛФ (в день TВП) был значимо выше, чем в группе сравнения, вне зависимости от результативности программы ЭКО. В группе сравнения зафиксировано снижение концентраций белка в программе, в сравнении с исходными данными.
При исследовании содержимого внутриматочных смывов установлено, что у здоровых женщин содержание ЛФ было сопоставимо с венозными концентрациями белка и даже превышало их на 13%. Поскольку ЛФ постоянно секретируется эпителиальными клетками и его локальные концентрации могут значительно превышать содержание белка в сыворотке крови [9], данный факт свидетельствует не о воспалительной реакции, а об антибактериальном и противовирусном потенциале слизистых оболочек.
Средние концентрации ЛФ в маточных смывах у женщин с бесплодием перед вступлением в программу ЭКО («в период окна имплантации») были значимо ниже в сравнении с контрольной группой. При этом нами не установлено зависимости концентраций белка от результативности программы ЭКО. Вполне вероятно, что врожденный дефект локальной секреции ЛФ может быть одной из причин бесплодия трубно-перитонеального генеза, возникающего вследствие перенесенной бактериальной инфекции [1, 5, 12], поскольку ЛФ обладает мощными антибактериальными и противовирусными свойствами, а также участвует в процессах оплодотворения и имплантации эмбриона [9].
Концентрации α2-МГ в смывах из полости матки у пациенток с бесплодием были значимо выше, чем у здоровых женщин (в 5 в группе сравнения и в 9 раз при ХЭ). При этом наиболее высокие концентрации белка (в 13 раз превышающие нормативные значения) были у женщин с ХЭ при нерезультативных программах ЭКО. В группе сравнения не установлено зависимости концентраций белка от результативности программ ЭКО. Поскольку данный белок синтезируется преимущественно печенью [8] и является маркером селективности экссудации [10], можно предположить, что при ХЭ увеличена проницаемость сосудистой стенки, способствующая проникновению высокомолекулярных белков из крови в содержимое полости матки. Это свидетельствует о сохранении проявлений вялотекущего воспаления в эндометрии, препятствующих имплантации эмбриона.
Данное предположение подтверждается результатами изучения содержания низкомолекулярного АЛБ венозного происхождения в смывах: выявлено статистически значимое повышение как в группе сравнения, так и при ХЭ по сравнению с контролем с достоверными различиями между группами пациенток. Максимально высокие значения определялись в маточных смывах при ХЭ и отрицательном результате ЭКО.
Заключение
Таким образом, у женщин с бесплодием трубно-перитонеального генеза вне зависимости от наличия ХЭ наблюдается локальный (внутриматочный) дефицит антибактериального ЛФ, участвующего в физиологическом оплодотворении и определяющего устойчивость слизистых оболочек к бактериальной и вирусной инвазии с сопутствующим воспалением. Наличие ХЭ у женщин, вступающих в программу ЭКО, не сопровождается выраженными клиническими проявлениями либо достоверными изменениями белкового профиля венозной крови, но отличается значительными изменениями белкового состава внутриматочного содержимого. Повышение уровня АЛБ и α2-МГ в маточных смывах свидетельствует о локальном вялотекущем воспалительном процессе, приводящем к неизбирательной экссудации высоко- и низкомолекулярных белков из тока крови. Подобные изменения сопровождают функциональные нарушения эндометрия – максимальные концентраций данных белков выявлены при нерезультативных программах ЭКО. Мы полагаем, что анализ маточных смывов на содержание ЛФ, α2-МГ, АЛБ у женщин с бесплодием до вступления в программы ЭКО позволит прогнозировать исходы программы ЭКО и повышать ее результативность за счет обоснованного проведения дополнительных курсов противовоспалительной терапии у женщин с выраженными локальными изменениями белкового профиля.



