Получение адекватного количества высококачественных ооцитов – главная цель стимуляции функции яичников, являющейся одним из этапов программ вспомогательных репродуктивных технологий (ВРТ) [1]. Отсутствие адекватного ответа на стандартные протоколы стимуляции суперовуляции называется «бедным» овариальным ответом (БОО) [2]. В зависимости от различий в определении БОО доля женщин с этим состоянием составляет от 5,6 до 35,1% в общей популяции бесплодных пар, проходящих лечение бесплодия методами ВРТ [3–4].
БОО может быть обусловлен системными заболеваниями, генетическими факторами, ятрогенными причинами, такими как хирургические вмешательства на яичниках и химиотерапия [5]. Доказанными факторами риска являются поздний репродуктивный возраст, эндометриоз и ожирение [6]. Также БОО может быть проявлением преждевременной недостаточности яичников (ПНЯ) у женщин моложе 40 лет. При этом БОО может развиваться на фоне как сниженного, так и нормального овариального резерва (скрытая форма ПНЯ). Предполагаемыми патогенетическими факторами развития БОО у этих женщин могут быть различные аутоиммунные нарушения [2].
До половины случаев ПНЯ ассоциируются с аутоиммунными реакциями в тканях яичника [7]. При этом отмечается высокая распространенность (в 30–67% случаев) антиовариальных антител (АОА) и других органо- и неорганоспецифических аутоантител [8]. Поскольку распространенность АОА у пациенток с БОО и ПНЯ сопоставима, было предложено считать БОО ранним этапом развития аутоиммунной формы ПНЯ [7].
Повреждение тканей яичников могут вызывать различные виды АОА: антитела к блестящей оболочке ооцита, антитела к фолликулостимулирующему гормону (ФСГ), антитела к стероид-продуцирующей ткани яичника. Появление антител к блестящей оболочке ооцита может привести к нарушению развития фолликула и созревания яйцеклетки [9]. Они часто определяются в сыворотке женщин с ПНЯ и бесплодием [10]. Другой мишенью аутоантител могут стать гонадотропины и их рецепторы. Антитела к лютеинизирующему гормону (ЛГ) были выявлены у 30% пациенток в программах ВРТ и у 50% бесплодных пациенток с эндометриозом [11]. Многие исследователи отмечают важное значение титра антител к ФСГ в развитии БОО, однако механизмы участия антител в патогенезе БОО до сих пор не установлены. Высокий титр этих антител негативно влияет на эффективность стимуляции суперовуляции, снижает количество растущих фолликулов и число полученных зрелых ооцитов [12].
Несмотря на то что выявление антител к тканям яичников и гонадотропинам может служить маркером БОО в программах ВРТ, проведено недостаточно исследований по изучению антител у пациенток с бесплодием, а результаты их противоречивы. Исследования в основном касаются изучения роли различных аутоиммунных антител в развитии клинически выраженной формы ПНЯ, и лишь в некоторых из них изучается БОО как вариант скрытой формы ПНЯ.
В связи с этим целью настоящего исследования явилось определение связи между выявлением различных видов аутоантител, включая антитела к ткани яичников, и снижением овариального ответа в программах ВРТ.
Материал и методы исследования
В проспективное когортное исследование были включены пациентки в возрасте от 20 до 40 лет с нормальным кариотипом, без выраженной экстрагенитальной патологии, пороков развития гениталий, операций на яичниках, химио- или лучевой терапии в анамнезе, а также противопоказаний к проведению ВРТ.
 Всем пациенткам была проведена стимуляция суперовуляции по единому протоколу с применением рекомбинантного ФСГ и антагонистов гонадотропин-рилизинг гормона. Доза ФСГ подбиралась индивидуально в зависимости от ответа яичников на стимуляцию овуляции. Максимально вводимая доза ФСГ составляла 250 МЕ/сутки. Согласно критериям ESHRE (2011 г.) была сформирована группа из 65 пациенток с БОО [13]. При этом БОО был диагностирован в случае созревания менее 3 фолликулов при стимуляции овуляции большими дозами гонадотропинов и наличия БОО в анамнезе или наличия сниженного овариального резерва (количество антральных фолликулов менее 5–7, уровень антимюллерова гормона (АМГ) менее 0,5 нг/мл). Группу сравнения составили 85 пациенток с нормальным овариальным ответом. Все пациентки подписали информированное согласие на участие в исследовании.
Всем пациенткам была проведена стимуляция суперовуляции по единому протоколу с применением рекомбинантного ФСГ и антагонистов гонадотропин-рилизинг гормона. Доза ФСГ подбиралась индивидуально в зависимости от ответа яичников на стимуляцию овуляции. Максимально вводимая доза ФСГ составляла 250 МЕ/сутки. Согласно критериям ESHRE (2011 г.) была сформирована группа из 65 пациенток с БОО [13]. При этом БОО был диагностирован в случае созревания менее 3 фолликулов при стимуляции овуляции большими дозами гонадотропинов и наличия БОО в анамнезе или наличия сниженного овариального резерва (количество антральных фолликулов менее 5–7, уровень антимюллерова гормона (АМГ) менее 0,5 нг/мл). Группу сравнения составили 85 пациенток с нормальным овариальным ответом. Все пациентки подписали информированное согласие на участие в исследовании.
Перед включением в протокол экстракорпорального оплодотворения (ЭКО) пациентки были обследованы согласно приказу Минздрава Российской Федерации от 30.08.2012 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» [14]. Помимо обязательного обследования пациенткам проводилось определение различных видов аутоантител методом иммуноферментного анализа (ИФА) в сыворотке крови. Определялись классы антител IgM и IgG к блестящей оболочке (анти-ZP), общие антиовариальные антитела (АОА) (фирма Bioserv Diagnostics, Германия), антикардиолипиновые антитела (АКЛ), антитела к β2-гликопротеину-1 (анти-β2-ГП) (фирма Orgentec Diagnostica, Германия), к ФСГ (анти-ФСГ), к гонадотропин-рилизинг гормону (анти-ГнРГ), антитела к хорионическому гонадотропину (анти-ХГ). У пациенток с БОО проводилось также определение аутоантител в фолликулярной жидкости методом ИФА: общие АОА IgA и IgG, анти-ZP IgA и IgG, анти-ФСГ IgA и IgG, анти-ГнРГ IgA и IgG, анти-ХГ IgA, IgM и IgG, АКЛ IgG, анти-β2-ГП IgG.
Триггер овуляции вводился при наличии в яичниках фолликулов диаметром ≥17 мм (в качестве триггера использовался человеческий хорионический гонадотропин в дозе 7500–10 000 МЕ), через 36 ч осуществлялась трансвагинальная пункция (ТВП) яичников. Через 48 ч после ТВП производилась оценка дробления полученных эмбрионов. Эмбрионы классифицировались согласно их морфологической оценке на 4 группы: А – отсутствие фрагментации, В – <25% фрагментации, С – 25–50% фрагментации и D – более 50% фрагментации. Перенос эмбрионов (ПЭ) в полость матки осуществлялся на 3–5-й день после ТВП.
Поддержка лютеиновой фазы индуцированного цикла у всех пациенток проводилась по стандартному протоколу с назначением натурального микронизированного прогестерона интравагинально в дозе 600 мг/день после ТВП.
Для статистического анализа использовался пакет статистических программ STATISTICA10 (США). Расчет объема выборки был основан на данных литературы о вероятности развития БОО при наличии аутоиммунной патологии (выявлении АОА и/или антител к ФСГ) [12]. Для получения валидных данных при принятии уровня альфа 0,05, уровня достоверности исследования 90%, частоты 1=31,3%, частоты 2=9,1%, с учетом возможного 15% выбывания пациенток из исследования достаточно включения 75 пациенток в каждую группу, всего – 150 пациенток.
Первичной конечной точкой были средние значения уровней различных антител в группах пациенток с «бедным» и нормальным овариальным ответом в зависимости от наличия или отсутствия сниженного овариального резерва. Вторичными конечными точками были: скорректированное отношение шансов (ОШкор) наступления беременности и самопроизвольного прерывания беременности в первом триместре в группах сравнения в зависимости от уровня аутоантител, корреляционная зависимость между уровнями различных аутоантител и овариальным ответом, уровнем АМГ, числом полученных фолликулов и ооцитов.
Имплантация (биохимическая беременность) диагностировалась через 2 недели после ПЭ по повышению уровня β-хорионического гонадотропина человека (β-ХГЧ) выше порогового. Клиническая беременность диагностировалась на основе повышения уровня β-ХГЧ и визуализации плодного яйца при ультразвуковом исследовании через 3 недели после ПЭ.
Статистический анализ проводился с применением χ2-теста для сравнения частотных показателей в 2 и более группах, t-теста и теста Уилкоксона для сравнения непрерывных величин в 2 группах, теста Крускала–Уоллиса для сравнения непрерывных величин в 3 группах, а также многофакторного регрессионного анализа (логистической регрессии) для расчета отношения шансов исходов программ ВРТ и построения ROC-кривой. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Исследование было одобрено комиссией по этике ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России.
Результаты исследования
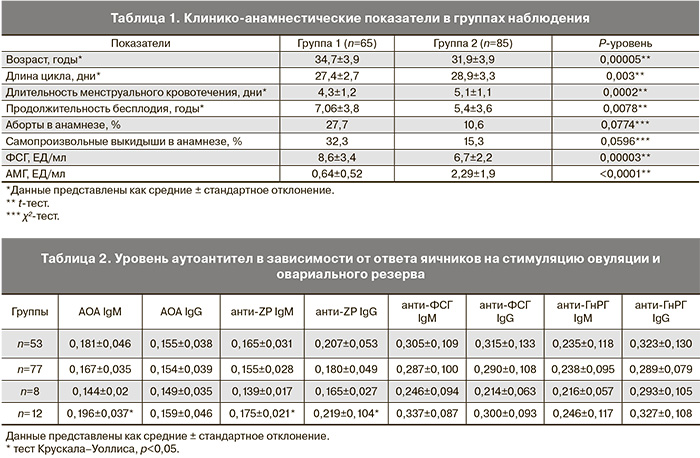
В исследование были включены 150 бесплодных супружеских пар, среди которых у 65 женщин был диагностирован БОО на стимуляцию суперовуляции, у 85 женщин был нормальный овариальный ответ. При анализе клинико-анамнестических данных как возможных конфаундеров группы не отличались статистически значимо по соматической и гинекологической заболеваемости и акушерскому анамнезу. Возраст пациенток был значимо больше с группе БОО и составил 34,7±3,9 года по сравнению с 31,9±3,9 года в группе сравнения (р=0,00005). Также у женщин основной группы отмечалась более короткая длина менструального цикла и более короткая продолжительность менструальных кровотечений. Продолжительность бесплодия была более длительная у женщин с БОО и составила 7,06±3,8 года по сравнению с 5,4±3,7 года у женщин с нормальным ответом (р=0,0078).
Перед включением в программу ЭКО пары были обследованы согласно протоколу. Основные лабораторные показатели также не отличались значимо в группах сравнения. При этом отмечался более высокий уровень ФСГ и низкий уровень АМГ в группе БОО (табл. 1). Также у пациенток основной группы в большинстве случаев отмечался сниженный овариальный резерв (у 53 из 65 пациенток) по сравнению с группой сравнения (у 8 из 85 женщин) (ОШ=42,5; 95% ДИ=14,9; 125,9).
У всех включенных в исследование женщин в момент пункции фолликулов была произведена оценка уровня различных видов и классов аутоантител методом ИФА в плазме крови. Отмечалось статистически значимое отличие уровня общих АОА IgM, анти-ZP IgM и IgG, анти-ГнРГ IgG и анти-β2-ГП-1 IgG, которые были выше у женщин с БОО (p<0,05) (рис. 1). Другие виды аутоантител хотя и были выше в группе женщин с БОО, но не статистически значимо. В целом, в когорте наблюдаемых женщин была выявлена отрицательная корреляционная связь между уровнем анти-ZP и числом полученных фолликулов и ооцитов (r=-0,19, р=0,02), и уровнем антител к β2-ГП-1 IgG и числом полученных фолликулов и ооцитов (r=-0,16, р=0,042).
 У женщин с БОО и нормальным овариальным резервом (n=12) наблюдались более высокие уровни антител по сравнению с пациентками с БОО и сниженным овариальным резервом (n=53), нормальным ответом и нормальным овариальным резервом (n=77) и нормальным ответом и сниженным резервом яичников (n=8) (табл. 2).
У женщин с БОО и нормальным овариальным резервом (n=12) наблюдались более высокие уровни антител по сравнению с пациентками с БОО и сниженным овариальным резервом (n=53), нормальным ответом и нормальным овариальным резервом (n=77) и нормальным ответом и сниженным резервом яичников (n=8) (табл. 2).
Отмечалась значимая корреляционная зависимость между уровнями анти-ZP IgG и анти-ФСГ IgG в крови и фолликулярной жидкости (r=0,3929 и r=0,4695 соответственно, p<0,05). Между уровнями других аутоантител в сыворотке и фолликулярной жидкости значительной корреляции не было выявлено.
Пациентки 2 групп отличались по среднему числу созревших фолликулов (1,9±0,3 и 7,9±3,1; p<0,0001) и полученных ооцитов (1,7±0,6 и 6,2±2,5; p<0,0001).
Было получено 86 зрелых ооцитов в группе с БОО и 434 ооцита в группе сравнения (p<0,0001). Все ооциты были оплодотворены, из них было получено 450 эмбрионов: 81 эмбрион в группе БОО (в среднем 1,2±0,8 эмбриона на 1 пару) и 369 эмбрионов в группе с нормальным ответом яичников (в среднем 4,3±2,6 эмбриона на 1 пару) (p<0,0001). Наблюдалась статистически значимая отрицательная корреляция между уровнем анти-ZP IgM и числом полученных эмбрионов (r=-0,16, р=0,047). В основном все полученные эмбрионы были хорошего качества (А и В): 95 и 97% в группах сравнения соответственно. В каждом цикле проводился перенос двух эмбрионов сходного качества.
На 14–15-й день после переноса в 49 случаях была диагностирована биохимическая беременность: 15 в группе БОО (23,1%) и 34 в группе сравнения (40,0%) (р=0,0285). Клинически были диагностированы 43 беременности: 12 – в группе БОО (18,5%), 31 – в группе нормального ответа яичников (36,5%) (р=0,0156). ОШгр наступления беременности составила 2,53, 95% ДИ=1,17; 5,49. С учетом выявленных конфаундеров (возраст, характер менструального цикла, длительность бесплодия, уровни ФСГ и АМГ, число полученных ооцитов и эмбрионов) ОШкор наступления беременности составила 1,48, 95% ДИ=0,57; 3,85.
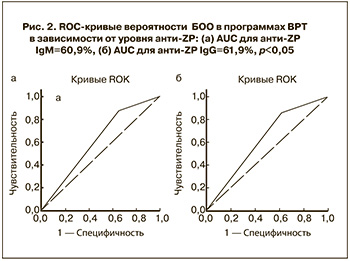
С помощью регрессионного анализа с построением ROC-кривых нами был определен пороговый уровень анти-Zp при развитии БОО, который составил для IgM 0,140 ед. ОП, для IgG 0,152 ед. ОП. При построении ROC-кривой для анти-Zp IgM чувствительность модели составила 87,7%, специфичность – 65,9%, площадь под кривой (AUC) – 60,9%. При построении ROC-кривой для анти-Zp IgG чувствительность модели составила 86,2%, специфичность – 62,4%, площадь под кривой (AUC) – 61,9% (рис. 2).
Обсуждение
БОО отмечается в 9–24% циклов ВРТ [2], приводит к снижению количества полученных ооцитов, отмене циклов ЭКО и к значительному уменьшению вероятности наступления беременности. В нашем исследовании шансы наступления беременности были в 2,5 раза ниже у женщин с БОО. Однако при проведении многофакторного анализа с учетом таких конфаундеров, как возраст, длительность бесплодия, уровень ФСГ и АМГ, число полученных ооцитов и эмбрионов шансы наступления беременности у женщин с БОО соответствовали таковым в группе сравнения, что объясняется определяющей ролью выявленных факторов в успехе наступления беременности в программах ВРТ.
Одной из причин БОО у женщин как со снижением, так и без снижения овариального резерва может быть поражение тканей яичника различными аутоиммунными антителами. Согласно данным J. Horejsi и соавт. (2000) вероятность выявления АОА значительно выше у пациенток с БОО, а также у пациенток с низким уровнем фертилизации ооцитов (40% и 50% соответственно) [15]. По мнению K.R. Pogacnik и соавт. (2014) АОА играют решающую роль в неэффективности программ ВРТ и обнаруживаются у 20–30% пациенток с ПНЯ [16]. Их наличие свидетельствует об иммунном повреждении ткани яичника [16–18]. В нашем исследовании был выявлен статистически значимо более высокий уровень общих АОА класса IgM, а также антител к ZP классов IgM и IgG у женщин с БОО (p<0,05).
На сегодняшний день в литературе имеется мало данных по оценке роли антител разных классов к блестящей оболочке ооцитов в развитии ответа яичников на стимуляцию овуляции и генезе БОО. Установлено, что блестящая оболочка, представляющая собой внеклеточный матрикс, окружающий ооциты, играет важнейшую роль в процессе фолликулогенеза и имплантации [19]. Анти-ZP могут вызвать повреждение ткани яичников с формированием аутоиммунного оофорита, нарушение развития фолликула и созревания яйцеклетки [10]. В своей работе Koyama и соавт. (2005) показали важную роль анти-ZP в генезе ПНЯ и нарушений процесса оплодотворения [10]. Анти-ZP наиболее часто определяются в крови и фолликулярной жидкости пациенток с 2 и более неудачными попытками ЭКО, и при эндометриозе [20]. В нашем исследовании наблюдалась статистически значимая отрицательная корреляционная связь между уровнем анти-ZP IgM и числом полученных эмбрионов.
Следует отметить, что у наблюдаемых пациенток 75-й перцентиль распределения АОА не превышал порог референсного значения. При этом и среднее значение, и медиана были значимо выше у пациенток с БОО. Хотя средние уровни АОА в обеих группах были ниже порога референсного значения, в группе с БОО средний уровень АОА был значительно выше, чем в группе сравнения. Пороговые значения уровня анти- ZP, определенные с помощью регрессионного анализа с построением ROC-кривых, также были значительно ниже принятых референсных значений. По-видимому, для повышения эффективности диагностики аутоиммунных поражений яичников необходимо проведение дополнительных исследований на большом клиническом материале с уточнением референсных значений для АОА и анти-ZP.
Многими исследователями изучалась патофизиологическая роль антител к гонадотропинам в генезе ПНЯ и «бедного» овариального ответа [7, 11–12]. Одной из причин появления этих антител в программах ВРТ может быть иммунизация организма женщины экзогенно вводимыми гонадотропинами [21]. В современной литературе отсутствуют данные по изучению взаимосвязи между антителами к ГнРГ и БОО. Однако широко обсуждается роль антител к ФСГ разных классов в развитии ПНЯ и БОО. По данным K. Haller и соавт. (2008) существует обратная корреляция между уровнем антител к ФСГ класса IgG и IgA в день ТВП яичников и количеством полученных ооцитов. Высокий титр этих антител приводит к неэффективности программ ВРТ, снижая количество растущих фолликулов и число полученных зрелых ооцитов [12]. Кроме аутоиммунной агрессии к ткани яичника анти-ФСГ антитела могут влиять на биологическую активность экзогенного или эндогенного ФСГ [22]. Антитела к ФСГ могут нарушать связывание гормона с рецептором, так как большая их часть направлена против участка полипептидной цепи (78–93) β-субъединицы гормона, который играет ключевую роль во взаимодействии гормона с рецептором [23]. По полученным нами данным у женщин с БОО был выявлен статистически значимо более высокий уровень IgG анти-ГнРГ антител (p<0,05) и более высокий уровень антител к ФСГ, чем в группе сравнения. Учитывая данные зарубежных авторов, возможно, отсутствие значимых результатов по анти-ФСГ антителам связано с недостаточно большими группами пациенток.
В нашем исследовании мы показали повышение уровня анти-β2-ГП-1 IgG у пациенток с БОО. Роль антифосфолипидных антител (АФА), в том числе анти-β2-ГП-1, хорошо изучена в генезе привычного невынашивания беременности, широко обсуждается их значение при ПНЯ и бесплодии неясного генеза [24]. Неудачные циклы ЭКО, по мнению некоторых авторов, могут быть связаны с действием АФА [25–26]. Это объясняется негативным влиянием АФА на процессы имплантации [27–28]. Однако согласно данным, полученным Matsubayashi и соавт. (2006), АФА класса IgG являются проявлением генерализованной активации иммунной системы и могут вызывать непосредственное повреждение ооцита и эмбриона [29]. Повышение уровня антител анти-β2-ГП-1 у пациенток в группе с БОО свидетельствует о том, что в развитии этой патологии важное значение имеет не только наличие специфических АОА, но и общая активация иммунной системы.
В нашем исследовании мы проводили определение аутоантител в крови и фолликулярной жидкости пациенток с целью определения возможных корреляционных связей между ними. Согласно данным зарубежных авторов аутоантитела к ткани яичника определяются не только в крови пациенток с ПНЯ и БОО, но и в фолликулярной жидкости, и между ними существует прямая корреляционная зависимость. Так, по результатам J. Horejsi и соавт. (2000) и J. Luborsky и соавт. (2002), антиооцитарные антитела были обнаружены в крови и фолликулярной жидкости пациенток в программах ВРТ. Частота выявления этих антител была значительно выше у пациенток с БОО [15, 30]. Антитела к ФСГ могут поступать из крови в фолликулярную жидкость. Уровни антител к ФСГ классов G и A в фолликулярной жидкости коррелируют с их уровнем в сыворотке крови [12]. Уровни анти-ZP возрастают в крови и фолликулярной жидкости у пациенток с ПНЯ и неудачными попытками ЭКО [31]. По мнению Matsubayashi и соавт. (2006), уровень IgG АФА коррелирует в крови и фолликулярной жидкости пациенток, страдающих ПНЯ [29]. В нашем исследовании значимая корреляционная зависимость была определена между уровнями анти-ZP IgG и анти-ФСГ IgG (r=0,3929 и r=0,4695 соответственно, p<0,05). Корреляционной зависимости между другими аутоантителами выявить не удалось, что, вероятно, объясняется недостаточным количеством образцов фолликулярной жидкости, в которой производилось определение антител.
У пациенток с БОО преимущественно отмечается сниженный овариальный резерв, что подтверждается сниженным уровнем АМГ и числом антральных фолликулов, и повышенным уровнем ФСГ [32]. В нашем исследовании у 18,5% женщин с БОО определялся нормальный овариальный резерв. Именно у этих пациенток наблюдались наиболее высокие уровни аутоантител, что может свидетельствовать о ранней фазе аутоиммунного поражения яичников. Наши данные подтверждаются данными других исследователей, которыми было продемонстрировано появление АОА в сыворотке крови за несколько лет до появления симптомов ПНЯ, что характеризует раннюю фазу аутоиммунного поражения яичников [33]. Мы согласны с данными Forges и соавт. (2004) о том, что определение АОА может иметь значение для прогноза исхода лечения бесплодия методом ЭКО [34].
По данным литературы, АОА обнаруживаются в сыворотке крови пациенток с бесплодием неясного генеза в 1/3 случаев [30]. Количество этих антител коррелирует с уровнем ФСГ и АМГ, и поэтому эти антитела могут рассматриваться в качестве маркеров аутоиммунного поражения яичников, предсказывая будущее угасание функции яичников у женщин с необъяснимым бесплодием.
Таким образом, антитела, вызывающие повреждение тканей яичников, могут играть важную роль в развитии ПНЯ, одним из клинических проявлений которой является БОО на стимуляцию овуляции в программах ВРТ, и рассматриваться как возможные факторы риска развития данных состояний.



