Эндометриоз – процесс, при котором за пределами полости матки происходит доброкачественное разрастание ткани, по морфологическим и функциональным свойствам подобной эндометрию [1].
В структуре гинекологической заболеваемости эндометриоз занимает 3-е место после воспалительных заболеваний и миомы матки, приводя к значительным нарушениям репродуктивной функции, стойкому болевому синдрому (71–87%) и бесплодию (21–47%). Эндометриоз поражает 10% женщин репродуктивного возраста и 35–50% женщин с тазовой болью и бесплодием [1–3].
Причины развития эндометриоза до настоящего времени неизвестны, однако предполагается, что важную роль играют многочисленные факторы окружающей среды и наследственные факторы [4, 5].
На основании изучения 3096 близнецов наследуемость эндометриоза (пропорция наличия болезни к наследственным факторам) была оценена в пределах 52% [5].
Проведенные исследования по полногеномному поиску ассоциаций (англ. GWAS, Genome-Wide Association Studies) позволили определить некоторые однонуклеотидные полиморфизмы (SNPs, Single nucleotide polymorphism), связанные с предрасположенностью к развитию заболевания [6].
Проведено четыре GWAS-исследования: два GWAS были опубликованы в 2010 г. на данных по японской популяции [7, 8]; GWAS на женщинах Европы было проведено в 2011 г. Международным Консорциумом EndoGene, в него также вошли данные по населению Австралии и Великобритании с независимым анализом аналогичных данных по американской популяции [9]; американское GWAS было проведено на женщинах европеоидной расы и опубликовано в 2013 г. [10].
В 2014 г. был проведен метаанализ, основанный на четырех GWAS-исследованиях и включивший 11 506 женщин с эндометриозом и 32 678 здоровых женщин как группу контроля; исследование было выполнено на женщинах европейской (Австралия, Бельгия, Италия, Великобритания и США) и японской популяций. Найдено 9 локусов связанных с развитием эндометриоза, из которых шесть (rs7521902, rs1270667, rs13394619, rs7739264, rs1537377 и rs10859871) определялись при заболевании наиболее часто [5, 6]: rs7521902 расположенный вблизи WNT4, rs1270667 на 7p15.2, rs13394619 в эстроген-зависимом регуляторе роста рака груди 1 (GREB1, Growth regulation by estrogen in breast cancer 1), rs7739264 около ингибитора ДНК-связывания 4 (ID4, Inhibitor of DNA binding 4), rs1537377 около антисмысловой РНК ингибитора 2В циклин-зависимой киназы (CDKN2B-AS1, Cyclin-dependent kinase inhibitor 2B antisense RNA) и rs10859871 рядом с vezatin (VEZT). Два других (rs1250248 и rs4141819) показали отчетливую пограничную взаимосвязь с наиболее тяжелыми стадиями заболевания (III-IV стадия) [5, 6]: rs1250248 в фибронектине 1 (FN1, fibronectin1) и rs4141819 на 2p14.
Другие исследования [5, 6, 11] подтвердили статистически значимую взаимосвязь развития эндометриоза и rs10859871, расположенного близко к гену VEZT, в сравнении с общей популяцией с лапароскопически подтвержденным контролем. Подобные достоверные данные по взаимосвязи эндометриоза и rs10859871 были получены для шотландской популяции [6].
По данным других исследований, rs4703908, расположенный близко к гену ZNF366, обеспечил более высокий риск эндометриоидных кист яичников и глубокого инфильтративного эндометриоза, особенно с вовлечением кишечника [12]. Фенотипические различия между формами наружного генитального эндометриоза (эндометриоидные кисты яичников, глубокий инфильтративный эндометриоз и эндометриоз брюшины малого таза) связаны с их откликом на различные половые гормоны.
В настоящее время отсутствуют данные по частоте встречаемости наиболее характерных для эндометриоза SNPs среди женщин с различными формами наружного генитального эндометриоза (НГЭ) в российской популяции. Исследование генетических наследственных факторов, связанных с предрасположенностью к различным формам эндометриоза может помочь сократить время на диагностику, особенно в случаях тяжелых «семейных» форм данного заболевания [12].
Цель исследования: определить частоту встречаемости rs10859871 и rs4703908 среди женщин с различными формами НГЭ (эндометриоидные кисты яичников, глубокий инфильтративный эндометриоз и эндометриоз брюшины малого таза) в российской популяции.
Материал и методы исследования
В исследование включены 218 пациенток репродуктивного возраста находившихся на лечении в отделении оперативной гинекологии ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в 2015–2016 гг. Перед включением в исследование все женщины ознакомились, датировали и подписали информированное согласие в 2 экземплярах. Протокол исследования был одобрен этическим комитетом.
Всем пациенткам было проведено полное клинико-анамнестическое обследование: сбор анамнеза, общий и гинекологический осмотр, ультразвуковое исследование (УЗИ) органов малого таза, клинико-лабораторное обследование. Эндоскопическую операцию проводили по стандартизированной методике с помощью эндовидеохирургического оборудования фирмы Karl Storz (Германия). Во время операции осматривали органы брюшной полости и малого таза, при обнаружении эндометриоидных кист яичников и/или эндометриоидных очагов оценивали степень распространенности эндометриоза. Стадирование эндометриоза во время лапароскопического оперативного вмешательства производили по пересмотренной в 1996 г. классификации Американского общества репродуктивной медицины (ASRM).
Критерии включения в исследование: женщины в репродуктивном возрасте (18–45 лет); женщины, у которых при лапароскопическом оперативном вмешательстве выявлен НГЭ (эндометриоидные кисты яичников, глубокий инфильтративный эндометриоз, эндометриоз брюшины малого таза), подтвержденный при последующем гистологическом исследовании; женщины, у которых при лапароскопическом оперативном вмешательстве не выявлен НГЭ и в анамнезе не было оперативных вмешательств по поводу НГЭ; подписанное информированное согласие на участие в исследовании.
На основании полученных данных сформированы следующие группы пациенток: 143 женщины с НГЭ (основная группа) и 75 женщин без эндометриоза (группа сравнения). В зависимости от формы НГЭ пациентки были разделены на три подгруппы: 75 женщин с эндометриоидными кистами яичников, 36 женщин с глубоким инфильтративным эндометриозом (ретроцервикальный/ректовагинальный эндометриоз) и 32 женщины с эндометриозом брюшины малого таза. Диагноз НГЭ был установлен на основании интраоперационного и гистологического исследований. Группу сравнения составили 75 женщин, у которых при выполнении лапароскопического исследования не было обнаружено эндометриоза. Это были женщины, поступившие на диагностическое лапароскопическое исследование в связи с бесплодием, а также пациентки с миомой матки, спаечным процессом, параовариальными кистами.
Материалом для исследования аллельного полиморфизма генов были образцы периферической крови пациенток с добавленным в качестве консерванта ЭДТА. Сбор образцов производился непосредственно во время операции. Образцы крови отправлялись в биобанк ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России и замораживались на -70° С для последующего хранения в коллекции.
Выделение ДНК проводили комплектом реагентов «ПРОБА-РАПИД-ГЕНЕТИКА» (ООО «НПО ДНК-Технология»). Метод основан на разрушении лимфоцитов с помощью лизирующего буфера, не влияющего на целостность мембран ядер лимфоцитов. Амплификацию ДНК проводили на приборе ДТпрайм (ООО «ДНК-Технология», Россия). ПЦР-реакция проводилась с праймерами на участки генома rs10859871 и rs4703908:
rs10859871: 5’- ATACAAAAGTCAGCCAGCCAGCC – 3’
5’- CCTGGAACAATGGTGTAACT – 3’
rs4703908: 5’- GGACTGGGGTAGTGCTCCTCAGAA – 3’
5’-GAATGAGCATTTGCATGGAGAGTCA- 3’
Последовательности фрагментов были определены путем секвенирования методом Сенгера на приборе ABI PRISM 3130 (Applied BioSystems, США). Генотипирование аллельных состояний каждого однонуклеотидного полиморфизма проводилось визуально по хроматограммам с помощью программы BioEdit.
Данные по европейской популяции получены по опубликованным результатам Проекта «1000 геномов». Официальные данные данного проекта представлены на сайте: http://www.ensembl.org/index.html.
Статистический анализ полученных данных проводили с применением стандартных методов математико-статистической обработки с использованием пакетов программ прикладного статистического анализа (Statistica for Windows v. 10.0, Office 2003, Microsoft Excel и др.). Для оценки межгрупповых различий значений признаков применяли критерий χ2 Пирсона, t-критерий Стьюдента. Для всех критериев и тестов величину критического уровня значимости принимали равной 0,05, то есть различия признавали статистически значимыми при p<0,05. Оценку соответствия выявленных частот генотипов закону Харди–Вайнберга проводили по критерию χ2 в сравнении с ожидаемыми частотами генотипов равновесного распределения.
Для оценки ассоциаций рассчитывали отношение шансов (OR) по формуле: OR=ad/bc (формула 2), где а – число лиц с наличием анализируемого маркера среди больных; b – его отсутствие среди больных; c и d – число лиц соответственно с наличием и отсутствием маркера в контрольной группе. Величина ОR=1 указывает на отсутствие ассоциации, ОR> 1 – имеет место при положительной ассоциации (фактор риска) и ОR<1 – отрицательная ассоциация аллеля (или генотипа) с заболеванием (протективный фактор). Отношение шансов (OR) приведено с 95% доверительным интервалом (CI). Мы считаем, так же как и другие исследователи [12, 13], что при OR<1,5 ассоциация не достаточно сильна, чтобы рассматривать потенциальное клиническое применение.
Результаты исследования
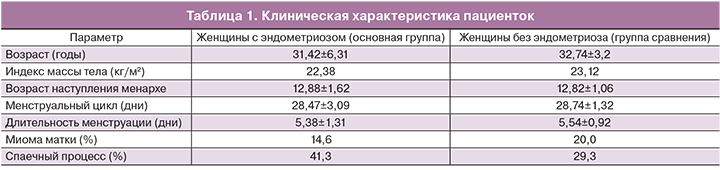
Обследованы 143 пациентки с различными формами НГЭ в возрасте от 18 до 45 лет. Во время оперативного вмешательства у 52,4% пациенток выявлены эндометриоидные кисты яичников, у 25,2% пациенток выявлен глубокий инфильтративный эндометриоз (ретроцервикальный /ректовагинальный эндометриоз) и у 22,4% – эндометриоз брюшины малого таза. Клиническая характеристика пациенток представлена в табл. 1.
Таким образом, возраст пациенток и характеристики менструального цикла в основной группе и группе сравнения достоверно не различались (p<0,05).
Частота встречаемости SNPs (rs10859871 и rs4703908) среди женщин с различными формами НГЭ в российской популяции
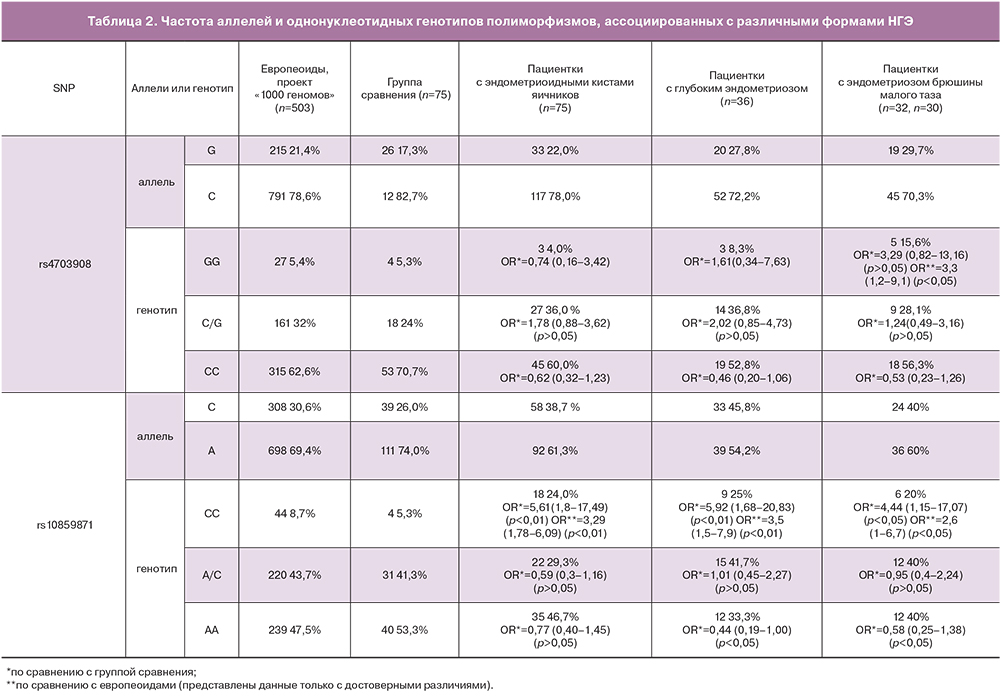
Распределение генотипов для всех полиморфизмов группы сравнения соответствовало ожидаемым частотам генотипов равновесного распределения по закону Харди–Вайнберга. Полученные данные о частотах встречаемости аллелей однонуклеотидных полиморфизмов в генах, способствующих развитию различных форм НГЭ, в группах исследования представлены в табл. 2. Помимо этого в таблице представлены данные о частотах аллелей и генотипов в европейской популяции. Полученные нами данные по частотам аллелей и генотипов в группе сравнения соответствуют данным по Европе.
Частоты встречаемости аллелей и генотипов при различных формах НГЭ сопоставлены с частотами встречаемости в группах сравнения. Выявлена положительная ассоциация гетерозиготного генотипа C/G локуса rs4703908 и риска развития эндометриоидных кист яичников (OR=1,78; 95%CI: 0,88–3,62; p>0,05) и глубокого инфильтративного эндометриоза (OR=2,02; 95% CI: 0,85–4,73; p>0,05). Выявлена положительная ассоциация C/G локуса rs4703908 и риска развития эндометриоза брюшины малого таза (OR=1,24; 95% CI: 0,49–3,16; p>0,05), однако OR не превышало 1,5. Выявлена положительная ассоциация гомозиготного генотипа GG локуса rs4703908 и риска развития эндометриоза брюшины малого таза (OR=3,29; 95% CI: 0,82–13,16; р>0,05) по сравнению с условно здоровыми женщинами основной группы сравнения. Достоверное увеличение частоты встречаемости выявлено только для гомозиготного генотипа GG локуса rs4703908 при сравнении с европеоидами (OR=3,3; 95% CI: 1,2–9,1; р<0,05).
Выявлена положительная ассоциация гомозиготного генотипа СС локуса rs10859871 и риска развития эндометриоидных кист яичников (OR=5,61; 95% CI: 1,8–17,49; р<0,01), глубокого инфильтративного эндометриоза (OR=5,92; 95% CI: 1,68–20,83; p<0,01) и эндометриоза брюшины малого таза (OR=4,44; 95% CI: 1,15–17,07; p<0,05) по сравнению с условно здоровыми женщинами основной группы сравнения. В группах женщин с НГЭ достоверно чаще выявлялся гомозиготный генотип СС локуса rs10859871 при сравнении с европеоидами: эндометриоидные кисты яичников (OR=3,29; 95% CI: 1,78–6,09; p<0,01), глубокий инфильтративный эндометриоз (OR=3,5; 95% CI: 1,5–7,9; р<0,01), эндометриоз брюшины малого таза (OR=2,6; 95% CI: 1–6,7; р<0,05). Отмечается отрицательная ассоциация гомозиготного генотипа АА локуса rs10859871 и риска развития эндометриоидных кист яичников (OR=0,77; 95% CI: 0,40–1,45; p>0,05), глубокого инфильтративного эндометриоза (OR=0,44; 95% CI: 0,19–1,00; p<0,05), эндометриоза брюшины малого таза (OR=0,58; 95% CI: 0,25–1,38; p<0,05).
В группе женщин с НГЭ достоверно чаще отмечен гомозиготный генотип СC локуса rs10859871 по сравнению с условно здоровыми женщинами из группы сравнения и европеоидами (аутосомно-рецессивная модель наследования).
Обсуждение
Полученные нами данные о частотах встречаемости аллелей однонуклеотидных полиморфизмов в генах, ассоциированных с развитием эндометриоза, в группе сравнения соответствуют данным по Европе (р<0,05). Некоторые недостоверные расхождения могут быть связаны со спецификой смешанной российской популяции и спецификой выборки европейской популяции (наличие данных, в том числе по мужчинам и отсутствие строгого отбора по признаку отсутствия НГЭ в европейской популяции). Косвенным показателем достоверности получаемых результатов может служить соответствие распределения частот генотипов полиморфизмов ожидаемым частотам генотипов равновесного распределения по закону Харди–Вайнберга, которое подтверждено в нашем исследовании. Данные по европейской популяции получены по опубликованным результатам Проекта «1000 геномов». Цель данного проекта состояла в обнаружении, генотипировании и обеспечении точной информации по гаплотипам полиморфизмов генома человека в различных популяциях: Европа, Восточная Азия, Южная Азия, Западная Африка и Америка. Официальные данные по реализации данного проекта представлены на сайте: http://www.ensembl.org/index.html.
В проведенном нами исследовании установлено, что гетерозиготный генотип C/G локуса rs4703908 связан с более высоким риском развития эндометриоидных кист яичников (OR=1,78; 95% CI: 0,88–3,62; p>0,05) и глубокого инфильтративного эндометриоза (OR=2,02; 95% CI: 0,85–4,73; p>0,05) в российской популяции. Гетерозиготный генотип C/G локуса rs4703908 связан с более высоким риском развития эндометриоза брюшины малого таза (OR=1,24; 95% CI: 0,49–3,16; p>0,05) по сравнению с группой условно здоровых женщин из контрольной группы. Однако в этом случае OR<1,5, поэтому мы считаем, что ассоциация не достаточно сильна, чтобы предполагать здесь причинно-следственную связь и/или рассматривать потенциальное клиническое применение. Результаты нашего исследования совпадают с данными зарубежных авторов [12], согласно которым rs4703908, расположенный вблизи ZNF366 гена, обеспечивал более высокий риск развития эндометриоидных кист яичников (OR=2,22; 95% CI: 1,26–3,92) и глубокого эндометриоза, особенно с вовлечением кишечника (OR=2,09; 95% CI: 1,12–3,91).
Фенотипические различия между формами наружного генитального эндометриоза (эндометриоидные кисты яичников, глубокий инфильтративный эндометриоз и эндометриоз брюшины малого таза) связаны с их откликом на различные половые гормоны. Эндометриоидные кисты яичников, глубокий инфильтративный эндометриоз и эндометриоз брюшины малого таза по-разному реагируют на прогестерон [14–18], изменения экспрессии некоторых генов [12, 14–16] и различные предрасполагающие факторы, которые могут влиять на одну форму заболевания и не влиять на другие [17, 19]. Rs4703908 связан с заменой G на C и расположен на хромосоме 5 в интронной области вблизи ZNF366 (zinc finger protein 366). ZNF366 играет важную роль в регуляции экспрессии таргетных генов, отвечающих на эстрогены [20]. ZNF366 может быть независимым прогностическим фактором рака груди [12, 21, 22]. ZNF366 также может действовать как опухолевый супрессор при развитии рака молочной железы [12, 23]. Результаты нашего исследования согласуются с данными зарубежных авторов [12] и делают rs4703908 вероятным кандидатным геном для эндометриоза (особенно эндометриоидных кист яичников и глубокого инфильтративного эндометриоза), который является эстроген-зависимым заболеванием. Можно предположить, что эндометриоидные кисты яичников и глубокий инфильтративный эндометриоз являются более эстроген-зависимыми формами заболевания по сравнению с эндометриозом брюшины малого таза, в развитии которого, вероятно, более значительную роль играют другие патогенетические факторы.
В проведенном нами исследовании установлено, что гомозиготный генотип СС локуса rs10859871, расположенный вблизи vezatin (VEZT) гена, обеспечивает более высокий риск развития всех форм НГЭ в российской популяции. Гомозиготный генотип СС локуса rs10859871 обеспечивает более высокий риск развития эндометриоидных кист яичников (OR=5,61; 95% CI: 1,8–17,49; р<0,01), глубокого инфильтративного эндометриоза (OR=5,92; 95% CI: 1,68–20,83; p<0,01) и эндометриоза брюшины малого таза (OR=4,44; 95% CI: 1,15–17,07; p<0,05). Мы нашли достоверное увеличение частоты встречаемости гомозиготного СС генотипа rs10859871 по сравнению с европеоидами: эндометриоидные кисты яичников (OR=3,29; 95% CI: 1,78-6,09; p<0,01), глубокий инфильтративный эндометриоз (OR=3,5; 95% CI: 1,5–7,9; р<0,01), эндометриоз брюшины малого таза (OR=2,6; 95% CI: 1–6,7; р<0,05). Значения OR для rs10859871 выше 1,5, это значит, что ассоциация достаточно сильна и можно предполагать причинно-следственные отношения и/или рассматривать потенциальное клиническое применение. В нашем исследовании гомозиготный генотип АА локуса rs10859871 выполняет протективную роль и снижает риск развития эндометриоидных кист яичников (OR=0,77; 95% CI: 0,40–1,45; p>0,05), глубокого инфильтративного эндометриоза (OR=0,44; 95% CI: 0,19–1,00; p<0,05), эндометриоза брюшины малого таза (OR=0,58; 95% CI: 0,25–1,38; p<0,05).
Наши результаты совпадают с данными GWAS-исследований [6, 24], согласно которым был идентифицирован локус в 12q22 около VEZT – rs10859871, ассоциированный с развитием эндометриоза. По данным метаанализа и повторного GWAS-исследования было найдено 9 локусов связанных с развитием заболевания, из которых шесть (rs7521902, rs1270667, rs13394619, rs7739264, rs1537377 и rs10859871), в том числе rs10859871, определялись при эндометриозе наиболее часто [6].
Наши данные соответствуют результатам ряда других зарубежных исследований [6, 11], согласно которым найдена статистически значимая взаимосвязь развития эндометриоза с rs10859871 в сравнении с общей популяцией (OR=1,43; 95% CI: 1,20–1,71; р=6,9×10(-5)) и лапароскопически подтвержденным контролем (OR=1,58; 95% CI: 1,24–2,02; р=2,1×10(-4)).
Локус VEZT кодирует трансмембранный белок VEZT, который был идентифицирован как компонент Е-кадгерин-катенинового комплекса адгезивных соединений [6]. Белок показал важную роль в генерации адгезивных сил, необходимых для изменений клеточной формы и/или движений во время эмбриогенеза [6, 25]. Предположительно, отсутствие VEZT приводит к нестабильному взаимодействию между E-кадгерин-катениновым комплексом и актиновым цитоскелетом в адгезивном соединении. Либо VEZT может входить в ядро клетки, регулируя экспрессию таргетных генов, которые модулируют клеточную адгезию или инвазию [25]. Позже было установлено, что VEZT действует как предполагаемый ген-супрессор опухолевого роста, поражая клеточную миграцию и инвазию [26]. Экспрессия определенных молекул адгезии, таких как интегрины и кадгерины, наблюдалась в эутопическом и эктопическом эндометрии от женщин с эндометриозом [6]. Миграция-адгезия-инвазия – фундаментальные патологические процессы эндометриоза. Эндометриальные клетки, которые при ретроградной менструации попадают в брюшную полость, для выживания в условиях гипоксии должны непрерывно экспрессировать молекулы, вовлеченные в процессы миграции, адгезии и инвазии, приводя к развитию эндометриоидных очагов [14, 15]. В microarray-исследовании обнаружили повышение экспрессии 2255 и снижение экспрессии 408 генов в эктопических эндометриоидных очагах по сравнению с эутопическим эндометрием от женщин с эндометриозом [15, 16, 27]. Эти гены (differentially expressed genes – DEGs) были преимущественно связаны с фокальной адгезией (например, FN1, EGF, FYN, EGFR, RAC1, CCND1 и JUN), регулированием актинового цитоскелета (например, FN1, EGF, EGFR, RAC1 и JUN) и MAPK-сигнальным путем (например, EGF, EGFR, RAC1, JUN, TGFB1 и MYC) [14–16, 27]. В других microarray-исследованиях эутопического эндометрия от женщин с эндометриозом по сравнению с эутопическим эндометрием от женщин без эндометриоза также были выявлены различно экспрессирующиеся гены [14–16, 28, 29]. Путь фокальной адгезии и рибосомальный путь были дисрегулированы при эндометриозе и лежали в основе патогенеза этого заболевания [14–16, 27–29]. Продемонстрировано, что динамика актинового цитослелета, затрагивающая клеточную миграцию, была различно отрегулирована стероидными гормонами у пациентов с эндометриозом и без этого заболевания [30]. Поэтому не удивительно, что ген, отвечающий за адгезивные межклеточные соединения и актиновую динамику, связан с эндометриозом.
Заключение
Гетерозиготный генотип C/G локуса rs4703908, расположенный вблизи ZNF366 гена, связан с повышенным риском развития эндометриоидных кист яичников и глубокого инфильтративного эндометриоза в российской популяции. Гомозиготный генотип СС локуса rs10859871, расположенный вблизи VEZT гена, обеспечивает значительно более высокий риск развития всех форм НГЭ (эндометриоидные кисты яичников, глубокий инфильтративный эндометриоз, эндометриоз брюшины малого таза) в российской популяции (аутосомно-рецессивная модель наследования). Гомозиготный генотип АА локуса rs10859871 выполняет протективную роль и снижает риск развития эндометриоидных кист яичников, глубокого инфильтративного эндометриоза, эндометриоза брюшины малого таза. Результаты нашего исследования делают rs10859871 вероятным кандидатным маркером, тестирование по которому может выявлять повышенную вероятность развития НГЭ у женщин российской популяции.



