Отслойка хориона и плаценты на ранних сроках беременности в общей популяции составляет 3%,
у женщин с привычной потерей беременности может достигать 10–15% [3].
Наличие отслоек сопровождается наружным кровотечением в 71%, бессимптомным течением – в 29% случаев. Если не происходит гибели эмбриона (плода), то в дальнейшем возможно развитие плацентарной недостаточности – в 24% случаев, преждевременных родов – в 16–19%, преэкламсии – в 8%, задержки развития плода – в 7%, дистресс-синдрома у новорожденного – в 19%. Частота кесарева сечения у данного контингента беременных составляет 27% [2].
Существенное значение в процессе инвазии цитотрофобласта играет соотношение фибринолитических и антифибринолитических компонентов системы гемостаза на уровне эндометрия. Процесс регуляции фибринолиза зависит, в первую очередь, от активности активаторов плазминогена тканевого и урокиназного типа (t-PA и u-PA) и от уровня синтеза и секреции ингибиторов активации плазминогена (PAI-1 и PAI-2) [1, 5].
PAI-1 ответственен не только за повышение депозиции фибрина в маточных сосудах и снижение
маточно-плацентарного кровотока, ему принадлежит также важная роль в снижении степени инвазии
трофобласта в ранние сроки беременности. Имеется также связь между ранними преэмбриональными
потерями и уровнем активности PAI-1, что в основном ассоциируется с дефектами имплантации [4].
При подготовке к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания PAI-1, t-PA, u-PА и других протеаз, необходимых для разрушения экстрацеллюлярного
матрикса в процессе имплантации. В условиях гипофибринолиза, в частности связанных с полиморфизмом генов PAI-1, происходит десинхронизация локальных процессов фибринолиза и фибринообразования при имплантации. При этом протеаз, синтезируемых бластоцистой, становится недостаточно для разрушения экстрацеллюлярного матрикса и адекватного внедрения в эндометрий. В связи с этим происходит образование ретрохориальных отслоек в середине I триместра [2].
Ингибитор активатора плазминогена (PAI-1), кодируемый геном SERPINE1, образуется в клетках эндотелия, гепатоцитах, а также в неактивной форме может высвобождаться из тромбоцитов. Концентрация PAI-1 зависит как от внешних (уровень триглицеридов [9], курение [10]), так и внутренних (генетических) факторов. Известен полиморфизм в промоторной области гена SERPINE1,
изменяющий активность гена. Различия в фенотипических проявлениях аллельных вариантов обусловлены тем, что при варианте 5G с промотором гена может связываться как активатор, так и репрессор, а при варианте 4G – только активатор. В результате при варианте 5G ген легко включается
и легко выключается, а при варианте 4G – легко включается, но плохо выключается [7, 8]. Таким образом, полиморфный вариант 4G сопровождается хронически повышенной экспрессией гена и повышением уровня PAI-1 в крови [10]. В результате снижается активность фибринолитической системы.
Согласно литературным источникам, полиморфизм гена SERPINE1 (PAI-1) играет существенную
роль в генезе репродуктивных потерь, в развитии плацентарной недостаточности, сердечно-сосудистых заболеваний [4]. В то же время отсутствуют данные о роли данного полиморфизма в генезе
преждевременной отслойки плаценты или хориона.
Целью исследования являлась оценка роли полиморфизма гена SERPINE1 (PAI-1) при отслойках
хориона и плаценты на ранних сроках беременности.
Материал и методы исследования
Основную группу составили 67 беременных женщин с синдромом привычной потери плода на ранних сроках.
Критериями исключения являлись: многоплодная беременность, наличие иммунологических нарушений и инфекционных состояний, гипергомоцистеинемия, полиморфизм генов V и II факторов.
Контрольную группу составили 53 здоровые первобеременные женщины. Помимо оценки клинико-анамнестических данных проводили динамическое ультразвуковое исследование с использованием
цифрового 512-канального сканера Siemens SonoLine Elegra (Германия) с абдоминальным (3,5 МГц) и
полостным (6,5 МГц) мультичастотными датчиками. Оценивали размеры эмбриона (плода), расположение и особенности строения хориона (плаценты) в соответствии со сроком беременности. При оценке гематом определяли их характер (ретрохориальные, ретроамниотические), объемные размеры, стадии развития.
ДНК для генотипирования выделяли из цельной крови с помощью системы выделения «ПробаГС» (ООО «НПО ДНК-Технология», Россия). Полученные образцы ДНК до типирования хранили при -20 °С. Концентрация ДНК, определенная на ДНК-минифлуориметре (Ноеfer, США), составляла в среднем 50–100 мкг/мл.
Определение генного полиморфизма проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), используя коммерческие тест-системы (ООО «НПО ДНК-Технология», Россия).
Кроме того, у женщин основной группы применяли бактериологические методы (бактериологический посев из цервикального канала, диагностика урогенитальных инфекций методом полимеразной цепной реакции), гормональные, иммунологические (субпопуляционный состав лимфоцитов периферической крови, определение уровня антифосфолипидных антител и антител к хорионическому гонадотропину человека, молекулярно-биологические (HLA II класса), гемостазиологические методы.
Результаты исследования и обсуждение
Средний возраст беременных основной группы составил 31,5±0,9 года. Возраст менархе – 13,4±0,4 года. Менструальная функция: через 29,7±0,4 дня по 5,4±0,2 дня. Паритет составлял от 2 до 4 беременностей, при этом привычная потеря беременности в 30% случаев отмечалась в сроки 7,1±0,6 недели. Роды в анамнезе отмечены у 19 женщин, из них перинатальные потери отмечались у 11. Средний возраст женщин контрольной группы составил 26,7±1,2 года.
У женщин основной группы из соматических заболеваний обращала на себя внимание высокая
частота хронического тонзиллита (42,8%), заболеваний мочевыводящих путей (20,0%), желудочнокишечного тракта (19,3%), сердечно-сосудистой системы (13,3%).
По данным ультразвукового исследования, средние сроки выявления ретрохориальных гематом составляли 8,3±0,4 нед, средняя длительность динамического наблюдения – 2,5±0,2 нед, при этом
в процессе лечения объем гематом уменьшился с 1,32±0,25 до 1,16±0,33 см2 (р>0,05). Средние сроки
выявления ретроамниотических гематом составляли 12,1±0,5 нед, средняя длительность наблюдения –
2,7±0,3 нед, при этом объем гематом уменьшился с 17,7±6,0 до 10,0±3,7 см2 (р>0,05). Сравнительный
анализ показал более позднее возникновение ретроамниотических гематом по сравнению с ретрохориальными на 3–6 нед (р<0,01). Объем ретроамниотических гематом в момент их выявления и в конце лечения был значительно больше ретрохориальных (р<0,01). Это подтверждает высказанное ранее положение о различном происхождении гематом, в том числе приоритетное значение бактериальновирусной инфекции в патогенезе ретроамниотических гематом [2].
Кроме того, при ретрохориальных гематомах гипоплазия хориона встречалась в 4 раза чаще, чем при ретроамниотических (р<0,01), а также несколько чаще отмечалось низкое расположение и предлежание плаценты.
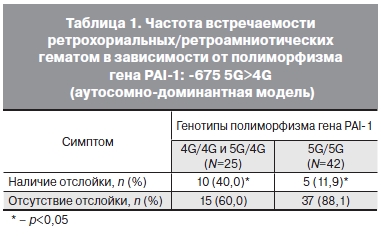
Для решения вопроса о влиянии 4G аллели на образование ретрохориальных/ретроамниотических гематом были рассчитаны частоты образования отслоек в зависимости от генотипа.
Анализ распределения аллельных вариантов полиморфизма гена SERPINE1 (PAI-1) показал, что отслойки хориона и плаценты чаще встречались среди носительниц аллеля 4G чем при генотипе
5G/5G. Данные представлены в табл. 1.
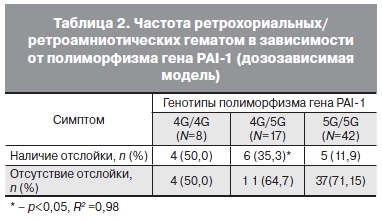
При этом следует отметить, что вероятность развития гематом имела выраженную зависимость от
количества аллелей 4G (табл. 2). При генотипе 4G/4G отслойки встречались в 1,5 раза чаще, чем
при генотипе 5G/4G (р<0,05).
Отношение шансов (ОШ) образования отслоек при носительстве аллеля 4G при гетерозиготном генотипе исследованного полиморфизма (4G/5G) равнялось 4,04 (1,06–15,34, p=0,062). При гомозиготном генотипе (4G/4G) OШ равнялось 7,4 (1,5136,33, р=0,026),
Частота образования ретрохориальных/ретроамниотических гематом «дозозависима» от аллели 4G
(p<0,05, коэффициент достоверности аппроксимации R2=0,98),
По имеющимся литературным данным, подходы к терапии при наличии патологии хориона носят в основном рекомендательный характер, При наличии гематом предлагается использовать препараты прогестеронового ряда, антиагреганты, антикоагулянты, препараты, улучшающие тканевой метаболизм. Отмечается высокая эффективность указанной терапии, которая выражается в уменьшении размеров и организации гематом в течение 1–1,5 нед, нормализации кровотока
в спиральных артериолах и межворсинчатом пространстве [3, 4].
В соответствии с полученными нами ранее результатами, основополагающим при наличии гематом
является назначение селективных антифибринолитиков (транексамовой кислоты) и по показаниям –
антиагрегантов (дипиридамола) и антикоагулянтов (низкомолекулярных гепаринов) [2]. В то же время
показано, что эффект от введение транексамовой кислоты до и после обширных операций различается в зависимости от генотипа SERPINE1: 5G>4G [6].
Особенности течения беременности у женщин с отслойкой хориона (плаценты) в I триместре выражались в угрозе прерывания в 100% случаев, ранний токсикоз отмечался в 3,3%. Во II триместре угроза прерывания встречалась в 53,3%, отслойка плаценты – в 10,0%, анемия – в 6,7%, начальные признаки плацентарной недостаточности – в 13,3%. В III триместре угроза преждевременных родов – в 23,3% случаев, признаки плацентарной недостаточности – в 53,3%, анемия– в 13,3%, умеренная преэкламсия – в 10,0%.
При динамическом анализе показателей системы гемостаза на протяжении беременности развитие
хронической формы синдрома диссеминированного внутрисосудистого свертывания отмечалось в 16,5% случаев.
Анализ исходов беременностей у женщин основной группы показал, что в 3 (4,5%) случаях отмечалась неразвивающаяся беременность в I триместре. Из 64 родивших преждевременные роды в сроках от
32 до 37 недель произошли у 21 (33,8%) женщины, своевременные роды – у 43 (66,2%), Путем операции кесарева сечения при доношенном сроке было родоразрешено 19 (29,7%) беременных, при недоношенном сроке – 16 (25,0%).
Масса тела новорожденных при своевременных родах составила 3491±112 г, длина 51,1±0,6 см. Признаки задержки роста плода среди доношенных имелись у 5 (11,6%) новорожденных. В удовлетворительном состоянии родились 32 (74,4%) ребенка, в состоянии гипоксии средней степени – 3 (7,0%). Масса новорожденных при преждевременных родах составила 2457±351,5 г, длина – 47,9±2,1 см. С признаками задержки роста плода родились 4 (19,0%) ребенка, В удовлетворительном состоянии родились 11 (52,4%) детей, в состоянии легкой гипоксии – 5 (23,8%), в состоянии гипоксии средней степени – 4 (19,0%), в тяжелой гипоксии – 1 (4,8%).
Таким образом, аллель 4G полиморфизма гена SERPINE1 (PAI-1) 5G>4G ассоциирован с развитием отслойки хориона и плаценты в ранние сроки беременности. При этом при генотипе 4G/4G отслойки встречаются в 1,5 раза чаще, чем при генотипе 5G/4G. При наличии в генотипе пациентки аллеля 4G указанного полиморфизма в случае отслойки хориона и плаценты, наряду с общепринятыми методами, рекомендуется использовать селективные антифибринолитики и противотромботическую терапию.



