Терапия активной иммунизации беременных женщин аллогенными лимфоцитами с целью профилактики ранних репродуктивных потерь связана с работами В.И. Говалло и В.М. Сидельниковой [1]. Научный интерес к изучению лимфоцитоиммунотерапии (ЛИТ) с целью профилактики и лечения ранних репродуктивных сохраняется более 30 лет. Нами осуществлен компьютерный поиск оригинальных сообщений по данному вопросу в системе PubMed – национальной медицинской библиотеки США (www.pubmed.com) за период 1984–2015 гг. Найдено около 200 полнотекстовых статей и 5 мета-анализов с результатами исследований по изучению данного вида терапии, отношение к которому в мировом научном сообществе неоднозначное. Ряд исследователей указывает на выраженный протективный эффект [2–6], другие не находят отличий в исходах беременностей [7–13] при проведении иммунизации беременной женщины. Полученные результаты до настоящего времени подвергаются критике [14].
На сегодняшний день доказано, что нарушение иммунологического ответа в период цитотрофобластической инвазии ведет не только к ранним самопроизвольным абортам у пациенток с привычным невынашиванием [15], но и ассоциировано с развитием плацентарной недостаточности и преэклампсии [16–19]. Представляет интерес концепция единства системы иммунитета, гемостаза и фибринолиза, выдвинутая профессором Б.И. Кузником еще в начале восьмидесятых годов прошлого века, согласно которой лейкоциты (лимфоциты и моноциты), макрофаги и эндотелий сосудистой стенки играют важную роль в объединении этих систем, обеспечивая единство гуморально-клеточной системы защиты организма [20]. На современном этапе показано, что провоспалительные цитокины (интерлейкины (IL)-1, IL-6, IL-8, IL-18, фактор некроза опухоли (TNF)-α и др.) тормозят фибринолиз, усиливая синтез и секрецию ингибиторов фибринолиза эндотелиоцитами, лейкоцитами и другими клетками. Противовоспалительные цитокины (IL-4, IL-10, трансформирующий фактор роста (TGF)-β и др.) способствуют активации фибринолиза за счет выделения тканевого и урокиназного активаторов плазминогена и уменьшения секреции ингибиторов этого процесса [21, 22]. В свою очередь, многочисленными исследованиями показано, что реакции фибринолиза (ингибиторы активаторов плазминогена (PAI)-1 и PAI-2, тканевой активатор плазминогена (t-PA) и урокиназа (uPA)) играют ключевую роль в инвазии трофобласта [23–25].
Таким образом, цитотрофобластическая инвазия, являясь ключевым моментом формирования системы мать-плацента-плод, регулируется гормональными, сосудистыми, иммунологическими факторами и факторами системы гемостаза. Оказывая влияние на уровень и соотношение цитокинов, иммуноцитотерапия должна опосредованно воздействовать на реакции фибринолиза, на изучение которых и было направленно наше исследование.
Цель исследования: изучение влияние иммунизации матери аллогенными лимфоцитами на синтез цитокинов (TNF-α, IL-10), фибринолитические реакции (PAI-1, t-PA, плазминоген, время XIIа-зависимого лизиса эуглобулинового сгустка фибрина (XIIа-ЗЛ)) на течение и исходы беременности.
Материал и методы исследования
Согласно поставленной цели на базе клинических подразделений ГБОУ ВПО АГМУ Минздрава РФ с 2012 по 2015 гг. проведено проспективное когортное исследование, включающее 233 женщины. Привычным невынашиванием беременности страдали 142 пациентки, то есть имели две и более репродуктивные потери до 20 недель в анамнезе. Женщины с отягощенным акушерским анамнезом разделены на 2 группы: основная – 69 беременных (31,1±2,8 года), которым наряду с традиционным лечением на предгравидарном этапе и в 1-м триместре беременности назначали ЛИТ и группа сравнения – 73 женщины (32,3±3,1 года), получавших традиционное лечение. Контрольная группа представлена 91 пациенткой (28,7±2,3 года) без отягощенного акушерско-гинекологического анамнеза.
Критерии включения: возраст беременной 18–35 лет; одноплодная прогрессирующая беременность, наступившая в естественном цикле; 2 и более репродуктивные потери в анамнезе до 20 недель, генез не определен; отсутствие аномалии развития внутренних половых органов; отсутствие экстрагенитальных заболеваний в стадии декомпенсации; информированное согласие женщины на проведение ЛИТ.
Критерии исключения: репродуктивные потери в анамнезе инфекционного, эндокринного, генетического генеза; аномалии развития половых органов; многоплодная беременность; беременность, наступившая в результате вспомогательных репродуктивных технологий; экстрагенитальные заболевание в стадии декомпенсации; аутоиммунные заболевания, включая антифосфолипидный синдром; наличие хромосомных аберраций у супругов.
В соответствии с положениями Хельсинской декларации Всемирной медицинской ассоциации, у всех женщин до включения в исследование было получено информированное согласие на проведение ЛИТ. Проведение исследования одобрено локальным этическим комитетом ГБОУ ВПО АГМУ Минздрава России.
Наряду со стандартными методами обследования, регламентированными приказами, в первом триместре у всех участниц исследования при сроке беременности 7–8 недель определены содержание цитокинов TNF-α и IL-10, а также некоторые показатели системы фибринолиза: содержание PAI-1, t-PA, плазминогена, XII-а ЗЛ, уровень D-димеров. Состояние иммунного статуса и фибринолитические реакции на предгравидарном этапе не оценивались в связи с тем, что данный вопрос широко представлен в научной литературе, а инициатором иммуно-гемостазиологических сдвигов является именно этап инвазии трофобласта, что и определяло наш интерес.
Содержание IL-10, TNF-α определяли с помощью коммерческих тест-систем «Bender Medsystems» (Австрия). Содержание плазминогена в плазме крови определяли с помощью набора реагентов «Berichrom-Plasminogen», Siemens». При оценке уровней антигена t-PA и PAI-1 применялись наборы реагентов для иммуноферментных исследований фирмы Technoclone GmbH: t-PA Combi Actibind ELISA, Actibind PAI-1 ELISA и Antigen PAI-1 ELISA. Исследование времени XII-а ЗЛ осуществлялось с применением набора реагентов «ТехФибринолиз-тест» фирмы «Технология-Стандарт». Уровень D-димера определяли турбодиметрическим методом с помощью набора реагентов «Auto Red D-dimer 700», производитель «Helena Bioscienses». Референтные значения фибринолитической активности плазмы крови и уровня D-димеров на прегравидарном этапе и во время беременности оценивались согласно опубликованными нами ранее данными [26–28].
ЛИТ осуществляли путем введения 100–120 млн отмытых лимфоцитов мужа в 5–6 точек подкожно. Перед каждой процедурой ЛИТ супруги протестированы на сифилис, ВИЧ-инфекцию, гепатиты В и С.
Пациентки с привычным невынашиванием беременности в основной группе на этапе планирования беременности прошли рекомендуемое стандартами обследование и лечение, а также 2–3 курса ЛИТ. При констатации маточной беременности ЛИТ выполнялась с кратностью 1 раз в 21 день до 12–16 недель гестации. Побочных эффектов, осложнений при проведении ЛИТ не наблюдалось. Пациенткам с репродуктивными потерями в анамнезе в качестве гестагеновой поддержки при наступлении беременности назначали дидрогестерон или микронизированный прогестерон: 35 (50,3% из 69) и 34 (49,7% из 69) в основной группе и 36 (49,3% из 73) и 37 (50,3% из 73) в группе сравнения соответственно.
Статистическую обработку результатов исследований проводили с использованием пакета прикладных программ Statistica for Windows 6.0 и SPSS 16.0 for Windows (SPSS Inc., США). Для проверки на нормальность распределения признака использовался критерий Шапиро–Уилка (Shapiro-Wilk’s W-test). Данные лабораторных показателей представлены в виде медианы (Ме) и левых и правых границ 95% доверительного интервала (95%Cl) и квартильного интервала (Me [25–75%]). Сравнение количественных параметров в исследуемых группах осуществлялось с использованием критериев Манна–Уитни и Крускалла–Уоллеса. Для показателей, характеризующих качественные признаки, указывали абсолютное значение и относительную величину в процентах, проверку статистических гипотез о совпадении наблюдаемых и ожидаемых частот осуществляли с использованием критерия χ2 и точного критерия Фишера. Для бинарных признаков вычисляли отношение шансов (OR) и 95% доверительный интервал (CI 95%). Критический уровень значимости различий (p) определен как p<0,05.

Результаты исследования
Анализ соматического статуса в анализируемых группах соответствовал литературным данным [29]. У пациенток с привычным невынашиванием достоверно чаще по сравнению с группой контроля определены заболевания сердечно-сосудистой системы – у 124 (87,9% от 152) и 63 (69,2% от 91) пациенток соответственно (OR=2,11; 95% Cl 1,14–3,92, p<0,05); заболевания почек у 39 (27,7% от 152) и 13 (14,3% от 91) соответственно (OR=2,03; 95% Cl 1,02–4,06, p<0,05); хронические воспалительные заболевания: тонзиллит, бронхит, гайморит у 85 (60,3% от 152) и 38 (41,7% от 91) соответственно (OR=1,8; 95% CI 1,1–3,1, p<0,05); заболевания щитовидной железы у 38 (27,0% от 152) и у 13 (14,3% от 91) соответственно (OR=2,04; 95% CI 1,02–4,07, p<0,05).
Структура репродуктивных потерь в основной группе и группе сравнения была идентична, на одну пациентку приходилось 2,2 эпизода репродуктивных потерь до 12 недель беременности. Таким образом, пациентки основной группы и группы сравнения были сопоставимы по возрасту, соматическому и репродуктивному статусу, являлись однородными и репрезентативными.
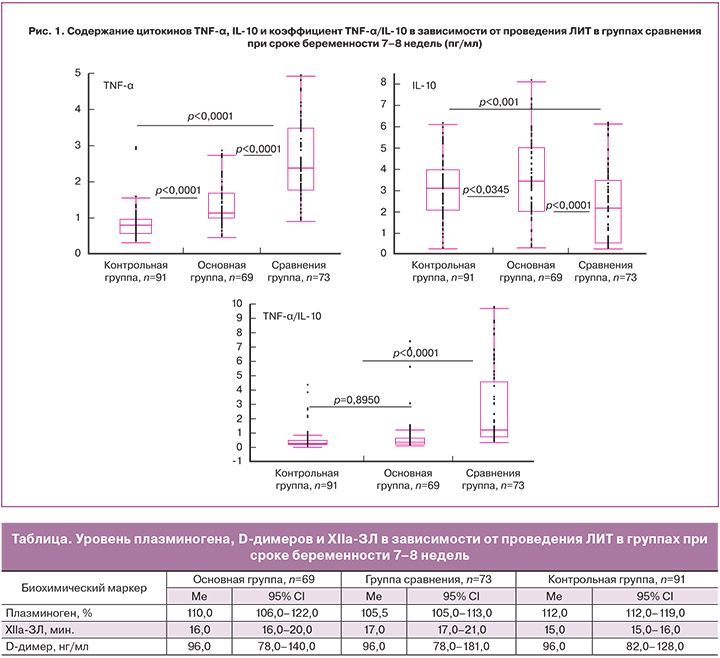
Результаты исследования показали, что у женщин в основной группе, получавших ЛИТ, содержание в плазме IL-10 было достоверно выше, чем в группе сравнения и в группе контроля (Me 3,6 пг/мл против Me 2,16 пг/мл и Me 3,13 пг/мл соответственно, p<0,0001), тогда как концентрация TNF-α в основной группе была достоверно ниже, чем в группе сравнения и достоверно выше, чем в группе контроля (Me 1,13 пг/мл против Me 2,4 пг/мл и Me 0,8 пг/мл, соответственно, p<0,0001) (рис. 1).
Расчет отношения концентрации цитокинов позволил выявить достоверное повышение показателя TNFα/IL-10 в группе сравнения (Me 1,34) по сравнению с основной (Me 0,34) и контрольной (Me 0,23) группами, и соответственно, преобладании иммунного ответа Th2-типа над Th1-типом на фоне иммуноцитотерапии у пациенток с привычным невынашиванием, сопоставимого с показателем TNFα/IL-10 контрольной группы.
Полученные нами данные при анализе показателей фибринолитической активности выявили повышение уровня и активности PAI-I в исследуемых группах по сравнению с контрольной группой. Вместе с тем назначение иммуноцитотерапии в основной группе привело к статистически значимому снижению содержания (Me 120,8 нг/мл) и активности (Me 4,8 Ед/мл) PAI-1 относительно группы сравнения (Me 142,1 нг/мл и Me 5,7 Ед/мл соответственно), не достигая показателей контрольной группы (Me 106,7 нг/мл и Me 4,3 Ед/мл соответственно) (рис. 2).
Уровень t-PA был сопоставим в основной (Me 3,6) и контрольной (Me 3,83) группах, в группе сравнения (Me 3,06) он был достоверно ниже. Для визуализации полученных данных был проведен расчет отношения уровней t-PА к PAI-1 в группах исследования. Данный показатель снижался в группе сравнения (Me 0,46) и был достоверно меньше по сравнению с основной (Me 0,78) и контрольной (Me 1,04) группами.
Оценка уровня плазминогена в плазме крови показала отсутствие достоверных изменений (p=0,2215) в основной и контрольной группах, тогда как в группе сравнения отмечалось умеренное снижение концентрации плазминогена, по сравнению с группой контроля (p=0,0016). Изменение концентрации плазминогена в группах женщин с привычным невынашиванием статистически не значимо (р=0,0510) (таблица).
Наряду с исследованием отдельных участников фибринолиза был изучен интегральный показатель фибринолитических реакций – XIIа ЗЛ, методика которого описана в руководстве З.С. Баркагана и А.П. Момота [27]. В нашем исследовании XIIа-ЗЛ в исследуемых группах было сопоставимо.
Анализ течения первого триместра беременности показал, что ранние репродуктивные потери встречались в контрольной группе у 2 беременных (2,2% от 91); в основной – у 5 (7,2% от 69); в группе сравнения – у 6 (8,2% от 73) женщин без статистической разницы. У пациенток с привычным невынашиванием, не получавших в первом триместре иммуноцитотерапию, по отношению к основной группе статистически достоверно чаще отмечались кровянистые выделения из половых путей – 18 (24,0% от 73) и 9 (11,8% от 69) соответственно (OR=2,51, 95% CI 1,04–6,06, p<0,05).
Течение третьего триместра осложнилось развитием преэклампсии средней/тяжелой степени у пациенток группы контроля в 1 случае (1,1% от 91), у беременных основной группы в 2 эпизодах (2,8% от 69). В группе сравнения преэклампсия диагностирована у 7 (9,6% от 73) женщин, что больше, чем основной (OR=0,28, 95% CI 0,06–1,4, p>0,05) и контрольной (OR=0,1, 95% CI 0,01–0,87, p<0,05) группах.
В основной группе досрочно, в 36 недель, путем операции кесарева сечения родоразрешена 1 (1,4% от 69) пациентка в связи с преэклампсией тяжелой степени. В группе сравнения до срока оперативно родоразрешены 5 (5,8% от 73) беременных (p>0,05): 3 – при сроке беременности 35–36 недель в связи с преэклампсией тяжелой степени и 2 – при сроках беременности 29 и 33 недели по причине декомпенсации функции плаценты. Перинатальных потерь в анализируемых группах не было.
Вес детей при рождении в контрольной и основной группах был соизмерим: 3454,4±395,4 г и 3345,4±377,1 г (p>0,05) соответственно и статистически значимо больше, чем в группе сравнения – 3030,9±552,7 г (p<0,05). Задержка развития плода (ЗРП) в группе контроля определена в 4 случаях (4,4% от 91), при среднем массо-ростовом индексе (МРИ) данных новорожденных 56,1±1,2. На фоне проводимой иммуноцитотерапии у пациенток с репродуктивными потерями в анамнезе ЗРП диагностирована у 6 пациенток (8,2% от 69), МРИ – 56,1±2,8, что сопоставимо с группой контроля (OR=0,51, 95% CI 0,14–1,89, p>0,05) и статистически значимо меньше, чем в группе сравнения – 14 эпизодов ЗРП (20,3% от 73) (OR=0,35, 95% CI 0,13–0,97, p<0,05), при среднем МРИ новорожденных с ЗРП 48,3±3,1.
Обсуждение
Проведение ЛИТ на этапе планирования беременности и в I триместре статистически достоверно снижает частоту ЗРП с 20,3 до 8,2% (OR=0,35; 95% CI 0,13–0,97; p<0,05), уменьшает частоту умеренной и тяжелой преэклампсии с 9,6 до 2,8% (OR=0,28; 95% CI 0,06–1,4; p>0,05). В проведенном исследовании снижение числа ранних репродуктивных потерь при проведении ЛИТ не выявлено.
У пациенток с привычным невынашиванием беременности назначение ЛИТ на прегравидарном этапе и в I триместре беременности сопровождается изменениями иммунных реакций: повышается уровень IL-10 (Me 3,46 против Ме 2,16; р=0,0001), снижается содержание TNF-α (Ме 1,13 против Ме 2,4; р=0,0001).
При проведении ЛИТ пациенткам с репродуктивными потерями в анамнезе отмечено изменение фибринолитических реакций. Статистически значимое снижение уровня PAI-1 (Me 120,8 нг/мл против Me 142,1 нг/мл, р=0,0001) и его активности (Me 4,8 Ед/мл против Me 5,7 Ед/мл, р=0,0173), повышение содержания t-PA (Me 3,6 нг/мл против Me 3,06 нг/мл, р=0,0413), приближение соотношения t-PА/PAI-1 к значению в контрольной группе.
Заключение
Полученные данные могут быть использованы для формирования групп риска по гестационным осложнениям и позволяют рассматривать терапию аллогенными лимфоцитами партнера как профилактическое мероприятие поздних осложнений беременности.



