Синдром гиперстимуляции яичников (СГЯ) является наиболее грозным осложнением программ вспомогательных репродуктивных технологий, почти 2% клинически значимых форм ятрогенного синдрома требуют госпитализации ввиду усугубления степени тяжести синдрома и риска развития фатальных последствий [1]. На современном этапе большинство исследователей признают, что главной причиной развития синдрома является повышение сосудистой проницаемости [2]. Этот феномен формируется на фоне экзогенного введения гонадотропинов как ответ гранулезо-лютеиновых клеток в течение первых 48 ч после введения овуляторной дозы человеческого хорионического гонадотропина, в результате чего происходит увеличение экспрессии мРНК сосудистого эндотелиального фактора роста (СЭФР) и повышение его концентрации [3].
Свои функции СЭФР осуществляет через два основных тирозинкиназных рецептора на клетках эндотелия: первый тип рецептора СЭФРР1(Flt-1, VEGF-R1) и второй – СЭФРР2 (KDR, VEGF-R2) [4].
KDR является основным рецептором, через который осуществляется реализация основных функций СЭФР, связанных с ростом, проницаемостью сосудов, выживаемостью клеток, в том числе с ангиогенезом в период эмбрионального развития [5].
Механизм формирования сосудистой проницаемости образуется за счет транспорта макромолекул из кровеносного русла в ткани через трансмембранные каналы эндотелиальных клеток. После связывания СЭФР с его рецептором второго типа нарушается организация межклеточных контактов, образованных сосудистыми кадгеринами или (VE)-кадгеринами соседних клеток, что приводит к повышению сосудистой проницаемости [6]. Рецептор Flt-1 предположительно играет роль блокатора при связывании СЭФР и KDR, тем самым регулирует его биологическую активность. СЭФР является одним из самых сильных индукторов сосудистой проницаемости.
В настоящее время вопросы профилактики СГЯ продолжают изучаться и напрямую связаны с поиском лекарственных препаратов, воздействующих на уменьшение сосудистой проницаемости. Агонисты D2-допаминовых рецепторов обладают таким свойством. Впервые в 2001 г. была отмечена способность каберголина снижать вероятность развития СГЯ у пациенток высокого риска этого осложнения [7]. Однако анализ данных литературы, касающихся профилактических возможностей каберголина, не демонстрирует четких представлений о системном действии препарата на патофизиологические механизмы СГЯ.
Целью настоящего исследования стала оценка влияния каберголина на маркеры сосудистой проницаемости (СЭФР, СЭФРР1, СЭФРР2) в сыворотке крови у женщин с высоким риском развития СГЯ.
Материал и методы исследования
Комплексное клинико-лабораторное обследование было проведено 168 женщинам, находящимся на лечении в программе ЭКО. В 1-ю группу вошли 65 женщин с риском развития СГЯ, которым в качестве профилактики развития синдрома был назначен каберголин в дозе 0,5 мг в сутки перорально со следующего дня после трансвагинальной пункции (ТВП) в течение 5 дней – до дня переноса эмбрионов (ПЭ). Курсовая доза каберголина составила 2,5 мг. 2-ю группу составили 63 аналогичные женщины, не принимавшие препарат. В ходе исследования женщины первых двух групп были разделены на подгруппы в зависимости от развития СГЯ: 1а и 2а – 38 и 30 пациенток соответственно без развития синдрома, 1б и 2б – 7 и 15 пациенток соответственно с развившимся СГЯ. В 3-ю группу (контрольную) вошли 40 женщин без факторов риска развития СГЯ и без проведения каких-либо профилактических мероприятий. Критериями включения в исследование были: возраст менее 38 лет, регулярный ритм менструаций (21–35 дней), индекс массы тела от 18 до 29, не более 2 безуспешных попыток ЭКО в анамнезе, более 15 ооцитов, полученных при ТВП яичников после завершения гонадотропной стимуляции, информированное согласие на участие в исследовании.
Для стимуляции функции яичников всем обследуемым 168 пациенткам был проведен стандартный протокол с антагонистами гонадотропин-рилизинг гормона и рекомбинантным ФСГ.
Уровень маркеров в сыворотке крови был определен в дни ТВП и ПЭ методом иммуноферментного анализа (ELISA) с использованием наборов фирмы R&D systems, США (СЭФР, СЭФРР2), Bender Medsistem, Австрия (СЭФРР1) у 45 из 65 женщин 1-й группы (38 пациенткам в 1а подгруппе, 7 – в 1б подгруппе) и у 45 из 63 женщин 2-й группы (у 30 обследуемых в 2а подгруппе и 15 – в 2б подгруппе), а также у всех 40 женщин 3-й (контрольной) группы.
Результаты исследования обрабатывали с помощью стандартного пакета статистических программ «Statistica for Windows» v. 7.0, StatSoft Inc. (США).
Результаты и обсуждение
Анализ анамнестических данных показал, что возраст пациенток составил 31,1±3,2 года в 1-й группе, 31,8±3,1 года во 2-й и 32,3±3,1 года в 3-й группе. Пациентки всех групп не отличались по соматическому и акушерско-гинекологическому анамнезу.
Ведущими причинами нарушения репродуктивной функции были: трубно-перитонеальный и сочетанные факторы бесплодия, частота которых в 1-й группе составила 41,5 и 26,5%, во 2-й группе – 36,5 и 25,3% соответственно. У женщин 3-й контрольной группы частота трубно-перитонеального бесплодия составила 42,5%, сочетанных форм – 25%.
Курсовые дозы гонадотропинов у пациенток в 1-й группе составили 1882,5±59,1 МЕ, во 2-й группе – 1916,1±54,5 МЕ, в 3-й группе – 2289,5±57,50 МЕ (р<0,0001 по сравнению с группами риска развития СГЯ). Среднее количество полученных ооцитов: 18,5±1,5 в 1-й группе, 18,7±1,4 – во 2-й группе, 7,3±0,9 – в 3-й (р<0,001).
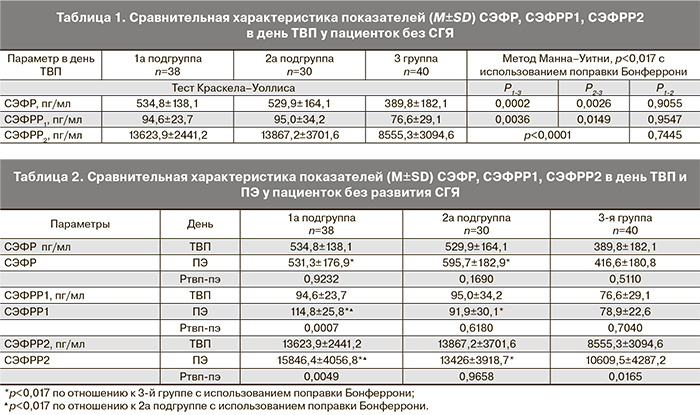
На первом этапе работы были оценены особенности маркеров сосудистой проницаемости в сыворотке крови у женщин без развития СГЯ в день ТВП (табл. 1).
Согласно данным табл. 1, к моменту забора ооцитов у женщин 1а и 2а подгрупп были выявлены достоверно высокие значения СЭФР, а также СЭФРР1 и СЭФРР2 по сравнению с аналогичными показателями женщин 3-й группы. Таким образом, активация вышеперечисленных маркеров в сыворотке крови у пациенток высокого риска развития СГЯ в день ТВП демонстрировала возможный запуск сосудистой проницаемости.
С целью оценки влияния каберголина на динамику вышеописанных показателей далее был рассмотрен уровень маркеров ангиогенеза у пациенток этих подгрупп к моменту ПЭ (5-м суткам культивирования эмбрионов) (табл. 2).
Данные табл. 2 демонстрируют активацию маркеров сосудистой проницаемости ко дню ПЭ, что характеризовалось высокими значениями СЭФР, СЭФРР1 и СЭФРР2 в сыворотке крови у женщин 1а и 2а подгрупп, независимо от приема каберголина, по отношению к значениям пациенток без факторов риска развития СГЯ. Риск развития СГЯ характеризовался высоким значением СЭФР>500 пг/мл и тенденцией к снижению свободных уровней СЭФРР1 и СЭФРР2 в сыворотке крови к дню ПЭ. Оценка внутригрупповых показателей в динамике после приема каберголина у женщин 1а подгруппы показала, что уровень СЭФР имел тенденцию к снижению по сравнению с аналогичным показателем женщин 2а подгруппы. Отличительной особенностью в день ПЭ у женщин, принимавших каберголин, было статистически значимое увеличение уровня СЭФРР1 (р=0,0007) и СЭФРР2 (р=0,0049). У женщин 2а подгруппы уровень СЭФР несколько увеличивался ко дню ПЭ при практически неизмененных высоких значениях СЭФРР1 и СЭФРР2.
У пациенток 3-й (контрольной) группы уровень СЭФР и СЭФРР1 незначительно увеличивался к дню ПЭ, в то время как показатель СЭФРР2 достоверно повышался (р=0,0165). Таким образом, анализ динамики маркеров сосудистой проницаемости в сыворотке крови на фоне профилактики каберголином демонстрирует, что действие препарата, вероятно, реализуется на системном уровне за счет повышения свободного уровня СЭФРР1, СЭФРР2 в сыворотке крови.
При оценке клинической эффективности каберголина признаки СГЯ были выявлены у 7 (10,7%) (1б подгруппа) из 65 женщин 1-й группы и у 19 (30,1%) (2б подгруппа) из 63 пациенток 2-й группы (p=0,0315). В структуре развившегося СГЯ у 17 женщин отмечена средняя степень тяжести, у 9 – тяжелая. Особый интерес представляла сравнительная характеристика маркеров сосудистой проницаемости у пациенток с развитием СГЯ (табл. 3).
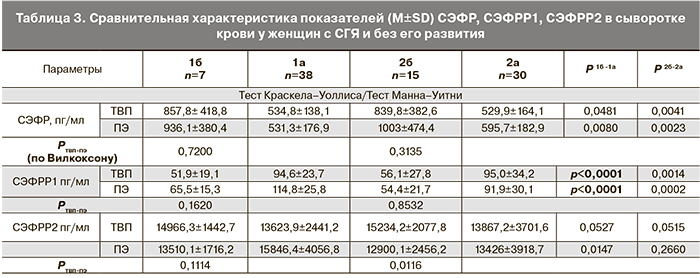
Данные табл. 3 показывают, что манифестация СГЯ сопровождалась более высоким значением одного из главных предикторов развития синдрома – СЭФР, как в день ТВП, так и в день ПЭ (р<0,05) по отношению к аналогичному показателю пациенток без признаков синдрома. Кроме того, у женщин с симптомами СГЯ отмечен более низкий уровень СЭФРР1 в дни ТВП и ПЭ по отношению к значениям пациенток без развития синдрома (р<0,001). Манифестация СГЯ происходила на фоне высокого уровня СЭФРР2 в день ТВП и его снижения ко дню ПЭ, в то время как у женщин без СГЯ, принимавших каберголин, отмечена обратная динамика. Так СГЯ развивался при уровне СЭФР>800 пг/мл, СЭФР1<70 пг/мл и отрицательной динамики СЭФР2 к дню ПЭ.
Результаты проведенного исследования показали, что профилактическое назначение каберголина позволило уменьшить общее количество случаев СГЯ в 3,6 раза. Снижение абсолютного риска (САР или ARR) развития ранней формы СГЯ средней степени тяжести на фоне приема каберголина составило 14% (95% ДИ 3–27%), для поздних и тяжелых форм – 5% (95% ДИ 5–16%).
Обсуждая результаты настоящего исследования, касающиеся особенностей динамики маркеров сосудистой проницаемости у обследуемой когорты женщин, мы обратились к данным более ранних работ, посвященных взаимосвязи концентрации маркеров ангиогенеза в сыворотке крови и развития СГЯ.
E. Pau в 2006 г. [8] и D. Petrovski в 2012 г. [9] представили данные о роли рецепторов СЭФР в сыворотке крови в манифестации синдрома. Авторы исследовали роль повышения уровня СЭФРР1 в развитии ранних форм СГЯ и отметили, что у женщин, имеющих высокий уровень этого показателя, синдром не манифестирует [8]. В то же время в клиническом наблюдении D. Petrovski был проведен анализ низких значений уровня СЭФРР2, который характерен для пациенток с тяжелой формой СГЯ, что косвенно демонстрировало высокую степень связывания СЭФР и рецептора второго типа на клеточном уровне [9].
Принимая во внимание результаты настоящего исследования, можно предположить, что пациентки с риском развития СГЯ без медикаментозной блокады каберголином имеют более низкую концентрацию растворимых форм рецепторов СЭФР как первого, так и второго типов в сыворотке крови, что характеризует их высокую степень связывания с СЭФР на клеточном уровне и готовность к повышению сосудистой проницаемости, а следовательно, и манифестации синдрома.
Таким образом, можно предположить, что назначение каберголина при риске развития СГЯ на системном уровне приводит к повышению уровня растворимых форм рецепторов СЭФР в сыворотке крови, связывающих СЭФР. Это объясняет снижение его биологической активности и торможение патофизиологических реакций в виде снижения сосудистой проницаемости у данного контингента больных. В этом контексте растворимые формы рецепторов как первого, так и второго типов могут выступать как модуляторы активности СЭФР. Этот механизм каберголина способен оптимизировать процесс сосудистой проницаемости при риске развития СГЯ и таким образом воздействовать на основное звено в запуске каскада патофизиологических реакций. Следовательно, назначение каберголина способствует поддержанию оптимального баланса между растворимыми формами рецепторов СЭФР первого и второго типов, регуляции биологической активности СЭФР и сохранению физиологического механизма сосудистой проницаемости. Наибольший превентивный эффект каберголина в группах высокого риска развития СГЯ отмечен для уменьшения вероятности развития ранних форм средней степени тяжести синдрома.



