Малая масса тела новорожденных (ММН) при рождении ассоциирована с высокой частотой неонатальной заболеваемости и смертности, а также, возможно, с повышенной частотой заболеваемости во взрослом возрасте [1–5]. Некоторые тяжелые металлы, в частности кадмий (Cd) и свинец (Pb), могут оказывать влияние на рост и развитие плода, что было продемонстрировано в ряде исследований [6–13]. Pb и Cd являются повсеместно распространенными токсикантами, которые занимают 2-е и 7-е место в списке токсичности CERCLA, состоящего их 275 веществ [14]. В Пармской декларации Pb и Cd признаны приоритетными репродуктивными антропогенными химическими веществами (АХВ) [15].
Для территории России характерно большое разнообразие климатических условий, определяющих потенциал загрязнения атмосферы (ПЗА). Город Чита, расположенный в условиях горно-котловинного рельефа местности, имеет высокий ПЗА, что связано с постоянным застоем воздушных масс. Ведущее место в загрязнении воздуха в Чите занимает автомобильный транспорт, количество которого на территории города ежегодно увеличивается. В процессе работы автомобильный транспорт выделяет вместе с отработавшими газами токсичные вещества, в том числе Pb и Cd.
Pb может попадать в организм с продуктами питания, табачным дымом, пылью, красками. В настоящее время есть данные о токсическом воздействии на плод концентраций Pb<5 мг/дл [16]. Неблагоприятное воздействие свинца на плод проявляется в задержке роста плода (ЗРП), малой массе тела, патологии и пороках развития новорожденных [2, 6, 13, 17]. Однако есть данные, не подтверждающие влияние Pb на развитие ЗРП [12, 16, 18].
Cd попадает в организм с пищей (злаки, морепродукты, грибы) или при курении. Особенность Cd состоит в том, что он медленно выводится из организма, и длительное поступление даже небольших доз может привести к развитию нарушений различных систем взрослого организма или появлению врожденных нарушений и пороков развития у потомства [3, 7–12]. Установлено, что пренатальный и неонатальный периоды являются столь чувствительными к токсическому воздействию Cd, что даже незначительная его концентрация, проникающая к плоду, может стать причиной увеличения количества мутаций и пороков развития [19]. Региональное бюро ВОЗ рекомендовало определять Cd в моче или крови матери [20]. Тем не менее, в литературе нет достаточно информации о влиянии Cd на течение беременности. Известно, что Cd способен аккумулироваться в плаценте и проникать к плоду. При этом концентрация Cd в пуповинной крови прямо пропорциональна концентрации Cd, поступившему в организм матери во время беременности [21]. В научной литературе накапливаются доказательства того, что существует связь между воздействием Cd на организм матери и ЗРП [7–10]. Однако эти исследования отличаются низкой доказательностью ввиду малого объема выборки, а также разной силой корреляции между воздействием и изучаемым исходом. Также в ряде исследований были получены противоречивые данные об отсутствии ассоциации между уровнем Cd в крови матери и размерами плода [11, 12].
На основании этого целью исследования стало изучение взаимосвязи между пренатальной экспозицией Рb и Cd и ММН.
Материалы и методы исследования
В популяционное одномоментное исследование были рекрутированы 242 родильницы, отобранные случайным образом из популяции беременных женщин, поступивших для родоразрешения в родильные дома Читы, родившие на сроке более 32 недель гестации. Критериями включения были возраст от 20 до 40 лет и проживание в Чите и Читинской области не менее 5 лет. Женщины с пороками развития плода, многоплодием, сахарным диабетом, преэклампсией/эклампсией не включались в исследование. Все пациентки подписали информированное согласие на участие в исследовании. На основании массы тела новорожденных были сформированы 2 группы: группа 1 (n=108) – пары мать-новорожденный с ММН для соответствующего гестационного возраста, группа 2 (n=134) – пары мать-новорожденный с нормальной массой тела новорожденных (НМН) для соответствующего гестационного возраста. ММН для соответствующего гестационного возраста устанавливалась, если масса тела при рождении была ниже 10-го перцентиля распределения массы для данного гестационного возраста (МКБ-10, Р05,0). Гестационный возраст рассчитывался путем вычитания даты первого дня последней менструации из даты родов. Масса тела новорожденных замерялась при помощи электронных весов с точностью 10 г.
Производилось анкетирование пациенток с уточнением демографических, клинико-анамнестических и наследственных факторов риска развития ММН, в качестве которых рассматривались следующие: возраст, социальный статус, образование, курение, прием алкоголя, профессиональные вредности, диета, гинекологические и соматические заболевания, осложнения и заболевания во время настоящей беременности.

В первые сутки после родов производился забор суточной мочи матерей и их новорожденных детей в стерильную химически чистую посуду. Из суточного сбора отбиралось 10–20 см3 мочи в химически чистые пластиковые контейнеры. В течение 3–5 суток пробирки транспортировались в лабораторию ФГУЗ Центр гигиены и эпидемиологии в Забайкальском крае. Хранение и транспортировка пробирок осуществлялась при температуре –200С. Исследование Pb и Cd в моче производилось методом атомной абсорбционной спектрометрии [4–5]. Пределом обнаружения Pb была концентрация 0,0012 мг/л, Cd – 0,0004 мг/л.
Для статистического анализа использовался пакет статистических программ STATISTICA10 (США). Расчет объема выборки был основан на данных литературы о корреляции между массой тела новорожденного и пренатальной экспозицией Cd [8]. Для получения валидных данных при принятии уровня альфа 0,05, уровня достоверности исследования 90%, коэффициента корреляции 0,309 с учетом 10% выбывания участников из исследования было достаточно включения 115 пациентов в каждую группу.
Первичной конечной точкой был пороговый уровень Pb/Cd в моче пар мать/новорожденный в зависимости от выявления ММН. Вторичными конечными точками были: средние значения уровня Pb и Cd (в моче беременных и новорожденных) в сравниваемых группах, корреляционная зависимость между Pb/Cd в моче мать/ребенок и массой тела новорожденных, а также скорректированное отношение шансов (ОШкор) с 95% доверительным интервалом (ДИ) развития ММН на основании уровня Pb и Cd в моче исследуемых пар.
Статистический анализ проводился с применением χ2-теста для сравнения частотных показателей в 2 группах, t-теста или теста Манна–Уитни для сравнения непрерывных величин в 2 группах в зависимости от нормальности распределения данных, а также многофакторного регрессионного анализа (логистической регрессии) для расчета отношения шансов развития ММН и построения ROC-кривой. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Исследование было одобрено этическим комитетом ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Результаты исследования
Средний возраст включенных в исследование женщин составил 26,07±5,3 и 26,3±5,7 года в группах 1 и 2 соответственно (р>0,05). 60% женщин были первородящие, а у повторнородящих было не более двух родов в анамнезе. При анализе демографических, клинико-анамнестических и наследственных данных, как возможных конфаундеров развития ММН, было выявлено, что группы статистически значимо отличались по возрасту менархе, частоте олигоменореи, числу осложнений предыдущих беременностей, гинекологической заболеваемости, частоте хронического тонзиллита, числу заболеваний желудочно-кишечного тракта и аллергических заболеваний. В группе 1 было больше курящих женщин. Также течение беременности в группе 1 характеризовалось большим числом острых респираторно-вирусных инфекций (ОРВИ) (табл. 1).
Средний гестационный возраст новорожденных детей составил в группе 1 – 38,2±1,3 недели (от 37 до 41 недели), в группе 2 – 39,7±0,9 недели (от 35 до 41 недели) (р<0,0001). При этом большее число недоношенных детей наблюдалось в группе с НМН: 2 ребенка (1,9%) в группе 1 и 39 (29.1%) детей в группе 2 (p<0,0001). В целом, несмотря на большее число доношенных беременностей, новорожденные в группе 1 характеризовались меньшим ростом, массой тела и более низкой оценкой по шкале Апгар по сравнению с группой 2. Масса тела детей в группе 1 в среднем составляла 2282,1±148,5 г (от 1850 до 2490 г), в группе 2 – 2812,4±564,3 г (от 1820 до 3860 г) (табл. 2).
При оценке среднего уровня Pb и Cd в моче женщин и новорожденных была выявлена статистически значимая более высокая концентрация Pb в моче матерей и детей и Cd в моче детей в группе с ММН. Для групп 1 и 2 соответственно эти концентрации составили 0,014±0,011 и 0,006±0,007 мг/л для Pb в моче матерей, 0,011±0,07 и 0,006±0,006 мг/л для Pb в моче детей, 0,006±0,002 и 0,003±0,003 мг/л для Cd в моче детей (р<0,0001). Содержание Cd в моче матерей не отличалось значимо между группами женщин и составило 0,015±0,09 и 0,003±0,003 мг/л в группах 1 и 2 соответственно (р=0,1468) (рис. 1).
В целом, в когорте наблюдаемых пациенток была выявлена значимая отрицательная корреляция между содержанием Pb в моче матерей и массой тела новорожденных, Pb в моче новорожденных и их массой тела (r= –0,5954, r= –0,6369 соответственно, p<0,01), а также между содержанием Cd в моче новорожденных и их массой тела (r= –0,8745, p<0,01). Содержание Cd в моче матерей не коррелировало с массой тела новорожденных (рис. 2). Также наблюдалась сильная положительная корреляция между содержанием Pb в моче матерей и новорожденных (r=0,8823, p<0,01) и между содержанием Pb и Cd в моче новорожденных (r=0,6682, p<0,01). Корреляции между содержанием Cd в моче матерей и новорожденных не отмечалось (r=0,0804, p=0,212). Содержание Pb и Cd в материнской моче имело слабую, но значимую корреляцию (r=0,1495, p=0,020).
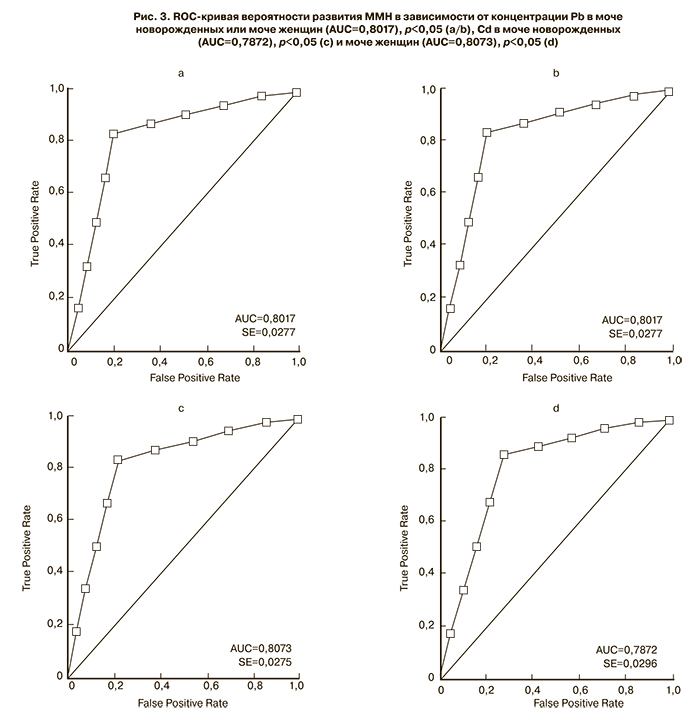
С помощью регрессионного анализа с построением ROC-кривых нами был проведен поиск пороговой концентрации Pb и Cd в материнской моче и моче новорожденных в зависимости от развития ММН. Концентрации Pb и Cd были представлены в виде бинарных величин с разделением по искомому порогу. ОШкор развития ММН с учетом значимых кофаундеров, таких как курение, олигоменорея, хронические воспалительные заболевания репродуктивной системы, хронический тонзиллит и хронические заболевания желудочно-кишечного тракта, в зависимости от концентрации Pb в моче женщин составило 7,44, 95% ДИ=3,93, 14,08; в зависимости от концентрации Pb в моче новорожденных – 7,73, 95% ДИ=4,02, 14,89; в зависимости от концентрации Cd в моче женщин – 7,91, 95% ДИ=4,13, 15,17; в зависимости от концентрации Cd в моче новорожденных детей – 7,42, 95% ДИ=3,89, 14,14. Пороговое значение концентрации Pb в моче женщин составило 0,0055 мг/л, в моче детей – 0,0059 мг/л. Чувствительность ROC-модели при этом составила 76,8%, специфичность – 84,3%, AUC (площадь под кривой) – 0,8017. Пороговое значение концентрации Cd в моче новорожденных составило 0,0057 мг/л с чувствительностью построенной ROC-модели 78,7%, специфичностью 75,4%, AUC 0,7872. Пороговое значение концентрации Cd в материнской моче составило 0,0035 мг/л с чувствительностью построенной ROC-модели 77,7%, специфичностью 82,8%, AUC 0,8073 (рис. 3).
Обсуждение
Малая масса тела детей при рождении является важной медицинской проблемой во всем мире. Это состояние связано с повышенной неонатальной и младенческой заболеваемостью и смертностью, а также с повышенным риском заболеваемости во взрослом возрасте, в частности сердечно-сосудистыми заболеваниями и ожирением (теория Баркера) [1]. Одной из причин развития ММН может быть экспозиция во время беременности к различным АХВ, в частности к тяжелым металлам. Мы определили, что у детей с малой массой тела в соответствии с их гестационным возрастом, концентрация в моче Pb и Сd была значительно выше, чем у детей с нормальной массой тела. Такая же связь прослеживалась между концентрацией Pb в моче пациенток и массой тела новорожденных. Многофакторный регрессионный анализ продемонстрировал, что шансы рождения ребенка с малой массой тела увеличиваются в 7 раз при концентрации Pb в моче новорожденного более 0,0059 мг/л, Cd – более 0,0057 мг/л, Pb в моче матери – более 0,0055 мг/л.
В литературе имеются противоречивые данные о взаимосвязи концентрации Cd в моче и крови матери и массой тела новорожденных [7–12]. При этом выводы о наличии связи между уровнем Cd в пуповинной крови и осложнениями беременности однозначны [11, 12]. Нами не было обнаружено статистически значимой корреляции между массой тела новорожденных и концентрацией Cd в моче пациенток. Также не было отмечено корреляции между содержанием Cd в моче женщин и детей. Однако в регрессионном анализе был выявлен статистически значимый порог концентрации Cd в моче женщин, который составил 0,0035 мг/л, что было несколько ниже, чем в моче новорожденных детей. Эти данные противоречат имеющимся данным литературы о взаимосвязи между показателями содержания тяжелых металлов в материнской моче, кровотоке и пуповинной крови, а также более высоком содержания Cd в моче матерей по сравнению с мочой новорожденных [22, 23]. Причиной более низкого диагностического порога Cd в моче матерей по сравнению с мочой новорожденных может быть способность этого АХВ накапливаться в плаценте и достигать значимого порога концентрации при значительном и длительном накоплении к концу беременности. Этим также может объясняться отсутствие значимой корреляции содержания Cd в моче матерей и моче детей.
Известно, что негативное влияние Cd на плод прежде всего обусловлено концентрацией вещества, проникшего через плацентарный барьер [24, 25]. При этом возможным механизмом повреждающего действия Cd является конкуренция с цинком (Zn), трансплацентарный транспорт которого при повышении концентрации первого нарушается. Так как недостаточное поступление Zn к плоду приводит к развитию таких осложнений беременности, как преждевременные роды и ЗРП, этот механизм сейчас считается одним из основных механизмов повреждающего действия Cd на плод [7]. Другим патогенетическим механизмом негативного влияния Cd на плод может быть снижение экспрессии и активности в плаценте 11β-гидроксистероид дегидрогеназы 2-го типа (11β-HSD2) путем супрессии транскрипции гена HSD11B2, что было продемонстрировано in vitro. Фермент 11β-HSD2 играет ключевую роль в росте и развитии плода путем участия в обмене кортизола [26]. Механизм повреждающего действия Pb на плод может быть также связан с конкуренцией за трансплацентарный трансфер с Zn, снижением уровня железа и плацентарных гормонов [13]. В данном исследовании мы не измеряли уровень Zn в крови пациенток и их новорожденных детей. Данное исследование планируется для изучения механизма влияния Pb и Cd на развитие ЗРП и ММН.
Одной из причин повышенного поступления Cd и Pb в организм беременных с ЗРП могло быть курение. Число курящих женщин в группе с ММН было статистически значимо выше по сравнению с группой с НМН. Также отмечалась положительная корреляция между числом курящих женщин и концентрацией Pb и Cd в моче пациенток и моче новорожденных (r=0,2799–0,3782, p<0,0001). Повышенная экспозиция к данным АХВ могла также быть связана с особенностями питания беременных женщин, хотя нами не была обнаружена статистически значимая разница в диетических предпочтениях пациенток двух групп.
Вывод
Более высокая концентрация Pb и Cd в моче новорожденных детей, а также Pb в моче их матерей связана с повышенным риском рождения детей с малой массой тела.



